La cuenca del Río Santa Lucía (CRSL) es la principal fuente de abastecimiento de agua potable para la población de Uruguay y en ella existe un importante uso del herbicida glifosato (GLY). El objetivo de este trabajo fue realizar un monitoreo preliminar de GLY y su metabolito ácido aminometilfosfónico (AMPA) en aguas superficiales (AS) de la cuenca, en agua bruta (AB) y en agua potable (AP) de la planta potabilizadora de Aguas Corrientes (PPAC). Se analizó GLY y AMPA en 121 muestras tomadas en el período de agosto a diciembre del 2020, 33 fueron de AB de la PPAC, 33 de AP y 55 de AS de la CRSL. Se encontró que, en AB y AP, GLY y AMPA dieron resultados no cuantificables y cumplen con las recomendaciones y regulaciones nacionales respectivamente. En AS se detectaron y cuantificaron GLY y AMPA en la subcuenca del arroyo Canelón Chico con valores inferiores a 1 µg/L. Estos valores cumplen con las recomendaciones nacionales para aguas naturales, no así con las regulaciones de la Unión Europea. Por otra parte, este hallazgo indica que la subcuenca del arroyo Canelón Chico es uno de los afluentes de menor calidad de la CRSL.
Palabras clave: herbicidas, proceso de potabilización, contaminación difusa.
A bacia do Rio Santa Lúcia (CRSL) é a principal fonte de abastecimento de água potável para a população do Uruguai, e há um uso significativo do herbicida glifosato (GLY) dentro dela. O objetivo deste estudo foi realizar um monitoramento preliminar de GLY e seu metabólito ácido aminometilfosfônico (AMPA) em águas superficiais (AS) da CRSL, na captação (Água Bruta, AB) e na água potável (AP) da estação de tratamento de água potável de Aguas Corrientes (PPAC). GLY e AMPA foram analisados em 121 amostras coletadas de agosto a dezembro de 2020, das quais 33 eram AB da PPAC, 33 eram AP e 55 eram AS da CRSL. Verificou-se que em AB e AP os resultados para GLY e AMPA não puderam ser quantificados, cumprindo as recomendações e regulamentos nacionais, respetivamente. No entanto, em AS, GLY e AMPA foram detectados e quantificados na sub-bacia do riacho Canelón Chico, com valores abaixo de 1 µg/L. Esses valores estão em conformidade com as regulamentações nacionais para águas naturais, mas não com as regulamentações da União Europeia. Além disso, essa descoberta indica que a sub-bacia do riacho Canelón Chico é um dos afluentes menos preservados da CRSL.
Palavras-chave: herbicidas, processo de tratamento de água, poluição difusa.
Introducción
El glifosato (GLY) es un herbicida de amplio uso a nivel mundial tanto en agricultura como en áreas urbanas. Es el herbicida de mayor uso en Uruguay, con volúmenes anuales de importación superiores a 7000 toneladas de ingrediente activo (Uruguay. Ministerio de Ganadería Agricultura y Pesca, 2020). Por esta razón es considerado prioritario en la lista de plaguicidas prioritarios para la gestión ambiental, realizada por la Dirección Nacional de Calidad y Evaluación Ambiental (Uruguay. Ministerio de Ambiente. Observatorio Ambiental Nacional, 2021).
Es empleado como herbicida sistémico de amplio espectro y rápida acción, particularmente asociado a la expansión de cultivos genéticamente modificados tolerantes al mismo (de Castilhos Ghisi et al., 2020). El mecanismo de acción consiste en la inhibición de la enzima 3-enolpiruvilsikimato-3-fosfato sintasa, lo cual interfiere en la biosíntesis de aminoácidos utilizados en la síntesis de proteínas (Roberts et al., 1998). Esta enzima forma parte de la vía metabólica del ácido shikimico, presente en plantas, hongos y bacterias, pero no en animales (Roberts et al., 1998). Sin embargo, existen controversias en relación con su clasificación como posible carcinógeno desde el año 2015 (International Agency for Research on Cancer, 2015) y posteriores reevaluaciones de su toxicología (United States Environmental Protection Agency, 2016). El uso sostenido de este compuesto en la agricultura convencional ha aumentado el interés sobre los potenciales riesgos a la salud humana y al ambiente (de Castilhos Ghisi et al., 2020; Zhang et al., 2022; Bo Liu et al., 2022; Maggi et al., 2020; World Health Organization, 2017).
A nivel nacional, la Norma UNIT 833:2008 (Instituto Uruguayo de Normas Técnicas, 2008) establece para agua potable (AP) el valor máximo permitido de GLY + ácido aminometilfosfónico (AMPA) en 700 µg/L. Para aguas naturales, las recomendaciones nacionales proponen 65 µg/L de GLY (Uruguay. Ministerio de Ambiente. GESTA. Grupo de Estándares Ambientales - Agua, 2014).
En tanto, las reglamentaciones internacionales, como la guía para la protección de la vida acuática canadiense, proponen valores de GLY máximos en agua superficial (AS) de 800 µg/L en una exposición a corto plazo y de 27.000 µg/L en una exposición a largo plazo (Canadá. Canadian Council of Ministers of the Environment, 2012). La reglamentación brasilera establece 280 µg/L como valor máximo permitido para AS de clase III (Brasil, 2005).
Si bien el GLY no es listado como un plaguicida prioritario en la Unión Europea y no dispone de un valor máximo permisible explícito, la normativa europea vigente establece un criterio general para plaguicidas individuales y sus metabolitos de 0,1 µg/L y una sumatoria de plaguicidas totales presentes en la muestra que debe ser inferior a 0,5 µg/L (Unión Europea, 2020).
Por otra parte, los valores máximos permitidos según las reglamentaciones nacionales no necesariamente aseguran que no exista un riesgo para los organismos acuáticos. Algunos estudios muestran que concentraciones de GLY por debajo de 0,1 µg/L implican un riesgo bajo para los organismos acuáticos, mientras que por encima de 1 µg/L representan un riesgo alto (Brovini et al., 2021). Estudios en la región han reportado riesgos significativos a concentraciones máximas de 70 µg/L y 125 µg/L de GLY en el agua (Bonansea et al., 2017). A nivel nacional, el estudio realizado por Corrales (2018) muestra que el GLY puede generar cambios en la composición de la comunidad de diatomeas. Guilherme et al. (2010) demostró que concentraciones de 18 µg/L y 36 µg/L de GLY suponen un riesgo para la salud de las poblaciones de los peces.
La movilidad de los plaguicidas hacia el ambiente acuático ocurre fundamentalmente por deriva, procesos erosivos y de escorrentía superficial que favorecen la llegada de estos compuestos a los cursos de agua (Gelós et al., 2020). La persistencia del GLY en suelos depende de las condiciones climáticas y del tipo de suelo. Su movilización y descomposición dependen de la estructura del suelo, cantidad y calidad de la materia orgánica, temperatura, pH, y tipo de arcilla, entre otros (González y Fuentes, 2022., Muskus et al., 2020).
La transformación microbiológica aeróbica del GLY ha sido identificada como la principal vía de degradación, generando el metabolito ácido aminometilfosfónico (AMPA) (Guijarro et al., 2018). AMPA presenta tiempos de vida media en suelo y agua mayores al GLY, por lo que también interesa conocer su ecotoxicidad y sus niveles en el ambiente (Sun et al., 2019; Ivantsova et al., 2022; Bonansea et al., 2017).
La cuenca del Río Santa Lucía (Uruguay, CRSL) se caracteriza por ser la fuente de agua de la principal planta potabilizadora del país, la Planta Potabilizadora de Aguas Corrientes (PPAC). La PPAC está ubicada en el departamento de Canelones (34°31’07”S, 56°23’39”W), potabiliza el agua que abastece a Montevideo y su zona metropolitana, con aproximadamente 1.700.000 de habitantes (Uruguay. Obras Sanitarias del Estado, 2021).
La CRSL abarca una superficie de 13.681 km2 y se ubica al sur de Uruguay, en los departamentos de Lavalleja, Canelones, San José, Montevideo, Flores y Florida. El Río Santa Lucía nace en la Cuchilla Grande, al noreste de Minas-Lavalleja, y desemboca en el Río de la Plata. Se alimenta de numerosos ríos, arroyos y cañadas, presentando un sistema hidrográfico denso (Uruguay. Ministerio de Ambiente, 2023b). La región de influencia de esta cuenca significa una importante zona agropecuaria de Uruguay, que combina la existencia de agricultura intensiva y extensiva, ganadería y lechería, entre otras actividades (Uruguay. Ministerio de Vivienda, Ordenamiento Territorial y Medio Ambiente, 2015). El estado ambiental de la cuenca hidrográfica del Río Santa Lucía ha sido reconocido como uno de los más críticos del país desde hace varios años, y por ello diversas instituciones han establecido numerosos programas de monitoreo (por ejemplo: Uruguay. Ministerio de Ambiente, 2023b).
Dentro del programa de monitoreo de la calidad de agua del Río Santa Lucía (Uruguay. Ministerio de Vivienda, Ordenamiento Territorial y Medio Ambiente, 2020), la CRSL se divide en 9 subcuencas y los monitoreos se realizan con una frecuencia bimestral en 25 estaciones de muestreo, a fin de obtener seis datos al año por punto de muestreo. Existen algunos antecedentes recientes de monitoreo de GLY y AMPA en estas subcuencas, los cuales han identificado al GLY y AMPA dentro de los contaminantes orgánicos con mayor frecuencia de detección (Uruguay. Ministerio de Vivienda, Ordenamiento Territorial y Medio Ambiente, 2020).
El objetivo de este trabajo fue realizar un monitoreo preliminar intensivo de GLY y AMPA en aguas naturales de la CRSL que impactan directamente en la toma de la PPAC y en AP en un periodo de tiempo acotado. Con esto se pretendió identificar potenciales riesgos en el suministro de AP debido al GLY y AMPA en los alfuentes inmediatos a la PPAC, lo cual es relevante desde el punto de vista del aseguramiento de la calidad del AP. Por otra parte, se buscó evaluar la eventual remoción de GLY y AMPA en el proceso de potabilización, la cual no se pudo realizar en función de los resultados obtenidos.
Con el fin de lograr la sostenibilidad del servicio de AP, es prioritario gestionar de manera integral la CRSL y en particular las fuentes de contaminación del AS para reducir los riesgos en la salud humana y la vida acuática.
Materiales y Métodos
Área de estudio y muestreo
Los puntos de muestreo fueron seleccionados para que representen las contribuciones de los diferentes afluentes de la cuenca del Río Santa Lucía (Figura 1). El punto EPS representa al Embalse Paso Severino ubicado en el Río Santa Lucía Chico, los puntos PP y SL al tramo alto y medio del Río Santa Lucía, mientras que BCC, MCC, ECG, PE y PC a la subcuenca del Arroyo Canelón Grande y Canelón Chico. Además, se muestra el mapa de usos y coberturas del suelo del año 2019 para la cuenca del Río Santa Lucia (Uruguay. Ministerio de Ambiente, 2023a). En la Figura 2 se observan las precipitaciones (medidas en la PPAC), la temperatura de muestreo (medida en agua bruta) y el nivel del río (medido en la PPAC) en el periodo de estudio (Uruguay. Obras Sanitarias del Estado, 2023).
De esta manera se realiza una descripción parcial del comportamiento del sistema en el periodo evaluado, definiendo así el escenario base de estudio.
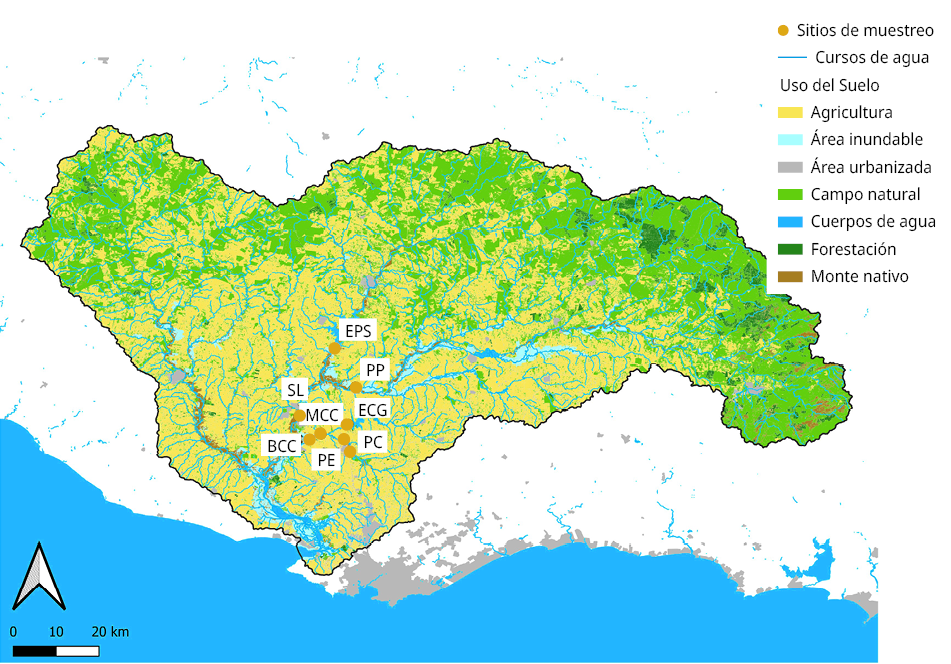
Figura 1. Mapa de usos y coberturas del suelo del año 2019 para la cuenca del Río Santa Lucia indicado con colores (Uruguay. Ministerio de Ambiente, 2023a). Los puntos anaranjados muestran los sitios de muestreo de la cuenca (AS). BCC: Arroyo Canelón Grande en Puente Belinzon (34°29’49.6”S 56°22’13.4”W); MCC: Arroyo Canelón Grande a la altura de Margat (34°29’05.2”S 56°20’27.9”W); ECG: Embalse Canelón Grande sobre Arroyo Canelón Grande (34°27’30.5”S 56°16’16.2”W); PC: Arroyo Canelón Chico en Paso Calleros (34°31’48.2”S 56°16’07.0”W); PE: Arroyo Canelón Chico en Paso Espinosa (34°29’56.0”S 56°16’55”W); SL: Río Santa Lucía en ciudad Santa Lucía (34°26’20.3”S 56°23’56.8”W); PP: Río Santa Lucía en Paso Pache (34°21’48.0”S 56°15’17.5”W); EPS: Embalse Paso Severino en Río Santa Lucía Chico (34°15’56.7”S 56°18’24.0”W).
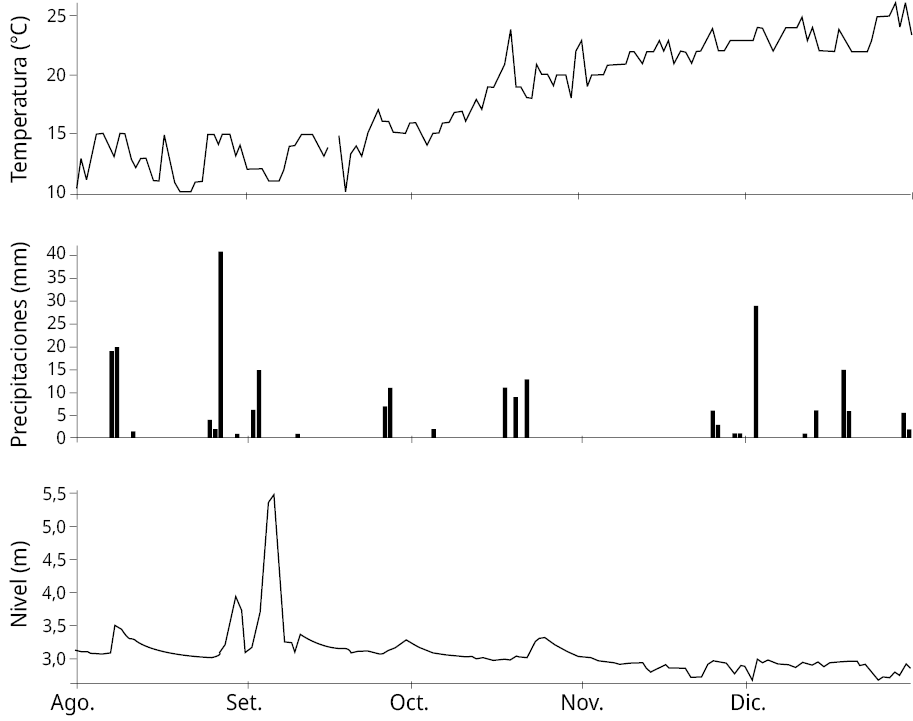
Figura 2. Temperatura (℃) del agua bruta (AB, panel superior), precipitaciones (mm en 24 horas) (panel medio) y nivel del río (m) (panel inferior) en la PPAC en función del tiempo (del 01/08/2020 al 31/12/2020).
Se colectaron 121 muestras, de las cuales 33 corresponden a agua superficial en la toma de la PPAC (Agua Bruta, AB), 33 a agua potabilizada de la PPAC (AP) y 55 a agua superficial (AS) de los afluentes inmediatos a la PPAC. La Figura 1 muestra la ubicación de estos puntos de muestreo. El muestreo fue realizado entre agosto y diciembre del 2020. Para AB y AP la frecuencia de muestreo fue: 1 muestra en agosto, 14 muestras en setiembre, y 6 muestras en octubre, noviembre y diciembre respectivamente. Para AS la frecuencia de muestreo fue: 16 muestras en octubre, 24 en noviembre y 15 en diciembre.
Cada muestra de AB se obtuvo en la entrada al sistema de la PPAC y cada muestra de AP fue colectada a la salida del sistema (punto de control rutinario del agua potable de la PPAC). Estas muestras fueron obtenidas de forma directa en tubo Falcon de polipropileno de 15 mL, y trasladadas en frío (2 - 8 ℃) al Departamento de Desarrollo Tecnológico del CURE (Centro Regional del Este, Rocha, Uruguay), donde inmediatamente fueron congeladas a -18 ℃ hasta su análisis.
Las muestras de AS de la cuenca se obtuvieron de la capa subsuperficial, las cuales fueron colectadas por el Laboratorio de la Unidad de Usinas Montevideo de Obras Sanitarias del Estado (OSE), Uruguay. Las muestras fueron tomadas con muestreadores de plástico y trasvasadas a botellas de polietileno marrones de 2 L. Previo a la colecta de las muestras, todas las botellas fueron enjuagadas dos veces con agua desionizada y tres veces con agua del punto de muestreo. En cada muestreo se tomó al menos 1 L de muestra y posteriormente se trasvasó a un tubo Falcon de polipropileno de 15 mL y se trasladó en frío (2 - 8 ℃) al Departamento de Desarrollo Tecnológico del CURE (Centro Regional del Este, Rocha, Uruguay), donde fue inmediatamente congelada a -18 ℃ hasta su análisis.
Método de análisis y preparación de muestra
La determinación de GLY y AMPA se realizó en el Laboratorio del Departamento de Desarrollo Tecnológico del CURE (Centro Regional del Este, Rocha, Uruguay) por derivatización con cloruro de fluorenilmetiloxicarbonilo (FMOC-Cl) y cromatografía liquida con detección de fluorescencia. La metodología empleada en este trabajo fue previamente reportada por Alonso et al. (2022).
Se tomó una alícuota de 3 mL de muestra de agua en un tubo Falcon de polipropileno de 50 mL. A cada muestra se le adicionó una alícuota de 15 µL de L-ácido aspártico (ASP) 10 mg/L. El tubo fue colocado en un baño de ultrasonido durante 3 minutos. Para la derivatización se agregaron 0,5 mL de Na2B4O7 25 mM, 0,5 mL de FMOC-Cl 6,0 g/L y 0,5 mL de acetonitrilo (ACN) y se agitó en vortex durante 30 segundos. Se dejó reaccionar durante 1 hora a temperatura ambiente (22 ± 3 ℃). Una vez transcurrido este tiempo, se purificó el extracto mediante una extracción líquido-líquido con diclorometano (DCM). Para ello, se agregaron 4,5 mL de DCM y se agitó con vortex durante 30 segundos. Posteriormente se tomó una alícuota de 1 mL de la fase acuosa (fase superior). Esta alícuota se cargó en jeringa descartable y se filtró mediante un filtro de PVDF de 0,45 µm (Thermo Fischer Scientific, EE. UU.) colectando en un vial de vidrio de 2 mL de automuestreador para su análisis instrumental (Alonso et al., 2022).
Reactivos y materiales
Los solventes utilizados fueron acetonitrilo (ACN), diclorometano (DCM) y metanol (MeOH) grado HPLC. En los tres casos, fueron suministrados por Merck (Darmstadt, Alemania). Se empleó agua ultrapura de un purificador de agua Smart2Pure 3 UV (Thermo Fisher Scientific, EE. UU.).
Los estándares analíticos de GLY (99,4 %), AMPA (99 %), el reactivo derivatizante cloruro de fluorenilmetiloxicarbonilo (FMOC-Cl, 99 %) y GLY-FMOC (98 %) fueron suministrados por HPC Standards (Cunnersdorf, Alemania). El L-ácido aspártico (ASP, 99 %) fue suministrado por J.T. Baker (Phillipsburg, EE. UU.) y empleado como estándar subrogado. La solucion stock de GLY, AMPA, ASP y GLY-FMOC fue preparada en agua ultrapura a una concentración de 2000 mg/L. Cada solución de trabajo se preparó en agua ultrapura diluyendo la solución stock.
Se preparó una solución de FMOC-Cl en ACN a una concentración de 6 g/L. Cada solución fue conservada en oscuridad a 4 ± 2 ℃. Los reactivos tetraborato de sodio decahidratado (Na2B4O7 · 10H2O), acetato de amonio (NH4CH3CO2) e hidróxido de amonio (NH4OH) en grado analítico fueron suministrados por Carlo Erba (Cornaredo, Italia).
Instrumental
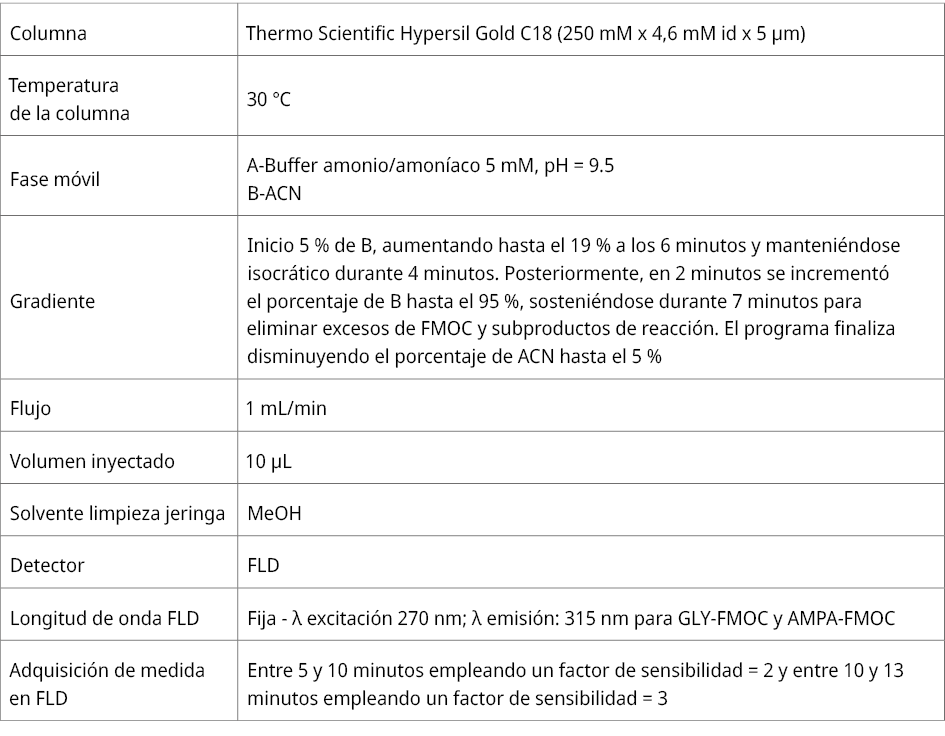
Para realizar el ajuste de pH de la fase móvil se utilizó un medidor de pH Thermo Scientific modelo Orion Versa Star. Se utilizó un baño sonicador Branson 2800. Se empleó un cromatógrafo líquido Thermo Scientific Ultimate 3000 acoplado a un detector de fluorescencia Thermo Scientific FLD 3400RS. La tabla 1 muestra las condiciones de la separación cromatográfica (Alonso et al., 2022).
Tabla 1. Condiciones cromatográficas.
Aseguramiento de la calidad
Las curvas de calibración fueron preparadas adicionando soluciones de GLY y AMPA al agua superficial. Este blanco fue previamente verificado de estar libre de estos analitos. Se fortificó cada muestra utilizando alícuotas apropiadas de soluciones intermedias de ambos compuestos preparadas en agua ultrapura. Posteriormente las curvas de calibración fueron sometidas al proceso analítico completo, por lo que estuvieron afectadas por recuperación. La técnica fue validada previamente llegando a límites de cuantificación (LOQ) de 0,25 µg/L para GLY y 0,67 para AMPA (Alonso et al., 2022). Los valores inferiores al LOQ no fueron reportados. Entre las operaciones de aseguramiento habituales se realizaron blancos de reactivos, blancos analíticos y curvas de calibración diarias en el rango 0,25-10 µg/L para GLY y 0,67-50 µg/L para AMPA. Asimismo, se realizó un gráfico de control del estándar subrogado ASP para determinar la conformidad del proceso analítico.
Resultados y Discusión
Monitoreo preliminar
Los resultados de GLY y AMPA para AB y AP acotados al período de este trabajo se encontraron por debajo del LOQ (0,25 µg/L para GLY y 0,67 µg/L para AMPA). Esto supone una baja incidencia de GLY y AMPA en la PPAC durante el período relevado bajo las condiciones ambientales del estudio. Los hallazgos de GLY y AMPA presentados en este trabajo podrían verse afectados en diferentes condiciones ambientales. Por ejemplo, la cantidad de lluvia y el tiempo transcurrido entre lluvias y muestreo puede afectar por escorrentía la concentración de GLY y AMPA en agua. El nivel del río representa una medida indirecta de la dilución generada: a mayor nivel del río, mayor cantidad de agua, y por lo tanto mayor dilución del o de los contaminantes de interés. Las condiciones ambientales implicaron un máximo de precipitaciones de 41 mm en 24 horas, un mínimo de < 1 mm en 24 horas y un promedio de 1,6 mm en 24 horas. El nivel máximo del río en la PPAC fue de 5,48 m, con un mínimo de 2,65 m y un promedio de 3,09 m. La temperatura del AB tuvo un máximo de 26 ℃, un mínimo de 10 ℃ y un promedio de 18 ℃.
La Tabla 2 muestra un resumen de los resultados encontrados para GLY y AMPA en AB y AP tomados en la PPAC, mientras que la Tabla 3 resume los resultados de GLY y AMPA en los afluentes. Dado los LOQ de las metodologías empleadas, no fue posible evaluar la eventual remoción de GLY y AMPA en el proceso de potabilización.
Tabla 2. Resumen de resultados de muestras analizadas en la PPAC y agua superficial. Se emplea el valor guía nacional en agua natural de 65 µg/L (Uruguay. Ministerio de Ambiente. GESTA. Grupo de Estándares Ambientales - Agua, 2014) para AS y AB y el Valor Máximo Permitido (VMP) de 700 µg/L para GLY + AMPA en AP (Instituto Uruguayo de Normas Técnicas, 2008).
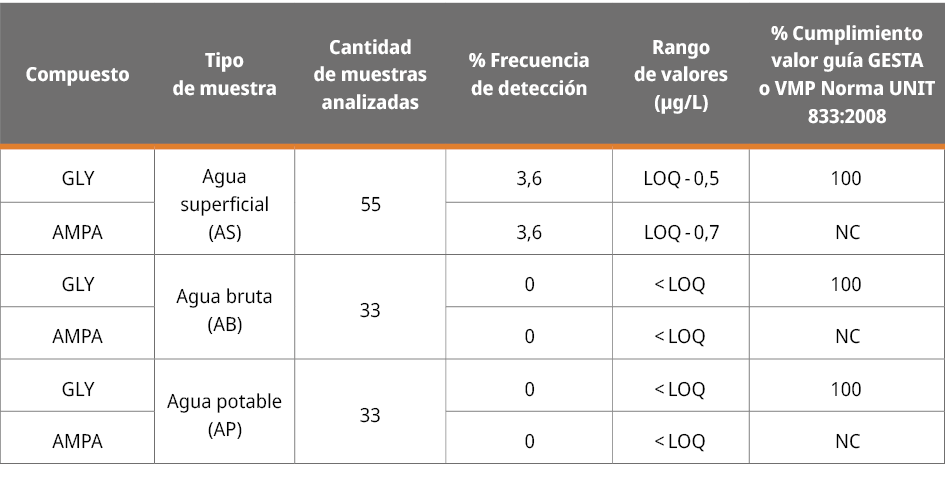
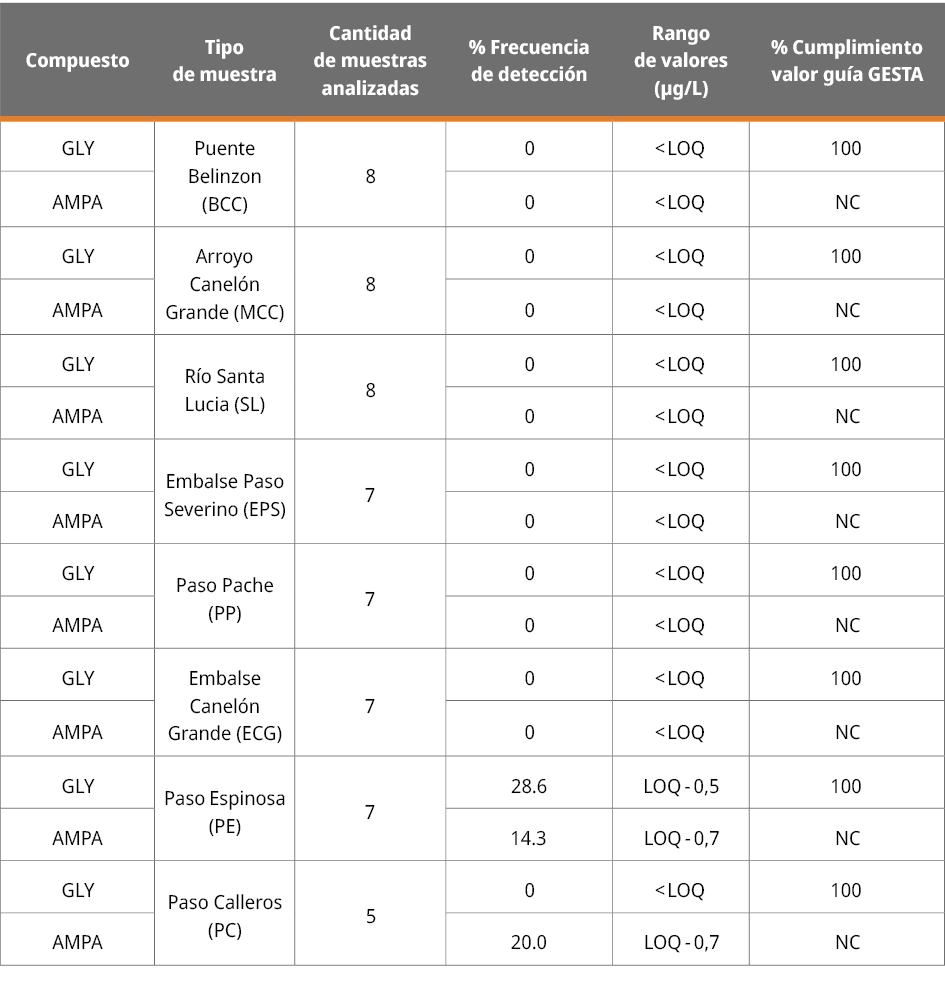
En lo que refiere al monitoreo en afluentes de la cuenca del Río Santa Lucía, los resultados de GLY y AMPA para todos los puntos estuvieron por debajo del LOQ, a excepción de los puntos PE y PC. En estos casos, fue posible cuantificar GLY en PE en dos oportunidades consecutivas en concentraciones < 1 µg/L (19/11/2020 y 26/11/2020). Por otro lado, se cuantificó AMPA una vez en PE (08/10/2020) y otra en PC (19/11/2020), también en concentraciones < 1 µg/L (Tabla 2 y 3).
En base a lo anterior, todas las muestras analizadas de AB y AP cumplieron con los valores máximos de referencia nacionales propuestos como 65 µg/L GLY en aguas naturales (Uruguay. Ministerio de Ambiente. GESTA. Grupo de Estándares Ambientales - Agua, 2014) y 700 µg/L de la suma de GLY y AMPA en AP (Instituto Uruguayo de Normas Técnicas, 2008) (Tabla 2).
Es destacable que estos resultados comparativos entre AB y AP de la PPAC en un periodo de tiempo acotado, con una alta frecuencia de muestreo, son los primeros realizados a nivel nacional y evidencian la necesidad de aumentar el monitoreo de estos compuestos en distintos escenarios ambientales y de forma sostenida en el tiempo.
Respecto a los afluentes de la cuenca del Río Santa Lucía, se concluye que en las muestras analizadas se cumple con los valores máximos propuestos en la reglamentación nacional (Uruguay. Ministerio de Ambiente. GESTA. Grupo de Estándares Ambientales - Agua, 2014).
Las concentraciones de GLY encontradas también se ubican por debajo de los valores de la guía para la protección de la vida acuática canadiense (Canadá. Canadian Council of Ministers of the Environment, 2012) y la reglamentación brasilera (Brasil, 2005). Sin embargo, para reglamentaciones más estrictas como la normativa europea vigente (Unión Europea, 2020), se evidencia la necesidad de aplicar metodologías analíticas con menores LOQ. La aplicación de técnicas de preconcentración, como extracción en fase sólida (SPE) o liofilización, la cromatografía líquida asociada a detección MS/MS, y alternativas como ELISA mejoran los LOQ (Rodríguez et al., 2020, Brovini et al., 2021).
Tabla 3. Distribución de resultados de muestras de agua superficial en afluentes. Se emplea el valor guía nacional en agua natural de 65 µg/L (Uruguay. Ministerio de Ambiente. GESTA. Grupo de Estándares Ambientales - Agua, 2014) para AS.
Recientemente, Rodríguez-Bolaña et al. (2023) han cuantificado GLY en la cuenca de la Laguna del Cisne-Uruguay en el rango de 227,5 ng/L a 1045 ng/L y AMPA en el rango de 580 ng/L a 890 ng/L. Estos resultados son superiores a los reportados en este trabajo en la CRSL. Por lo anterior, es fundamental expandir el monitoreo de GLY y AMPA en aguas superficiales y evaluar los riesgos asociados a los organismos acuáticos.
En términos generales, los resultados obtenidos en AS son afines al programa de monitoreo de calidad de agua de la cuenca del Río Santa Lucía desarrollado entre los años 2015-2019 (Uruguay. Ministerio de Vivienda, Ordenamiento Territorial y Medio Ambiente, 2020), donde se registró el cumplimiento de los estándares de calidad en general de casi todas las subcuencas, a excepción del afluente del Arroyo Canelón Chico (donde se ubican los puntos PE y PC). En este afluente se evidencia comparativamente un mayor deterioro, producto de la fuerte presión urbana y agrícola de la zona. En este mencionado antecedente, se encontró para los arroyos Canelón Grande y Canelón Chico un 60 % de muestras cuantificables para el GLY (Rango 0.1-10 µg/L) y un 83 % de muestras cuantificables para AMPA (Rango 0.5-10 µg/L) (Uruguay. Ministerio de Vivienda, Ordenamiento Territorial y Medio Ambiente, 2020).
Algunos autores plantean que la cuenca de Canelón Grande registró el mayor aumento promedio del área terrestre cultivada y manejada en el periodo 2008-2011 (cultivos regados, de secano y frutales), con un 80 % de aumento en el cambio del uso del suelo y cursos de agua clasificados en estado eutrófico a hipereutrófico (Aubriot et al., 2017). Además, los afluentes Canelón Grande/Canelón Chico han sido los cursos de agua de la cuenca con las mayores concentraciones de nutrientes registradas desde 2005. Las concentraciones promedio de nitrógeno total (NT) y fósforo total (FT) en el último periodo reportado, según el informe de evolución de la calidad de agua en la cuenca del Río Santa Lucía 2015-2019, fueron de NT: 2,3 mg/L y PT: 0,876 mg/L para el afluente Canelón Grande, y NT: 7,5 mg/L y PT: 1,292 mg/L para el afluente Canelón Chico (Uruguay. Ministerio de Vivienda, Ordenamiento Territorial y Medio Ambiente, 2020).
Ha sido señalado que los nutrientes, en particular el fósforo, podrían ser transportados a los cursos de agua en forma particulada como consecuencia de la erosión del suelo o en forma soluble por escorrentía superficial (Aubriot et al., 2017). Asimismo, estudios recientes muestran que la fracción disuelta de fósforo predomina sobre la fracción particulada (Goyenola et al., 2015, Goyenola et al., 2021). En analogía a los nutrientes, se sugiere el transporte de GLY hacia los cursos de agua asociado a fenómenos de erosión y/o de escorrentía de la zona. Se propone para próximos estudios correlacionar resultados de GLY y AMPA con resultados de nutrientes.
Por otra parte, en este trabajo no se obtuvieron resultados cuantificables en muestras del Embalse de Paso Severino y del Río Santa Lucía, lo que difiere del monitoreo de calidad de agua de la cuenca del Río Santa Lucía desarrollado entre los años 2015-2019 (Uruguay. Ministerio de Vivienda, Ordenamiento Territorial y Medio Ambiente, 2020), donde se observa en muestras del Embalse de Paso Severino 39 % de datos cuantificables para GLY (Rango 01-10 µg/L) y 64 % para AMPA (Rango 0.5-10 µg/L) y en muestras del Río Santa Lucía 15 % de GLY (Rango 0.1-10 µg/L) y 51 % de AMPA (Rango 0.5-10 µg/L).
La presencia de GLY en agua depende de varios factores que podrían explicar las diferencias encontradas. Además del momento del muestreo, las condiciones del clima, la dosis aplicada, la frecuencia de aplicación y la formulación utilizada están directamente relacionadas con la persistencia del GLY en el suelo y por lo tanto su presencia en el agua (Maggi et al., 2020). La cantidad y frecuencia de lluvias, la ventana entre que se aplica y un evento de precipitación impactan en la escorrentía, en el lixiviado, y consecuentemente en la concentración en los cursos de agua (Maggi et al., 2020).
Los resultados del estudio realizado sobre los niveles de GLY y AMPA tampoco garantizan la inexistencia de riesgos al suministro de agua potable. Se recomienda realizar un monitoreo continuo y detallado de la cuenca durante un año completo que incluya puntos de muestreo adicionales. También se sugiere analizar la información recopilada en relación con el uso del suelo y los momentos en que se aplican los herbicidas, así como otros factores ambientales como las precipitaciones. De esta manera se podrá determinar si existe algún riesgo potencial para la salud pública y tomar medidas para mitigar cualquier impacto negativo.
Considerando que el GLY también se puede encontrar en otras matrices ambientales, por ejemplo, en suelos o sedimentos, se sugiere ampliar el monitoreo a estas matrices para una mayor comprensión del comportamiento de este plaguicida.
Conclusiones
Los niveles de GLY y AMPA encontrados en las aguas naturales y potables cumplen con las normativas nacionales. Sin embargo, en la subcuenca del Arroyo Canelón Chico se han detectado valores de GLY y AMPA que incumplen con la normativa de calidad de aguas de la Unión Europea. Esta subcuenca ha sido identificada como la zona de mayor exportación de GLY y AMPA a nivel de la cuenca del Río Santa Lucía, significando un potencial riesgo para la protección de la calidad del agua potable en la Planta Potabilizadora de Aguas Corrientes. La remoción de GLY durante la potabilización no pudo ser determinada debido a que se obtuvieron resultados no cuantificables en el periodo de estudio para el agua potable. De todos modos, se sugiere desarrollar experimentos a escala laboratorio para evaluar la remoción de GLY y AMPA en tratamientos convencionales y no convencionales.
Agradecimientos
Los autores de este trabajo agradecen el apoyo de PEDECIBA Química. A Obras Sanitarias del Estado (OSE) por facilitar el acceso a las muestras, el muestreo de cuencas analizadas en este estudio y los datos de precipitaciones, nivel del río y temperatura de muestreo. Se agradece a Luciana Griffero y a Beatriz Alonso por la colaboración brindada en las determinaciones de glifosato.
Referencias
Aubriot, L.; Delbene, L.; Haakonsson, S.; Somma, A.; Hirsch, F. y Bonilla, S., 2017. Evolución de la eutrofización en el Río Santa Lucía: Influencia de la intensificación productiva y perspectivas. En: INNOTEC, 14, pp. 7-16. DOI: https://doi:10.26461/14.04
Alonso, B.; Griffero, L.; Bentos, H.; Pareja, L. y Pérez, P., 2022. Determination of glyphosate and AMPA in freshwater and soil from agroecosystems by 9-fluorenylmethoxycarbonyl chloride derivatization and liquid chromatography-fluorescence detection and tandem mass spectrometry. En: MethodsX, 9, pp. 1-12. DOI: https://doi.org/10.1016/j.mex.2022.101730
Bo Liu, J.; Fa Li, Z.; Lu, L; Yong Wang, Z. y Wang, L., 2022. Glyphosate damages blood-testis barrier via NOX1-triggered oxidative stress in rats: Long-term exposure as a potential risk for male reproductive health. En: Environment International (159), pp. 1-14. DOI: https://doi.org/10.1016/j.envint.2021.107038
Bonansea, R.; Filipi, I.; Wunderlin, D.; Marino, D. y Ame, M., 2017. The fate of glyphosate and AMPA in a freshwater endorheic basin: An ecotoxicological risk assessment. En: Toxics, 6(1), pp. 1–13. DOI: https://doi: 10.3390/toxics6010003.
Brasil. Resolução CONAMA nº 357, de 17 de março de 2005. Diário Oficial da União. [En línea], 18 de marzo de 2005. [Consulta: 05 de diciembre de 2023]. Disponible en: http://www.siam.mg.gov.br/sla/download.pdf?idNorma=2747
Brovini, M.; Cardoso, S.; Quadra, G.; Vilas-Boas, J.; Paranaíba, J.; Pereira, R. y Fernandes, R., 2021. Glyphosate concentrations in global freshwaters: ¿are aquatic organisms at risk? En: Environmental Science and Pollution Research, (28), pp. 60635–60648. DOI: https://doi.org/10.1007/s11356-021-14609-8.
Canadá. Canadian Council of Ministers of the Environment, 2012. Canadian water quality guidelines for the protection of aquatic life: Glyphosate [En línea]. Winnipeg: Canadian Council of Ministers of the Environment. [Consulta: 05 de diciembre de 2023]. Disponible en: https://ccme.ca/en/res/glyphosate-en-canadian-water-quality-guidelines-for-the-protection-of-aquatic-life.pdf
Corrales Martín, N., 2018. Efectos del glifosato en ecosistemas acuáticos: análisis experimental de las respuestas de la comunidad de diatomeas perifíticas (Laguna del Cisne, Canelones). Montevideo: UdelaR, Facultad de Ciencias. (Tesis de maestría).
de Castilhos Ghisi, N; Zuanazzi, N; Fabrin, T y Olivera, E, 2020. Glyphosate and its toxicology: A scientometric review. En: Science of the Total Environment, (733), pp. 1-15. DOI: https://doi.org/10.1016/j.scitotenv.2020.139359
Gelós, M, 2020. Modelación SWAT. Evaluación del destino ambiental de plaguicidas. Cuenca Piloto del Santa Lucía. Proyecto GCP/URU/031/GFF [En línea]. Montevideo: MSP, MGAP, MA, FAO, Gef. [Consulta: 19 de abril de 2023]. Disponible en: https://www.gub.uy/ministerio-ambiente/comunicacion/publicaciones/evaluacion-del-destino-ambiental-plaguicidas
Goyenola, G.; Meerhoff, M.; Teixeira-De Mello, F.; González-Bergonzoni, I.; Graeber, D.; Fosalba, C.; Vidal, N.; Mazzeo, N.; Ovesen, N. B.; Jeppesen, E. y Kronvang, B., 2015. Monitoring strategies of stream phosphorus undercontrasting climate-driven flow regimes. En: Hydrology and Earth System Sciences, 19, pp. 4099-4111. DOI: https://doi.org/10.5194/hess-19-4099-2015
Goyenola, G.; Kruk, C.; Mazzeo, N.; Nario, A.; Perdomo, C.; Piccini, C. y Meerhoff, M., 2021. Producción, nutrientes, eutrofización y cianobacterias en Uruguay: armando el rompecabezas. En: INNOTEC, 22, pp. 1-33. DOI: https://doi.org/10.26461/22.02
Guilherme, S.; Gaivao, I.; Santos, M. A. y Pacheco M., 2010. European eel (Anguilla anguilla) genotoxic and pro-oxidant responses following short-term exposure to Roundup® - a glyphosate-based herbicide. En: Mutagenesis, 25, pp. 523–530. DOI: https://doi.org/10.1093/mutage/geq038
González, E. y Fuentes, M., 2022. Dinámica del glifosato en el suelo y sus efectos en la microbiota. En: Rev. Int. Contam. Ambie., (38), pp. 127-144. DOI: https://doi.org/10.20937/RICA.54197
Guijarro, K.; Aparicio, V.; de Geronimo, E.; Castellote, M.; Figuerola, E.; Costa, J. y Erijman, L., 2018. Soil microbial communities and glyphosate decay in soils with different herbicide application history. En: Science of the Total Environment, (634), pp. 974–982. DOI: https://doi.org/10.1016/j.scitotenv.2018.03.393
International Agency for Research on Cancer, 2015. Evaluation of five organophosfhate insecticides and herbicides [En línea]. Lyon: IARC. [Consulta: 16 de abril de 2023]. Disponible en: https://www.iarc.fr/featured-news/media-centre-iarc-news-glyphosate/
Instituto Uruguayo de Normas Técnicas, 2008. UNIT-ISO 833: Agua potable Requisitos. Montevideo: UNIT.
Ivantsova, E.; Wengrovitz, A.; Souders, C. y Martyniuk, C., 2022. Developmental and behavioral toxicity assessment of glyphosate and its main metabolite aminomethylphosphonic acid (AMPA) in zebrafish embryos/larvae. En: Environmental Toxicology and Pharmacology, 93, pp. 1-10. DOI: https://doi.org/10.1016/j.etap.2022.103873
Maggi, F.; la Cecilia, D.; Tang, F. y McBratney, A., 2020. The global environmental Hazard of glyphosate use. En: Sci Total Environ, (717), pp. 1-12 DOI: https://doi.org/10.1016/j.scitotenv.2020.137167
Muskus, A. M.; Krauss, M.; Miltner, A.; Hamer, U. y Nowak K. M., 2020. Degradation of glyphosate in a Colombian soil is influenced by temperature, total organic carbon content and pH. En: Environ. Pollut., 259, 113767. DOI: https://doi.org/10.1016/j.envpol.2019.113767
Roberts, T.; Hutson, D.; Lee, P.; Nicholls, P. y Plimmer, J., 1998. Metabolic Pathways of Agrochemicals. Cambridge: Royal Society of Chemistry. ISBN: 978-0-85404-494-8.
Rodríguez, C.; Boroskib, M.; Aparecido, G. y Theodoro, A., 2020. Glyphosate and AMPA occurrence in agricultural watershed: the case of Parana Basin 3, Brazil. En: Journal of Environmental Science and Health, Part B, 55(10), pp. 909–920. DOI: https://doi.org/10.1080/03601234.2020.1794703
Rodríguez-Bolaña, C.; Pérez-Parada, A.; Tesitore, G.; Goyenola, G.; Kröger, A.; Pacheco, M.; Gérez, N.; Berton, A.; Zinola, G.; Gil, G.; Mangarelli, A.; Pequeño, F.; Besil, N.; Niell, S.; Heinzen, H. y Teixeira de Mello, F., 2023. Multicompartmental monitoring of legacy and currently used pesticides in a subtropical lake used as a drinkingwater source (Laguna del Cisne, Uruguay). En: Science of the Total Environment, 874, 162310. DOI: http://dx.doi.org/10.1016/j.scitotenv.2023.162310
Sun, M.; Li, H. y Jaisi, D., 2019. Degradation of glyphosate and bioavailability of phosphorus derived from glyphosate in a soil-water system. En: Water Research, (163), pp. 1-10, 114840. DOI: https://doi.org/10.1016/j.watres.2019.07.007
United States Environmental Protection Agency, 2016. Glyphosate issue paper: evaluation of carcinogenic potential [En línea]. Washington: USEPA. [Consulta: 16 de abril de 2023]. Disponible en: https://nepis.epa.gov/Exe/ZyPDF.cgi/P100ZNU6.PDF?Dockey=P100ZNU6.PDF
Unión Europea. Directiva (UE) 2020/2184, de 16 de diciembre de 2020. Diario Oficial de la Unión Europea [En línea], 23 de diciembre de 2020. [Consulta: 05 de diciembre de 2023]. Disponible en: https://eur-lex.europa.eu/legal-content/ES/ALL/?uri=CELEX%3A32020L2184
Uruguay. Ministerio de Ambiente, 2023a. Cuenca Santa Lucía (2019) clasificación de usos/coberturas del suelo [En línea]. Montevideo: Ministerio de Ambiente. [Consulta: 21 de abril de 2023]. Disponible en: https://www.ambiente.gub.uy/geoservicios/
Uruguay. Ministerio de Ambiente, 2023b. Plan de cuenca del río Santa Lucía [En línea]. Montevideo: Ministerio de Ambiente. [Consulta: 21 de abril de 2023]. Disponible en: https://www.gub.uy/ministerio-ambiente/comunicacion/publicaciones/plan-cuenca-del-rio-santa-lucia#:~:text=Se%20trata%20de%20un%20documento,la%20gesti%C3%B3n%20integrada%20del%20agua.
Uruguay. Ministerio de Ambiente. GESTA. Grupo de Estándares Ambientales - Agua, 2014. Propuesta de modificación del Decreto 253/79. Normas reglamentarias para prevenir la contaminación ambiental mediante el control de las aguas. Montevideo: Ministerio de Ambiente.
Uruguay. Ministerio de Ambiente. Observatorio Ambiental Nacional, 2021. Plaguicidas prioritarios para la gestión ambiental [En línea]. Montevideo: Ministerio de Ambiente. [Consulta: 16 de abril de 2023]. Disponible en: https:// ambiente.gub.uy/oan/datos-abiertos/
Uruguay. Ministerio de Ganadería Agricultura y Pesca, 2020. Importaciones de fitosanitarios [En línea]. Montevideo: MGAP. [Consulta: 25 de noviembre de 2022] Disponible en: https://www.gub.uy/ministerio-ganaderia-agricultura-pesca/datos-y-estadisticas/datos/importaciones-productos-fitosanitarios
Uruguay. Ministerio de Vivienda, Ordenamiento Territorial y Medio Ambiente, 2015. Atlas de la cuenca del río Santa Lucía [En línea]. Montevideo: MVOTMA. [Consulta: 19 de abril de 2023]. Disponible en: https://www.gub.uy/ministerio-vivienda-ordenamiento-territorial/comunicacion/publicaciones/atlas-cuenca-del-rio-santa-lucia
Uruguay. Ministerio de Vivienda, Ordenamiento Territorial y Medio Ambiente, 2020. Informe evolución de la calidad de agua en la cuenca del río Santa Lucía 2015-2019 [En línea]. Montevideo: MVOTMA. [Consulta: 01 de abril de 2023]. Disponible en: https://www.gub.uy/ministerio-ambiente/sites/ministerio-ambiente/files/documentos/publicaciones/Informe-Santa-Lucia-2015-2019.pdf
Uruguay. Obras Sanitarias del Estado, 2021. Agua potable [En línea]. Montevideo: OSE. [Consulta: 16 de abril de 2023]. Disponible en: http://www.ose.com.uy/agua/agua-potable
Uruguay. Obras Sanitarias del Estado, 2023. Datos de precipitación, temperatura y nivel del río suministrados por OSE de informes del Laboratorio de la Unidad Usinas de Montevideo.. Montevideo: OSE.
World Health Organization, 2017. Guidelines for drinking-water quality [En línea]. Fourth edition incorporating the first Addendum. Ginebra: WHO. [Consulta: 16-de abril de 2023]. Disponible en: https://www.who.int/publications/i/item/9789241549950
Zhang, Q.; Liub, .X; Gao, M.; Li, X.; Wang, Y.; Chang, Y.; Zhang, X.; Huo, Z.; Zhang, L.; Shan, J.; Zhang, F.; Zhu, B. y Yao, W., 2022. The study of human serum metabolome on the health effects of glyphosate and early warning of potential damage. En: Chemosphere, (298), pp. 1-11. DOI: https://doi.org/10.1016/j.chemosphere.2022.134308



