La contaminación del agua constituye una problemática ambiental global. Los embalses de Córdoba, Argentina, atraviesan hace décadas un continuo proceso de contaminación antrópica, que derivó en un avanzado estado de eutrofización. El Embalse San Roque (ESR) presenta eventos de dominancia de cianobacterias, como Microcystis spp., capaces de producir cianotoxinas y afectar los usos del agua. Aún no se ha implementado un método eficiente de mitigación. El ultrasonido podría ser una alternativa. El objetivo de este trabajo fue evaluar, mediante ensayos de laboratorio, el efecto del ultrasonido (f = 124 kHz, P = 20 W, t = 20 min) sobre la abundancia y flotabilidad celular en muestras de Microcystis spp., extraídas del ESR y de una cepa pura aislada del mismo embalse. Las variables se analizaron por recuento manual y automatizado. También se analizó clorofila intracelular y se observaron efectos sobre las vesículas de gas por microscopía electrónica de transmisión. Los resultados mostraron una reducción significativa en la abundancia celular en cultivos puros, y en células flotantes en muestras del ESR. Si bien estos ensayos fueron realizados a escala de laboratorio, aportan evidencia preliminar sobre los efectos del ultrasonido en Microcystis spp. y su potencial aplicación en estrategias de control de la calidad del agua.
Palabras clave: mitigación de floraciones algales, cianobacterias, transductores, contaminación acuática, eutrofización.
A poluição hídrica é um problema ambiental de nível global. Os reservatórios de Córdoba,
Argentina, vêm sofrendo um processo contínuo de poluição antropogênica há décadas, o que levou a um estado avançado de
eutrofização. O Reservatório San Roque (RSR) apresenta eventos com predominância de cianobactérias, como
Microcystis spp., capazes de produzir cianotoxinas e afetar os usos da água. Ainda não foi implementado um
método eficiente de mitigação. O ultrassom pode ser uma alternativa. O objetivo deste estudo foi avaliar, por meio de
testes laboratoriais, o efeito do ultrassom (f = 124 kHz, P = 20 W,
t = 20 min) na abundância e flotabilidade celular em amostras de Microcystis spp., extraídas
do RSR e de uma cepa pura isolada do mesmo reservatório. As variáveis foram analisadas por contagem manual e
automatizada. Também foi avaliada clorofila intracelular e efeitos nas vesículas de gás por meio de imagens de
microscopia eletrônica de transmissão. Os resultados mostraram uma redução significativa da abundância celular em
culturas puras e nas células flotantes nas amostras do RSR. Embora esses ensaios tenham sido conduzidos em escala
laboratorial, eles fornecem evidências preliminares sobre os efeitos do ultrassom em Microcystis spp. e sua
potencial aplicação em estratégias de manejo da qualidade da água.
Palavras-chave: mitigação de proliferação de algas, cianobactérias, transdutores, poluição aquática, eutrofização.
Introducción
La contaminación del agua constituye una problemática ambiental a nivel global que afecta a los ecosistemas (Chen et al., 2019). El cambio climático y las actividades antropogénicas han provocado graves problemas de contaminación hídrica (Yang et al., 2025). En particular, el exceso de nutrientes generado por parte de estas actividades ha acelerado notablemente la eutrofización de los cuerpos de agua (Klapper, 1991 y Wetzel, 2001). Una de las expresiones más inminentes de este tipo de contaminación son las floraciones algales nocivas (FAN) (Aguilera et al., 2023). El término FAN es funcional, no taxonómico, y se utiliza para describir proliferaciones de organismos fotosintéticos densos. Dentro de las FAN se incluyen las “ciano-FAN”, proliferaciones masivas de cianobacterias, un fenómeno global presente en cuerpos de aguas superficiales, causando efectos adversos en ecosistemas acuáticos así como problemas de salud pública (Sosa Benegas et al., 2020). Estos eventos se vuelven cada vez más intensos y generalizados con el aumento de las temperaturas y la estratificación del agua (Dick et al., 2021). Como se reporta en la revisión de Reichwaldt y Ghadouani (2012), los cambios en los patrones de precipitación podrían generar un impacto significativo en la dinámica de las floraciones de cianobacterias. A largo plazo, los eventos de lluvia intensa pueden incrementar la frecuencia de floraciones debido a un mayor aporte de nutrientes por escorrentía, mientras que los períodos de sequías generan condiciones favorables para la proliferación de especies potencialmente tóxicas, asociadas a una columna de agua más estable, temperaturas elevadas y un aumento del grado de eutrofización.
Las floraciones algales degradan la calidad del agua utilizada para diferentes fines (consumo humano, recreativo, pesquero), amenazando al ecosistema acuático en particular, la seguridad hídrica mundial y generando altos costos económicos. En América Latina, una de las principales reservas mundiales de agua dulce, la información sobre este fenómeno y su posible mitigación es escasa (Aguilera et al., 2023). Más del 75 % de las de las floraciones de cianobacterias producen toxinas (cianotoxinas) afectando la vida silvestre y los seres humanos (Chorus, 2001; Breidenbach et al., 2022; Lomeo et al., 2024; Tornabene et al., 2024).
Los embalses de la provincia de Córdoba, Argentina, atraviesan desde hace varias décadas un continuo proceso de contaminación, que los ha llevado a un estado general y avanzado de eutrofización (Prosperi, 2021). En la actualidad uno de los ambientes acuáticos continentales más problemáticos del país, debido a su avanzado grado de eutrofización, es el Embalse San Roque (ESR) (Daga et al., 2020), el cual se encuentra ubicado en el centro oeste de la provincia de Córdoba. El ESR es multipropósito: se destina al abastecimiento de agua, la generación de energía eléctrica, el riego, el control de crecidas y el uso recreativo. Presenta frecuentes eventos de floraciones algales, entre ellas, de la cianobacteria Microcystis sp. (Halac et al., 2020; Prosperi, 2021). Frente a esta problemática, es prioritario avanzar en estrategias de control de cianobacterias. Una herramienta de mitigación posible es el ultrasonido (US), el cual podría afectar las cianobacterias sin generar daño celular que aporte metabolitos secundarios al medio (Kibuye et al., 2021; Sukenik y Kaplan, 2021). El US tiene la capacidad de colapsar las vesículas de gas intracelulares (Water Research Australia, 2015), estructuras que permiten a las células regular su flotabilidad y alcanzar la superficie para realizar fotosíntesis (Kibuye et al., 2021; Sukenik y Kaplan, 2021). Como cita Vaughan et al. (2023) y expone la investigación de Kibuye et al. (2021), las características de las vesículas varían entre especies, por lo que se requiere ajustar la potencia y la frecuencia ultrasónica dependiendo del microorganismo.
En este sentido, validar el US como herramienta de mitigación resulta un desafío. En base a estos precedentes, en este trabajo se planteó como objetivo general evaluar los efectos del US configurado a 124 kHz de frecuencia y 20 W de potencia, sobre la abundancia y la flotabilidad en muestras con dominancia del género Microcystis sp. recolectadas en el ESR y cultivos puros del mismo género aislados del embalse.
A su vez, este estudio constituye una continuación de un trabajo previo realizado en el Laboratorio de Hidráulica, Facultad de Ciencias Exactas, Físicas y Naturales, Universidad Nacional de Córdoba (Romero et al., 2024), en el que se evaluó el efecto del mismo transductor de US sobre muestras del embalse. Particularmente, en este trabajo se incorporan muestras de cultivo puro y se profundiza en el análisis de la variable flotabilidad.
Materiales y Métodos
Preparación de las muestras utilizadas en los ensayos
Cultivo puro de Microcystis sp.: a partir de una cepa pura no axénica de Microcystis sp. aislada del ESR por el Centro de Excelencia en Procesos y Productos de Córdoba (CEPROCOR) y mantenida en el Laboratorio de Hidráulica, se inoculó cultivo puro de Microcystis sp., en botellas con medio de cultivo Z8 (modificado por CEPROCOR). Las mismas se incubaron con la mitad inferior cubierta con papel, para asegurar de que las células busquen la luz en la superficie y produzcan vesículas de gas.
Muestras extraídas del ESR con alta abundancia de Microcystis sp.: la Figura 1 muestra los dos puntos del ESR donde fueron colectados 10 L de muestra en bidones plásticos translúcidos durante la campaña realizada en noviembre de 2024. Las muestras fueron trasladadas al laboratorio (a temperatura ambiente), las cuales se mezclaron con el fin de obtener un volumen total de 20 L. Para verificar la presencia de cianobacterias antes de comenzar el experimento, se tomó una muestra y fue observada bajo microscopio óptico.
Los géneros de cianobacteria dominantes fueron Microcystis spp. y Dolichospermum.sp.
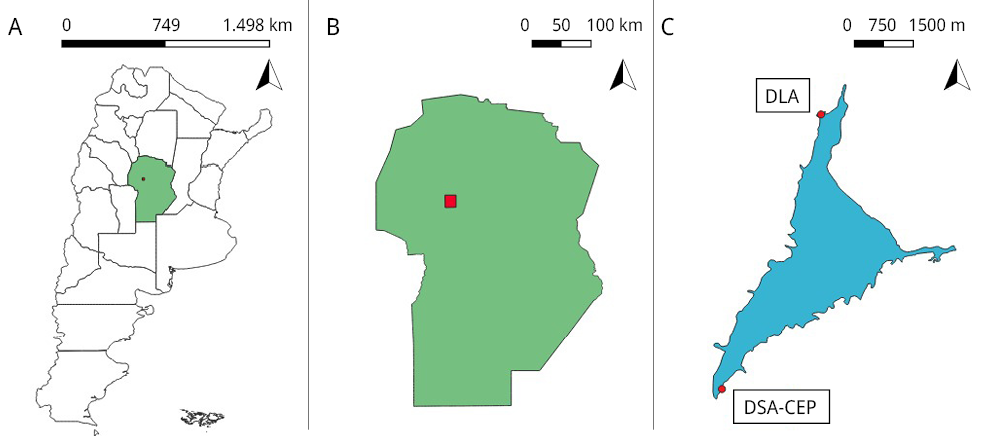
Figura 1. Puntos de muestreo de cianobacterias en el ESR. A) Mapa de Argentina resaltando la Provincia de Córdoba. B) Provincia de Córdoba, en rojo localización del ESR. C) Puntos de muestreo del ESR. DLA: Desembocadura Las Mojarras (31°20’14.8”S 64°28’10.7”W). DSA-CEP: Desembocadura San Antonio, Cuerpo Especial de Policía (31°24’47.9”S 64°29’47.9”W).
Ultrasonido (US)
Se utilizó un transductor de US de la empresa holandesa LG Sonic (Ginpertec con 59,5 mm de diámetro y 98 mm de altura). Se activó mediante un amplificador desarrollado en el Laboratorio de Hidráulica de la Universidad Nacional de Córdoba (UNC). La frecuencia y potencia aplicada fue de 124 kHz y 20 W respectivamente, las cuales fueron medidas a lo largo del experimento para monitorear su permanencia y estabilidad.
Para evaluar la estabilidad del transductor de US, durante el tiempo de exposición y las tres réplicas de los ensayos, se fue midiendo frecuencia, potencia y temperatura. Se realizaron gráficos utilizando lenguaje de programación Python (Python Software Foundation, 2024), en el entorno Visual Studio Code. Se emplearon las bibliotecas pandas (McKinney, 2010), numpy (Harris et al., 2020), matplotlib (Hunter, 2007) y seaborn (Waskom, 2021).
Diseño experimental
Con el objetivo de evaluar los efectos del US sobre Microcystis spp., se llevaron a cabo ensayos de laboratorio bajo condiciones controladas, utilizando cultivos puros y muestras naturales extraídas del ESR. La condición experimental del ensayo constó de un grupo control (C) no expuesto (transductor apagado) y un grupo tratamiento (T) donde se aplicó US a 124 kHz de frecuencia y 20 W de potencia durante 20 min. El tiempo de exposición y los parámetros ultrasónicos fueron determinados en base a experiencias previas, donde las células comenzaron a sedimentar a partir de los 10 min. El volumen empleado fue de 600 ml, el cual fue considerado por la limitación que supone escalar cultivos puros, priorizando la obtención de resultados comparables en dos tipos de muestras diferentes. En lo que respecta a la temperatura ambiente, la misma se acondicionó a 27 ℃ (en línea con la temperatura utilizada en cultivos puros en cámara de cultivo, 27 ℃ ± 1) (Jiaqi et al., 2017).
Los ensayos se realizaron en dos recipientes acrílicos transparentes de 64 mm de diámetro y 19 cm de altura, cada uno fijado a un transductor de US. Antes de aplicar el US se midió pH y temperatura. Para evaluar la temperatura se realizaron gráficos exploratorios con datos obtenidos durante el tiempo de exposición utilizando lenguaje de programación Python (Python Software Foundation, 2024), en el entorno Visual Studio Code. Se emplearon las bibliotecas pandas (McKinney, 2010), numpy (Harris et al., 2020), matplotlib (Hunter, 2007) y seaborn (Waskom, 2021).
Las variables medidas fueron abundancia y flotabilidad celular, evaluadas en tres tiempos diferentes: t1 (antes de encender el US), t2 (cuando se apagó el US a los 20 min) y t3 (luego de cuatro días de reposo). Para esto, fueron tomadas submuestras en cada uno de los diferentes tiempos. Además, en el ensayo con cultivos puros, se tomaron submuestras adicionales para la observación de vesículas de gas por microscopía electrónica de transmisión (MET) y para determinar clorofila como indicador de lisis celular. Los experimentos se realizaron por triplicado y se lavó cuidadosamente todo el material para evitar contaminación cruzada.
Para evaluar la abundancia, se realizó el recuento celular de forma manual (para las muestras del ESR) en cámara de Fuchs Rosenthal, por microscopía óptica (Leica DM750 con cámara ICC50 W, Alemania), siguiendo el protocolo desarrollado en el Instituto Nacional del Agua (Ferreyra et al., 2023). Para las muestras de cultivo puro se utilizó la cámara de recuento en combinación con MatLab (protocolo de recuento automatizado desarrollado en el Laboratorio de Hidráulica de la UNC). Los datos obtenidos fueron registrados en una planilla de cálculos Excel diseñada para expresar los resultados en cel/ml ó cel/L. Con los mismos se calculó un promedio por muestra para luego realizar los análisis estadísticos correspondientes en Python (Python Software Foundation, 2024), en el entorno Visual Studio Code.
Para evaluar la flotabilidad, las submuestras se reservaron en buretas y se dejaron reposar verticalmente. En cultivos puros, se reservaron en incubadora a 27 ± 1 ℃, con la mitad inferior cubierta, para favorecer el ascenso de células flotantes. En el caso de las submuestras del ESR, este paso no fue necesario ya que las células agregadas en colonias flotan con mayor facilidad. En ambos ensayos se descartaron los mililitros inferiores y se fijó la fracción superior con Lugol para su posterior recuento y análisis. Además, se tomaron fotografías de los recipientes del ensayo desde el frente y desde arriba antes y después de aplicar el tratamiento, como complemento visual de los resultados.
Después del tiempo de exposición, se midió nuevamente el pH, se tomaron nuevas submuestras y se almacenaron los volúmenes restantes para el período de reposo. Con los resultados obtenidos del recuento celular, se calculó el porcentaje de diferencia de flotabilidad en el tratamiento en relación con el control, de acuerdo con la siguiente fórmula (Rodriguez-Morales et al., 2014):

Siendo F la flotabilidad, 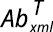 la abundancia en la muestra de los xml superiores del tratamiento, y
la abundancia en la muestra de los xml superiores del tratamiento, y 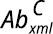 la abundancia de los xml del control.
la abundancia de los xml del control.
En cuanto al análisis cualitativo de la flotabilidad, se utilizaron fotografías para observar las diferencias en la estratificación celular dentro de la columna de agua. Estas observaciones se realizaron para las muestras control y tratamiento de los tiempos 2 y 3.
Análisis de microscopía electrónica de transmisión (MET)
Con el objetivo de observar el impacto del US en las vesículas de gas en cultivos puros de Microcystis sp., se enviaron muestras para obtener imágenes de MET al Centro de Microscopía Electrónica, Facultad de Ciencias Médicas, UNC. En primera instancia, las muestras se lavaron con un buffer de fosfato salino (PBS) y fijaron en una mezcla de Karnovsky, compuesta por formaldehído al 4 % (p/v) y glutaraldehído al 2 % (p/v) en buffer de cacodilato 0,1 M, durante 2 hs antes de centrifugar. El material sedimentado fue lavado nuevamente y tratado (OsO4 al 1 % durante 1 h), para su tinción en bloque con acetato de uranilo al 1 % en tampón de acetato 0,1 M pH 5,2 durante 20 min. Después de la deshidratación las células se incorporaron en resina Spurr para realizar los cortes. Finalmente, las rejillas se tiñeron con acetato de uranilo/citrato de plomo y se examinaron en un Microscopio electrónico Hitachi HT 7800 (Hitachi, Tokio, Japón) operado a 80 kV y fotografiado con una cámara NS 15 AMT (Advanced Microscopy Techniques Corp., Woburn, MA, EE. UU.). A partir de las micrografías obtenidas, se seleccionaron de cada muestra 20 células al azar.
Análisis de clorofila intracelular
En este estudio, la clorofila intracelular de las cianobacterias se utilizó como un indicador indirecto del grado de lisis celular. Mientras las células se mantienen íntegras, conservan su contenido de clorofila; en cambio, cuando ocurre lisis, la clorofila se libera al medio y se degrada.
De este modo, al cuantificar la clorofila intracelular en conjunto con la abundancia celular, es posible estimar las células viables después del tratamiento. Una disminución en la clorofila, acompañada de una reducción en el número de células, refleja una mayor pérdida de integridad celular asociada al proceso de lisis.
El análisis de las muestras para la evaluación de clorofila intracelular se realizó en Aguas Cordobesas S.A.
Análisis estadístico
Con los datos obtenidos del recuento celular de abundancia (células totales) y flotabilidad (células flotantes) se realizó un Análisis de la varianza (ANOVA) y una prueba de Tukey en el caso correspondiente.
Además, se aplicó un análisis de medidas repetidas para el factor tiempo, dado que las mediciones en los distintos momentos provinieron de una misma unidad experimental. Este método permite considerar la dependencia entre observaciones y evaluar correctamente los cambios a lo largo del tiempo.
Los análisis mencionados se efectuaron en Python (Python Software Foundation, 2024), en el entorno Visual Studio Code. Se emplearon las bibliotecas pandas (McKinney, 2010), numpy (Harris et al., 2020), matplotlib (Hunter, 2007), statsmodels (Seabold y Perktold, 2010) y seaborn (Waskom, 2021).
Resultados
Durante los ensayos el registro de la frecuencia y la potencia de US mostró estabilidad, con mínimas variaciones respecto de lo configurado. Los registros de la temperatura también se mantuvieron dentro del rango esperado.
Ensayo con cultivo puro
Abundancia celular vs tiempo
El ANOVA mostró un efecto significativo del tiempo sobre la abundancia (F (2,12) = 56,04, p < 0,001), mientras que la condición experimental, C vs T (F (1,12) = 0,02, p = 0,89) y la interacción entre ambos factores (F (2,12) = 0,84, p = 0,46) no fueron significativos.
La prueba de Tukey revela que hay diferencias significativas para la abundancia celular de las muestras tras la aplicación de US (T, en tiempo 2), la abundancia celular disminuyó en comparación con C en el tiempo 1 y 2, y con T en el tiempo 1. En el tiempo 3, aumentó la cantidad de cel/L respecto del tiempo 1 y 2 para todas las muestras. La Figura 2, muestra la abundancia celular (cel/L) en C y T respecto del tiempo. Se observan variaciones principalmente en el tiempo 3 respecto del tiempo 1 y 2.
El ANOVA de medidas repetidas mostró resultados equivalentes al ANOVA factorial (F (2,6) = 87,66, p < 0,0001).
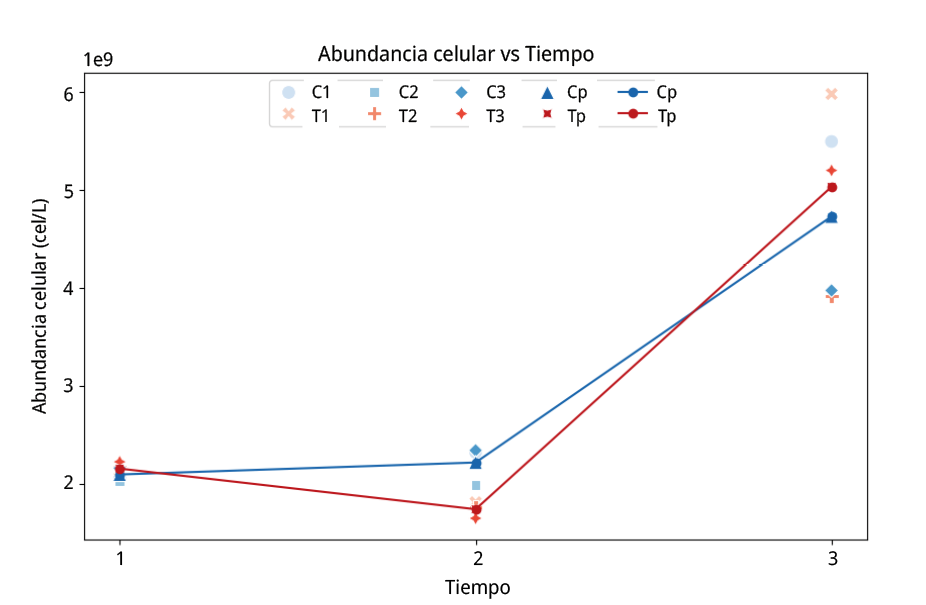
Figura 2. Ensayo de cultivo puro. Abundancia celular en valores x 109 cel/L vs tiempo. C1: muestra control de la réplica 1. C2: muestra control de la réplica 2. C3: muestra control de la réplica 3. Cp: promedio de muestras control para las tres réplicas. T1: muestra tratamiento de la réplica 1. T2: muestra tratamiento de la réplica 2. T3: muestra tratamiento de la réplica 3. Tp: promedio de muestras tratamiento para las tres réplicas (C1–T1, C2–T2, C3–T3).
Flotabilidad
Resultado cualitativo de flotabilidad
En la Figura 3 se observa una mayor sedimentación de las células en los tratamientos respecto del control en todas las réplicas. Las fotografías de las muestras en reposo vistas desde la superficie también muestran esta tendencia; se observa una menor cantidad de células en la superficie de los tratamientos en comparación con los controles.

Figura 3. Ensayo de cultivo puro. Imágenes macroscópicas de flotabilidad en el control C y tratamiento T para las tres réplicas (C1–T1, C2–T2, C3–T3). A) Tiempo 2. B) Tiempo 3.
Resultado cuantitativo de flotabilidad
Si bien se observó una tendencia a la disminución en la flotabilidad en el tratamiento T durante el tiempo 2, y un aumento en el tiempo 3 respecto al tratamiento C (Figura 4), el ANOVA no reveló diferencias significativas en la abundancia de células flotantes entre tiempos ni entre grupo control y tratamiento. Los efectos del tiempo (F (2,12) = 2,32, p = 0,14), de la condición experimental (F (1,12) = 0,38, p = 0,55) y de su interacción (F (2,12) = 0,77, p = 0,48) no fueron estadísticamente significativos. El ANOVA de medidas repetidas mostró resultados equivalentes al ANOVA factorial (F (2,6) = 2,95, p = 0,1282).
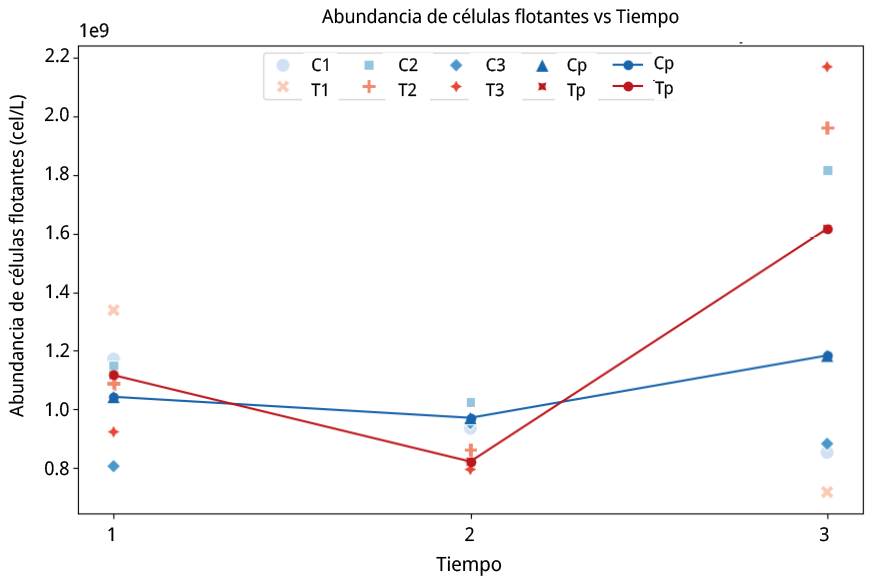
Figura 4. Ensayo de cultivo puro. Abundancia celular en valores x 109 cel/L vs tiempo. C1: muestra control de la réplica 1. C2: muestra control de la réplica 2. C3: muestra control de la réplica 3. Cp: promedio de muestras control para las tres réplicas. T1: muestra tratamiento de la réplica 1. T2: muestra tratamiento de la réplica 2. T3: muestra el tratamiento de la réplica 3. Tp: promedio de muestras tratamiento para las tres réplicas (C1–T1, C2–T2, C3–T3).
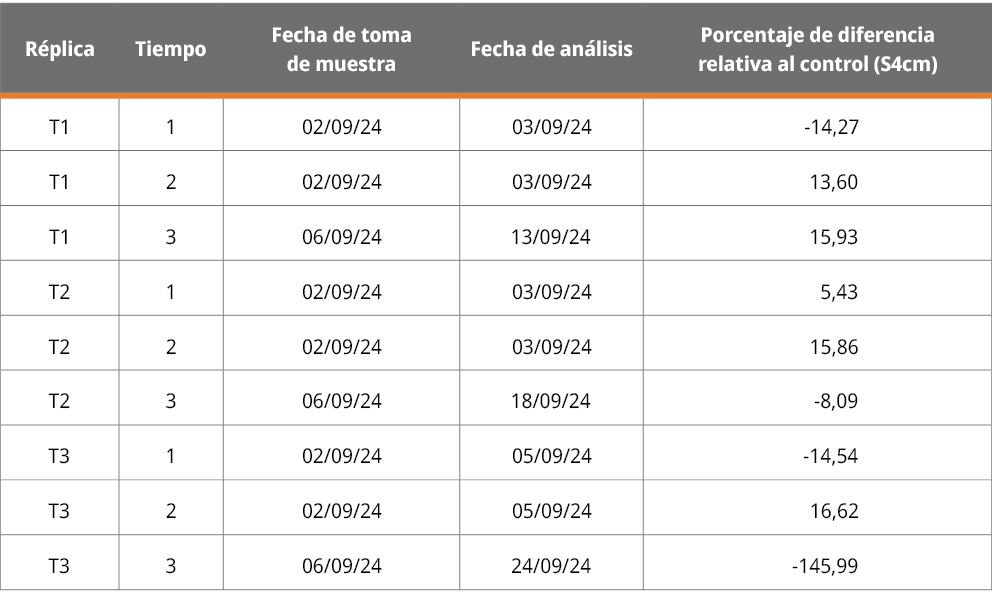
Diferencia porcentual de células flotantes
Resultados de la diferencia porcentual de células flotantes en T con respecto a C, para las muestras de los tiempos 1, 2 y 3. Los valores positivos indican una mayor flotabilidad en el control, mientras que los negativos una mayor flotabilidad en las muestras provenientes del tratamiento.
Tabla 1. Ensayo de cultivo puro. Resultados del cálculo del porcentaje de flotabilidad en el tratamiento con respecto al control.
Microscopía electrónica de transmisión

Figura 5. Imágenes de microscopía electrónica de transmisión (MET) de Microcystis sp. de cultivos puros. Vesículas de gas (VG), señaladas con flechas rojas. Células tratadas, con vesículas colapsadas. A) Muestra inicial. Escalas: 1 μm (arriba) y 200 nm (abajo). B) Réplica 1: comparación entre células control y tratadas. Escalas: 600 nm. C) Réplica 2: comparación entre células control y tratadas. Escalas: 600 nm. (D) Réplica 3: comparación entre células control y tratadas. Escalas: 600 nm (arriba) y 800 nm (abajo). (E) Muestra de reposo: comparación entre células control y tratadas. Escalas: 800 nm.
Clorofila intracelular
El ANOVA mostró un efecto significativo del tiempo sobre la concentración de clorofila (F (2,12) = 33,92, p < 0,001) mientras que no se encontraron diferencias significativas para la condición experimental (F (1,12) = 0,93, p = 0,355) ni para su interacción (F (2,12) = 1,03, p = 0,388). A pesar de la significancia para uno de los factores, la prueba de Tukey no mostró resultados concluyentes; no se evidencia ningún patrón consistente entre los tiempos de exposición al ultrasonido.
El análisis de medidas repetidas mostró un efecto significativo del factor tiempo sobre la variable de respuesta (F (2,4) = 39,30, p = 0,0023), consistente con el resultado del ANOVA factorial.
Ensayo con muestra del ESR
Abundancia celular vs tiempo
Si bien se observaron tendencias a la disminución de células después de la aplicación del US en los resultados obtenidos, el ANOVA para la abundancia celular en el ensayo ESR no mostró efectos significativos del tiempo (F (2,12) = 1,09, p = 0,368), de la condición experimental (F (1,12) = 0,29, p = 0,602), ni de su interacción (F (2,12) = 2,29, p = 0,144).
Al igual que para el ANOVA factorial, el análisis de medidas repetidas no mostró un efecto significativo del factor tiempo sobre la variable de respuesta (F (2,4) = 1,28,p = 0,37).
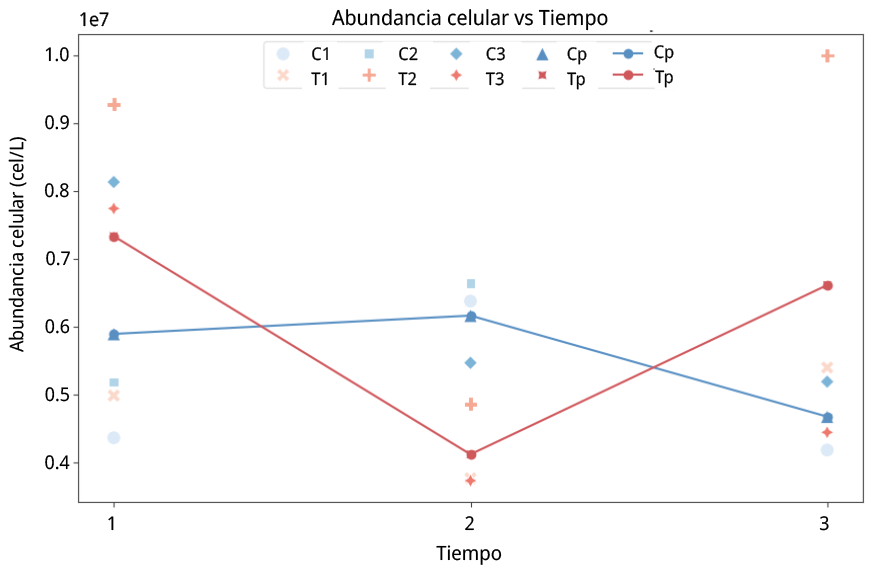
Figura 6. Ensayo ESR. Abundancia celular en valores x 107 cel/L vs tiempo. C1: muestra control de la réplica 1. C2: muestra control de la réplica 2. C3: muestra control de la réplica 3. Cp: promedio de muestras control para las tres replica. T1: muestra tratamiento de la réplica 1. T2: muestra tratamiento de la réplica 2. T3: muestra tratamiento de la réplica 3. Tp: promedio de muestras tratamiento para las tres réplicas (C1–T1, C2–T2, C3–T3).
Flotabilidad
Resultado cualitativo de flotabilidad
La Figura 7A muestra una notable pérdida de flotabilidad en el tratamiento, formando una capa de sedimento en las tres réplicas para el tiempo 2. Las células de los tratamientos, después de los cuatro días de reposo (tiempo 3), no recuperaron flotabilidad (Figura 7B).

Figura 7. Ensayo ESR. Imágenes macroscópicas de flotabilidad en C y T para las tres réplicas (C1–T1, C2–T2, C3–T3). A) tiempo 2. B) tiempo 3.
Resultado cuantitativo de flotabilidad
El ANOVA para la abundancia de flotabilidad en el ensayo ESR mostró efectos significativos tanto del tiempo (F (2,12) = 25,45, p < 0,001) como de la condición experimental (F (1,12) = 34,72, p < 0,001). La interacción entre tiempo y condición experimental no fue significativa (F (2,12) = 3,25, p = 0,074), aunque el valor de p se aproximó al umbral de significancia (0,05). La prueba de Tukey evidenció que el tratamiento en los tiempos t2 y t3 presentaron una reducción marcada de la abundancia celular y estadísticamente significativa, frente al control en t1 y t3. El control en t1, t2 y t3 mostró variaciones menores, con una única diferencia significativa entre control en t1 y control en t3.
Como puede observarse en la Figura 8, tanto para el t2 y t3 (post aplicación de US) la cantidad de células flotantes por litro disminuyó en el tratamiento para las tres réplicas, respecto de C y T para el t1.
El análisis de medidas repetidas mostró consistencia con los resultados del ANOVA factorial, es decir, que hubo un efecto significativo del factor tiempo sobre la variable de respuesta (F (2,4) = 27,19, p = 0,0047).
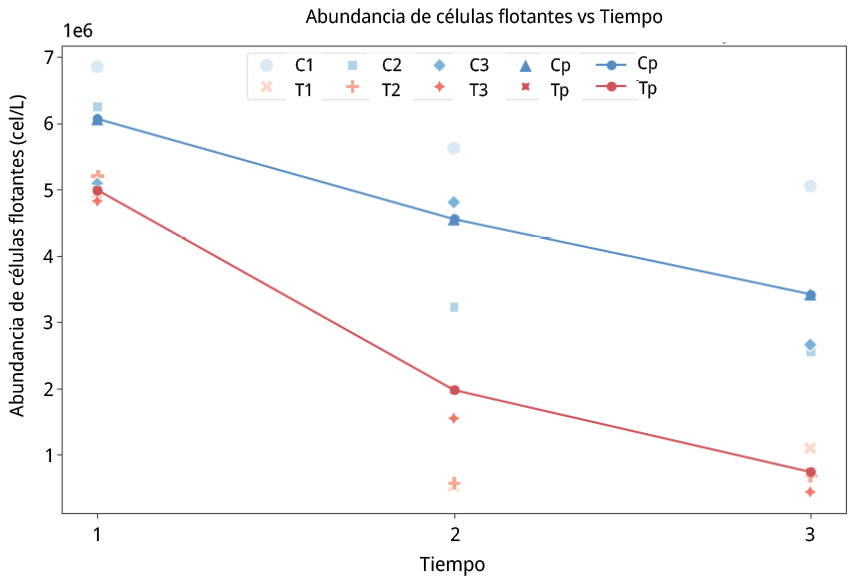
Figura 8. Ensayo ESR. Abundancia de células flotantes en valores x 106 cel/L vs tiempo.C1: muestra control de la réplica 1. C2: muestra control de la réplica 2. C3: muestra control de la réplica 3. Cp: promedio de muestras control para las tres réplicas. T1: muestra tratamiento de la réplica 1. T2: muestra tratamiento de la réplica 2. T3: muestra tratamiento de la réplica 3. Tp: promedio de muestras tratamiento para las tres réplicas (C1–T1, C2–T2, C3–T3).
Porcentaje relativo de células flotantes del tratamiento respecto al control
Los resultados de la diferencia porcentual de células flotantes en el tratamiento con respecto al control para las muestras de los tiempos 1, 2 y 3 se exponen en la Tabla 2. Los valores positivos indican una menor flotabilidad celular en el tratamiento respecto del control.
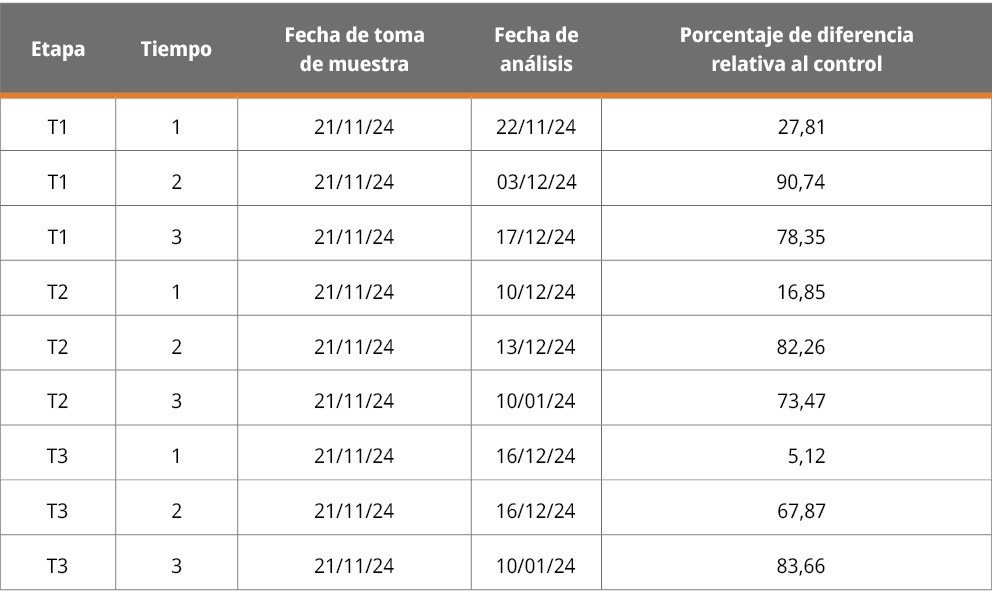
Tabla 2. Ensayo ESR. Valores de recuento celular por tratamiento (C y T) y réplicas (1, 2 y 3) en los tiempos inicial (1), final (2) y reposo (3). Cálculo de porcentaje de diferencia de la abundancia de células flotantes en el tratamiento relativo al control. Valores positivos indican mayor abundancia en el control y valores negativos mayor en el tratamiento.
Discusión
Ante el panorama actual, con una fuerte influencia antrópica sobre el ambiente, existe una gran demanda de estrategias de remediación eficientes en el tratamiento de aguas contaminadas. Para afrontar esta problemática, se han estudiado varias tecnologías alineadas con objetivos de protección ambiental y desarrollo sostenible. La tecnología ultrasónica se ha posicionado en un lugar clave y estratégico en ecosistemas acuáticos, respecto a la mitigación de las floraciones algales. Esta tecnología cuenta con un potencial que supera algunas limitaciones de los métodos de remediación existentes (Lv et al., 2024).
En este estudio, tanto los cultivos puros de Microcystis sp. como las muestras del ESR fueron sometidas a 124 kHz y 20 W de tratamiento ultrasónico, frecuencia y potencia ya aplicadas en estudios previos realizados por Romero et al. (2024).
Tanto los valores de frecuencia, potencia y temperatura de los transductores ultrasónicos se mantuvieron en los rangos esperados, estabilizándose en los primeros minutos. La medición de estos parámetros resulta clave para validar el funcionamiento del US durante el tiempo de exposición de cada una de las muestras.
Los resultados mostraron que la abundancia celular disminuyó significativamente en el ensayo con cultivos puros, a diferencia del ensayo con la muestra del ESR donde no se observaron diferencias significativas. Esto se debe a que los cultivos puros presentan mayormente células aisladas y escaso material extracelular segregado (Kieffer et al., 2015), en comparación con las muestras del ESR donde Microcystis predomina de forma agrupada por la presencia del mucílago, el cual favorece su supervivencia ante predadores (Yu et al., 2013, Yang et al., 2025).
Resultados similares fueron obtenidos en el trabajo previo de Romero et al. (2024), donde evidenciaron que la abundancia celular total no reflejó efectos bajo tratamiento ultrasónico en muestras del ESR.
Los resultados luego de cuatro días de reposo mostraron un aumento de la abundancia celular en cultivos puros, no así, en muestras del ESR. Esto indica que, en los cultivos puros, las células viables recuperan su integridad y/o se reproducen durante los días de reposo independientemente del tratamiento. Esto coincide con trabajos que describen la capacidad de Microcystis de recuperarse y proliferar tras interrupciones temporales de su integridad celular (Zhang et al., 2006; Lürling et al., 2016).
La variable clorofila, asociada directamente a las células de Microcystis en cultivos puros, no evidenció asociación con la abundancia celular que permita evaluar lisis. Si bien los resultados obtenidos no son concluyentes, otros estudios han reportado la medición de este pigmento como indicador de lisis celular (Wert et al., 2013; Mehta et al., 2015). Es fundamental continuar perfeccionando las técnicas de medición de pigmentos, ya que esto permitiría inferir la posible liberación de toxinas al medio como consecuencia de la lisis celular, reduciendo costos y optimizando el tiempo de análisis.
Respecto a los resultados de flotabilidad celular, cualitativamente se observó una menor cantidad de células en la superficie en el tratamiento respecto al control para cultivos puros, aunque sin diferencias estadísticamente significativas. Las imágenes del MET constatan la formación de vesículas. Los hallazgos cualitativos obtenidos con esta herramienta revelaron una reducción en las vesículas de gas en las células expuestas al US. Estos resultados coinciden con lo reportado por Romero et al. (2024), que muestra desagregación y un marcado descenso en el porcentaje de vesículas de gas en células tratadas con US. Es probable que, aumentando el número de repeticiones, se puedan encontrar diferencias estadísticamente significativas ya que se logró obtener evidencia de los efectos sobre esta variable desde múltiples perspectivas: diferencia porcentual de células flotantes y cualitativamente a partir de fotografías macro y de observaciones de imágenes de MET.
Sin embargo, en las muestras del ESR, se observa una notable pérdida de flotabilidad que no se recupera después de los cuatro días de reposo, con diferencias estadísticamente significativas para todos los tiempos de exposición estudiados. Heng et al. (2009) expone que la aplicación de US disminuye significativamente la cantidad de células, por cavitación acústica, sin aumentar la concentración de microcistinas en el medio. En nuestro caso, si bien no se evaluaron los niveles de toxinas, la pérdida de flotabilidad está asociada a un daño estructural de las vesículas de gas, pero sin colapso celular, lo cual se ve reflejado en los resultados de abundancia.
Varios autores realizan ensayos similares con otros cultivos, utilizando frecuencias, potencias, tiempo y volúmenes diferentes mostrando una gran variabilidad (Rajasekhar et al., 2012; Kieffer et al., 2015; Lv et al., 2024). Existen algunos reportes sobre la aplicación del ultrasonido a campo, en la tesis doctoral de Purcell (2009) se menciona que ciertas especies unicelulares y filamentosas fueron susceptibles al tratamiento ultrasónico durante los primeros 30 días de crecimiento de la floración, pero que luego de ese periodo no se observó control sobre los microorganismos. En el trabajo de Míguez et al. (2016) se reporta la aplicación de US en un tajamar, en el cual se observó una disminución de la clorofila en un plazo de 7 días.
En términos prácticos, los resultados obtenidos en este trabajo aportan evidencia sobre la eficacia potencial del ultrasonido en condiciones controladas, pero también ponen de manifiesto los desafíos para su implementación a mayor escala.
Tanto el tipo de muestra como el volumen, el tiempo y las características ultrasónicas son fundamentales para obtener resultados que nos permitan cumplir con nuestro objetivo. Por ello, la extrapolación de los resultados de laboratorio al campo requiere considerar parámetros hidrodinámicos, profundidad del cuerpo de agua, volumen tratado y distribución espacial de los transductores.
Conclusiones
Los resultados obtenidos en este estudio aportan evidencia sobre el potencial que tiene el US como herramienta de control de floraciones algales nocivas, específicamente sobre la cianobacteria Microcystis spp. La aplicación de ultrasonido (124 kHz, 20 W), en ensayos a escala de laboratorio, produjo efectos sobre abundancia (cultivos puros) y la flotabilidad celular (muestras ESR) de Microcystis spp. Estos hallazgos denotan la importancia de considerar las características de las muestras como también las condiciones experimentales (frecuencia, potencia, tiempo de exposición y volumen) al evaluar la herramienta.
El US podría ser una herramienta útil, aunque para su implementación se requerirá de ajustes precisos y estrategias acordes al espacio físico donde se considere aplicar.
Referencias
Aguilera, A.; Almanza, V.; Haakonsson, S.; Palacio, H.; Rodas, G. A. B.; Barros, M. U.; Capelo-Neto,J.; Urrutia, R.; Aubriot, L. and Bonilla, S., 2023. Cyanobacterial bloom monitoring and assessment in Latin America. En: Harmful Algae, 125, 102429. DOI: https://doi.org/10.1016/j.hal.2023.102429
Breidenbach, J.D.; French, B.W.; Gordon, T.T.; Kleinhenz, A.L.; Khalaf, F.K.; Willey, J.C.; Hammersley, J.R.; Wooten, R.M.; Crawford, E.L.; Modyanov, N.N.; Malhotra, D.; Teeguarden, J.G; Haller, S.T. y Kennedy, D.J., 2022. Microcystin-LR aerosol induces inflammatory responses in healthy human primary airway epithelium. En: Environment International, 169, 107531. DOI: https://doi.org/10.1016/j.envint.2022.107531
Chen, B.; Wang, M.; Duan, M.; Ma, X.; Hong, J.; Xie, F and Zhang, R. y Li, X., 2019. In search of key: Protecting human health and the ecosystem from water pollution in China. En: Journal of Cleaner Production, 228, pp. 101-111.
Chorus, I., 2001. Toxic effects and substances in cyanobacteria other than microcystins, anatoxin-a and saxitoxins. En: Chorus, I., ed. Cyanotoxins: Occurrence, causes, consequences. Berlín: Springer. pp. 281–315.
Daga, I.C.; Fernández Belmonte, M.C. y Reyna, S.M., 2020. Composición algal y bioindicadores de calidad de agua. Caso de estudio: Embalse San Roque, Córdoba. Argentina. En: Cuadernos de Investigación Serie HAM, 26. DOI: https://doi.org/10.35305/curiham.v26i0.143
Dick, G. J.; Duhaime, M. B.; Evans, J. T.; Errera, R. M.; Godwin, C. M.; Kharbush, J. J.; Nitschky, H.S.; Powers, M.A.; Vanderploeg, H.A.; Schmidt, K.C.; Smith, D.J.; Yancey, C.E.; Zwiers, C.C. and Denef, V. J., 2021. The genetic and ecophysiological diversity of Microcystis. En: Environmental Microbiology, 23(12), pp. 7278-7313. DOI: https://doi.org/10.1111/1462-2920.15615
Ferreyra, A.; Romero, F. E.; Rodriguez, M. I.; Juaneda Allende, M.; Ruiz, M. A. y Rodriguez, A., 2023. Propuesta de protocolo de recuento Microcystis sp. (resumen extendido) [En línea]. En: Instituto Nacional del Agua. XXVII Congreso Nacional del Agua CONAGUA (Bs.As., Argentina, 28-30 de Agosto de 2023). Buenos Aires: INA. p. 568. [Consulta: 7 de marzo de 2024]. Disponible en: https://conagua.ina.gob.ar/archivos/Libro-resumenes-CONAGUA2023.pdf
Halac, S.; Mengo, L.; Guerra, L.; Lami, A.; Musazzi, S.; Loizeau, J. L.; Ariztegui, D. and Piovano, E. L., 2020. Paleolimnological reconstruction of the centennial eutrophication processes in a sub-tropical South American reservoir. En: Journal of South American Earth Sciences, 103, 102707. DOI: https://doi.org/10.1016/j.jsames.2020.102707
Harris, C.R.; Millman, K.J.; van der Walt, S.J.; Gommers, R.; Virtanen, P.; Cournapeau, D.; Wieser, E.; Taylor, J.; Berg, S.; Smith, N.J.; Kern, R.; Picus, M.; Hoyer, S.; van Kerkwijk, M.H.; Brett, M.; Haldane, A.; del Río, J.F; Wiebe, M., Peterson, P.; Gérard-Marchant, P.; Sheppard, K.; Reddy, T.; Weckesser, W. Abbasi, H.; Gohlke, C. y Oliphant, T.E., 2020. Array programming with NumPy. Nature, 585(7825), pp. 357–362. DOI:
Heng, L.; Jun, N.; Wen-jie, H. and Guibai, L., 2009. Algae removal by ultrasonic irradiation–coagulation. En: Desalination, 239(1-3), pp. 191-197. DOI: https://doi.org/10.1016/j.desal.2007.12.035
Hunter, J.D., 2007. Matplotlib: A 2D graphics environment. En: Computing in Science & Engineering, 9(3), pp. 90–95. DOI: https://doi.org/10.1109/MCSE.2007.55
Jiaqi, Y.; Kevin, M.; Jiarong, H.; Miki, H., 2017. Temperature effects on growth and buoyancy of Microcystis aeruginosa. En: Journal of Plankton Research, 40(1), pp. 16–28. DOI: https://doi.org/10.1093/plankt/fbx059
Kibuye, F. A.; Zamyadi, A. y Wert, E. C., 2021. A critical review on operation and performance of source water control strategies for cyanobacterial blooms: Part II-mechanical and biological control methods. En: Harmful Algae, 109, 102119. DOI: https://doi.org/10.1016/j.hal.2021.102119
Kieffer, L. A.; de la Sierra, P. M.; Devercelli, M.; Luna, J. A.; Claret, M. y Leiz, E., 2015. Ensayos en laboratorio para el control de floraciones algales mediante ultrasonido [En línea]. En: Ciencia, Docencia y Tecnología, 50, pp. 224-243. [Consulta: 30 de octubre de 2023]. Disponible en: https://dialnet.unirioja.es/servlet/articulo?codigo=5092631
Klapper, H., 1991. Control of Eutrophication in Inland Waters. Chichester: Ellis Horwood Limited. ISBN: 978-0-13-174830-9.
Lomeo, D; Tebbs, E. J; Babayani, N. D; Chadwick, M. A; Gondwe, M. J; Jungblut, A. D; McCulloch, G.P; Morgan, E.R.; Schillereff, D.N.; Simis, S.G.H. and Songhurst, A. C., 2024. Remote sensing and spatial analysis reveal unprecedented cyanobacteria bloom dynamics associated with elephant mass mortality. En: Science of the Total Environment, 957, 177525. DOI: https://doi.org/10.1016/j.scitotenv.2024.177525
Lürling, M.; Waajen, G. y de Senerpont Domis, L. N., 2016. Evaluation of several end-of-pipe measures proposed to control cyanobacteria. En: Aquatic Ecology, 50, pp. 499-519. DOI: https://doi.org/10.1007/s10452-015-9563-y
Lv, N.; Wu, R.; Guo, R.; Wu, L.; Zhang, H.; Guo, C.; Wu, L.; Zhang, H.; Guo, C. y Xu, J., 2024. Exploring the progress and challenges of ultrasonic technology in environmental remediation. En: Ultrasonics Sonochemistry, 107175. DOI: https://doi.org/10.1016/j.ultsonch.2024.107175
McKinney, W., 2010. Data structures for statistical computing in Python [En línea]. En: van der Walt, S. y Millman, J., eds. Proceedings of the 9th Python in Science Conference. Austin: s.n. pp. 51–56. [Consulta: 15 de junio de 2025]. Disponible en: https://proceedings.scipy.org/articles/Majora-92bf1922-00a.pdf
Mehta, K.K.; Evitt, N. H. y Swartz, J. R., 2015. Chemical lysis of cyanobacteria. En: Journal of Biological Engineering, 9, pp.1-8. DOI: https://doi.org/10.1186/s13036-015-0007-y
Míguez, D., 2016. Tecnologías de control de floraciones de cianobacterias y algas nocivas en cuerpos de agua, con énfasis en el uso de irradiación por ultrasonido. En: Innotec, 12, pp. 54-61. DOI: https://doi.org/10.26461/12.06
Prosperi, C., 2021. Importancia sanitaria y agronómica de los niveles tróficos de dos embalses de Córdoba (Argentina). En: Revista de Ingeniería Química Agrícola y Alimentaria, 1(1), pp. 06-12.
Purcell, D., 2009. Control of algal growth in reservoirs with ultrasound [En línea]. Cranfield: Cranfield University. (Tesis de Doctorado). [Consulta: 6 de octubre de 2025]. Disponible en: http://dspace.lib.cranfield.ac.uk/handle/1826/5204
Python Software Foundation, 2024. Python: a programming language for general-purpose programming [En línea]. Vers. 3.12.4. Wilmington, DE: Python Software Foundation. [Consulta: 15 de junio de 2025]. Disponible en:
Rajasekhar, P.; Fan, L.; Nguyen, T. y Roddick, F. A., 2012. A review of the use of sonication to control cyanobacterial blooms. En: Water Research, 46(14), pp. 4319-4329. DOI: https://doi.org/10.1016/j.watres.2012.05.054
Reichwaldt, E.S. y Ghadouani, A., 2012. Effects of rainfall patterns on toxic cyanobacterial blooms in a changing climate: between simplistic scenarios and complex dynamics. En: Water Research, 46(5), pp. 1372–1393. DOI: https://doi.org/10.1016/j.watres.2011.11.052
Rodriguez-Molares, A.; Dickson, S.; Hobson, P.; Howard, C.; Zander, A. y Burch, M., 2014. Quantification of the ultrasound induced sedimentation of Microcystis aeruginosa. En: Ultrasonics Sonochemistry, 21(4), pp. 1299-1304. DOI: https://doi.org/10.1016/j.ultsonch.2014.01.027
Romero, F. E.; Ferreyra, A.; Allende, M. J.; Gómez, M.; Vitulich, C. A.; Díaz, P. R.; Ojeda, G.; Marconi, G.; Amé, M.V; Mussi, C.; Baraibar, V; Mansur, P.; Rigatuso, A.; Fierro, J.; Martino, R.; Boccardi, L.; Halac, S.R.; Mínguez, D. y Rodriguez, A., 2024. Análisis cuantitativo del porcentaje de vesículas de gas en células de Microcystis del Embalse San Roque (Córdoba, Argentina) tratadas con ultrasonido. En: Innotec, e665. DOI: https://doi.org/10.26461/28.03
Seabold, S. y Perktold, J., 2010. Statsmodels: Econometric and statistical modeling with Python [En línea]. En: van der Walt, S. y Millman, J., eds. Proceedings of the 9th Python in Science Conference. Austin: s.n. pp. 92–96. [Consulta: 15 de junio de 2025]. Disponible en: https://proceedings.scipy.org/articles/Majora-92bf1922-011.pdf
Sosa Benegas, G. R.; Fernandes Bernal, S. P.; Maia de Oliveira, V. y Zambrano Passarini, M. R., 2020. Inibição do crescimento de Microcystis Aeruginosa e degradação da Cianotoxina Microcistina LR por extratos de microrganismos do continente antártico [En línea]. Foz de Iguazú: Universidad Federal de Integración Latino-Americana. Instituto Latino-Americano de Ciencias de la Vida y de la Naturaleza. Programa de Posgrado en Biociencias. (Tesis de Maestría). [Consulta: 14 de junio de 2025]. Disponible en: https://dspace.unila.edu.br/handle/123456789/6029
Sukenik, A. y Kaplan, A., 2021. Cyanobacterial harmful algal blooms in aquatic ecosystems: A comprehensive outlook on current and emerging mitigation and control approaches. En: Microorganisms, 9(7), p. 1472. DOI: https://doi.org/10.3390/microorganisms9071472
Tornabene, B. J.; Smalling, K. L. y Hossack, B. R., 2024. Effects of harmful algal blooms on amphibians and reptiles are under‐reported and under‐represented. En: Environmental Toxicology and Chemistry, 43(9), pp. 1936-1949. DOI: https://doi.org/10.1002/etc.5941
Vaughan, L.; Barnett, D.; Bourke, E.; Burrows, H.; Robertson, F.; Smith, B.;Cashmore, J.; Welk, M.; Burch, M. y Zamyadi, A., 2023. Evaluating ultrasonicator performance for cyanobacteria management at freshwater sources. En: Toxins, 15(3), p. 186. DOI: https://doi.org/10.3390/toxins15030186
Waskom, M., 2021. Seaborn: statistical data visualization. En: Journal of Open Source Software, 6(60), p. 3021. DOI: https://doi.org/10.21105/joss.03021
Water Research Australia, 2015. Ultrasound for the control of cyanobacteria. Adelaide: Water Research Australia.
Wert, E. C.; Dong, M. M. y Rosario-Ortiz, F. L., 2013. Using digital flow cytometry to assess the degradation of three cyanobacteria species after oxidation processes. En: Water Research, 47(11), pp. 3752-3761. DOI: https://doi.org/10.1016/j.watres.2013.04.038
Wetzel, R. G., 2001. Limnology: lake and river ecosystems. 3a ed. San Diego: Academic Press. ISBN: 978-0-12-744760-5.
Yang, W.; Schmidt, C.; Wu, S.; Zhao, Z.; Li, R.; Wang, Z.; Wang, H.; Hua, P.; Krebs, P. y Zhang, J., 2025. Exacerbated anthropogenic water pollution under climate change and urbanization. En: Water Research, 280, p.123449. DOI: https://doi.org/10.1016/j.watres.2025.123449
Yu, G.; Zhao, C.; Liu, B.; Li, Q. y Gao, H., 2013. Removal of algae from raw water by ultrasonic irradiation and flocculation: a pilot scale experiment. En: Journal of Environmental Biology, 34(2 suppl), p. 331. Disponible en: http://www.jeb.co.in/journal_issues/201304_apr13_supp/paper_07.pdf
Zhang, G.; Zhang, P.; Wang, B. y Liu, H., 2006. Ultrasonic frequency effects on the removal of Microcystis aeruginosa. En: Ultrasonics Sonochemistry, 13(5), pp. 446-450. DOI: https://doi.org/10.1016/j.ultsonch.2005.09.012


