Las drogas vegetales son ampliamente utilizadas con fines medicinales, pero su calidad puede verse comprometida por adulteraciones y deficiencias en los procesos de control. En Uruguay, los análisis botánicos sobre estos productos siguen siendo escasos, a pesar de su creciente demanda. Este trabajo evaluó la calidad botánica de 42 muestras de drogas vegetales empleadas por empresas y laboratorios locales, previo a su comercialización. Las muestras fueron analizadas mediante caracterización organoléptica, análisis macroscópico y microscópico, conforme a los criterios establecidos en el Decreto 289/018 del Ministerio de Salud Pública de Uruguay. Se determinó que el 69 % de las muestras correspondió a materiales de calidad aceptable. Las principales causas de no conformidad fueron la presencia de órganos vegetales que no forman parte de la droga vegetal, la presencia de hongos, insectos o material inorgánico, y el uso de especies incorrectas. Además, se analizaron en detalle casos de adulteraciones entre especies botánicamente relacionadas, particularmente en drogas de las familias Apiaceae, Malvaceae y Asteraceae, seleccionados por su recurrencia en muestras comerciales evaluadas en años anteriores. Los resultados destacan la necesidad de fortalecer los controles de calidad botánica en la comercialización de drogas vegetales en el país para garantizar su autenticidad, eficacia y seguridad.
Palabras clave: autenticación botánica, normativa sanitaria, control de adulteraciones, caracteres morfoanatómicos, análisis de drogas vegetales.
As drogas vegetais são amplamente utilizadas com fins medicinais, mas sua qualidade pode ser comprometida por adulterações e deficiências nos processos de controle. No Uruguai, as análises botânicas desses produtos ainda são escassas, apesar da crescente demanda. Este trabalho avaliou a qualidade botânica de 42 amostras de drogas vegetais utilizadas por empresas e laboratórios locais antes de sua comercialização. As amostras foram analisadas por meio de caracterização organoléptica, análise macroscópica e microscópica, conforme os critérios estabelecidos no Decreto 289/018 do Ministério da Saúde Pública do Uruguai. Determinou-se que 69 % das amostras correspondiam a materiais de qualidade aceitável. As principais causas de não conformidade foram a presença de órgãos vegetais que não fazem parte da droga vegetal, a presença de fungos, insetos ou material inorgânico, e o uso de espécies incorretas. Além disso, foram analisados em detalhe casos de adulterações entre espécies botânicas relacionadas, particularmente em drogas das famílias Apiaceae, Malvaceae e Asteraceae, selecionadas por sua recorrência em amostras comerciais avaliadas em anos anteriores. Os resultados destacam a necessidade de fortalecer os controles de qualidade botânica na comercialização de drogas vegetais no país para garantir sua autenticidade, eficácia e segurança.
Palavras-chave: autenticação botânica, regulamentação sanitária, controle de adulterações, caracteres morfoanatômicos, análise de drogas vegetais.
Introducción
El uso de plantas medicinales ha sido una práctica ancestral en diversas culturas, constituyendo la base de la medicina tradicional (Petrovska, 2012). La medicina tradicional es entendida como el conjunto de saberes y prácticas sanitarias transmitido por las comunidades, centrado en el uso de recursos naturales para el cuidado de la salud (Organización Mundial de la Salud, 2002). En Uruguay es más frecuente, sin embargo, el uso del término “medicina popular” debido a que la identidad cultural del país se construyó a partir de la fusión de distintas tradiciones, sin una referencia única a un sistema médico ancestral. En este contexto, el empleo de plantas medicinales representa la forma más extendida de estas prácticas (Tabakián, 2017).
A lo largo de la historia, la relevancia que se le ha dado a las plantas en el tratamiento de dolencias ha fluctuado, pero en las últimas décadas se observó un incremento en su consumo a nivel global, impulsado por la revalorización de la medicina natural (Cañigueral et al., 2003). No obstante, este crecimiento ha estado acompañado de deficiencias en los mecanismos de regulación y control, lo que plantea desafíos para garantizar la calidad y seguridad de las drogas vegetales (Cuassolo et al., 2010). A pesar de estas limitaciones, las plantas medicinales continúan desempeñando un papel fundamental en la medicina popular, especialmente en el tratamiento de dolencias de manejo doméstico, con una mayor preponderancia en áreas rurales (Cuassolo et al., 2010; Tabakian, 2017).
En nuestro país, entre las principales plantas medicinales comercializadas se destacan la marcela (Achyrocline saturejoides (Lam.) DC., Asteraceae), la carqueja (Baccharis trimera (Less.) DC., Asteraceae), el cedrón (Aloysia citrodora Paláu, Verbenaceae) y la menta (Mentha × piperita L., Lamiaceae). Estas especies se utilizan principalmente para tratar afecciones digestivas, respiratorias, inflamatorias y del sistema nervioso, y se encuentran comúnmente en herboristerías, ferias y mercados, formando parte del acervo de la medicina tradicional del país (Tabakián, 2019).
La ciencia contemporánea ha incorporado muchos principios activos de origen vegetal en la medicina moderna (Petrovska, 2012). En este contexto, la Organización Mundial de la Salud (OMS) ha reconocido la necesidad de integrar los conocimientos y recursos de la medicina tradicional en los sistemas de salud pública (Organización Mundial de la Salud, 2002). Sin embargo, para alcanzar este objetivo es esencial contar con profesionales capacitados en el cultivo, recolección, procesamiento y control de plantas medicinales con el fin de asegurar la calidad de los productos fitoterapéuticos (Jiménez, 1992).
El registro de los conocimientos populares sobre el uso de las plantas (etnobotánica) y la determinación de identidad y de pureza de los materiales vegetales (botánica aplicada) son herramientas claves para garantizar la calidad y seguridad de las drogas vegetales disponibles para la población (Pochettino et al., 2008). Se considera que una droga vegetal es de mala calidad botánica cuando presenta un elevado porcentaje de materia extraña (adulterantes), es decir, elementos que no forman parte de la droga vegetal definida, como fragmentos de otras especies, estructuras vegetales no autorizadas, insectos, tierra o materiales sintéticos (Organización Mundial de la Salud, 2011).
Se ha demostrado que tanto en Uruguay como en otros países de la región muchas de las plantas medicinales comercializadas incumplen con las normativas de salud, registrándose una alta proporción de muestras con este tipo de adulteraciones (Acosta et al., 2017; Cuassolo et al., 2010; Figliolo et al., 2023; Madrigal-de la Selva et al., 2019; Pochettino et al., 2008). A pesar de la importancia de realizar controles sistemáticos, en Uruguay son escasos los estudios que han evaluado la calidad botánica de las drogas vegetales comercializadas (Figliolo et al., 2023).
En Uruguay, el Decreto N.º 403/016 regula desde el año 2016 el registro y la comercialización de hierbas medicinales y drogas vegetales (Uruguay, 2016). En su Anexo II, este decreto establece que los análisis de calidad deben basarse en monografías y fuentes reconocidas internacionalmente, entre las que se incluyen la Farmacopea Europea, la Farmacopea Argentina, la Farmacopea Brasileña, así como otras referencias técnicas como las monografías de la OMS. Según el Ministerio de Salud Pública de Uruguay (MSP), el contenido de materia extraña en una droga vegetal no debe superar el 2 % masa/masa (Uruguay, 2018). Esta materia extraña se clasifica en tres categorías: (a) partes de la misma planta no especificadas en la monografía de referencia o que superan los límites establecidos; (b) elementos vegetales ajenos a la especie definida como droga vegetal; y (c) impurezas de origen mineral o contaminantes no relacionados (Organización Mundial de la Salud, 2011). Entre las adulteraciones más frecuentes reportadas se encuentran fragmentos de otras plantas (como hojas de Poaceae), estructuras vegetales no constitutivas de la droga, insectos, tierra, plástico y moho (Acosta et al., 2017; Cuassolo et al., 2010; Figliolo et al., 2023; Madrigal-de la Selva et al., 2019; Turano y Cambi, 2009).
El Laboratorio de Botánica de la Facultad de Química de la Universidad de la República (Labot, Udelar) realiza de manera rutinaria la identificación botánica y evaluación de la calidad de drogas vegetales, a solicitud de diversas empresas. Las muestras analizadas corresponden, en su mayoría, a fragmentos de plantas utilizadas para infusiones, las cuales pueden incluir diferentes órganos y estructuras tales como tallos, raíces, hojas, flores, inflorescencias, frutos y semillas. Entre los diferentes tipos de adulteraciones, aquellas que involucran especies del mismo género o familia que la declarada en la droga vegetal, resultan particularmente difíciles de detectar debido a la similitud morfoanatómica entre los taxones implicados (Figliolo et al., 2023; Molinelli et al., 2014). En la experiencia del Labot (Udelar) este tipo de adulteraciones ha sido frecuentemente observado en los últimos diez años, especialmente en ciertas familias como Apiaceae, Malvaceae y Asteraceae.
Por ese motivo, para este trabajo se seleccionaron algunos casos representativos, que se analizaron en detalle con el objetivo de caracterizar los elementos diagnósticos necesarios para su correcta identificación, lo cual podría contribuir a mejorar los criterios de control de calidad en el país. Así, este estudio tiene como objetivo principal determinar la calidad botánica de las drogas vegetales utilizadas por empresas y laboratorios de Uruguay durante 2023, enfocándose particularmente en las adulteraciones más frecuentes encontradas en estos productos.
Materiales y Métodos
Muestras analizadas
Las muestras procedieron de seis empresas en el ramo de alimentos y medicamentos con domicilio en Montevideo, Uruguay. Fueron entregadas como materia prima o como material ya envasado pronto para el consumo. Para su análisis, se siguió la metodología sugerida en el Decreto 289/018 del MSP (Uruguay, 2018). Se realizó el cuarteo de las muestras para proceder con el análisis organoléptico, macroscópico y microscópico. Todos los materiales fueron pesados en su totalidad utilizando una balanza digital RADWAG modelo WTC 200, con una sensibilidad de 0,001 g. Posteriormente, los elementos extraños separados fueron pesados con la misma balanza, registrándose su masa en gramos.
Caracterización organoléptica y macroscópica
En el caso de muestras simples (es decir, aquellas correspondientes a una única especie vegetal), el análisis se inició con la caracterización organoléptica de los fragmentos, evaluando atributos como el color, la consistencia y el olor (Organización Mundial de la Salud, 2011). A continuación, se procedió a la separación de fragmentos que por sus caracteres morfoanatómicos podrían corresponder a la droga vegetal, utilizando una lupa estereoscópica (Bausch & Lomb, 10× a 30×). Paralelamente, se aislaron aquellos fragmentos que presentaban características no compatibles con la droga, tales como estructuras vegetales ajenas, insectos, hongos, plásticos u otros contaminantes visibles, los cuales fueron considerados posibles adulterantes.
Para las muestras complejas (mezclas que contenían más de una especie vegetal), se realizó la separación de los distintos fragmentos utilizando también una lupa estereoscópica (Bausch & Lomb, 10× a 30×), con el fin de analizarlos individualmente. Los materiales vegetales fueron diferenciados en función de atributos morfológicos como forma, color, tamaño, pilosidad y brillo, entre otros. Los fragmentos considerados como posibles adulterantes fueron igualmente aislados. El análisis se realizó sobre las muestras tal como fueron entregadas, y los elementos considerados adulterantes se registraron para la muestra comercial, sin asociarlos necesariamente a una de las especies declaradas para la mezcla.
Análisis microscópico
Para la observación de caracteres superficiales (tricomas, estomas, papilas) se realizaron diafanizados, utilizando lactofenol como agente aclarante. La solución de lactofenol se preparó siguiendo el procedimiento de D’Ambrogio de Argüeso (1986). Para la observación de la anatomía interna de estructuras vegetales (tejidos conductores, estructuras secretoras internas, idioblastos) se realizaron cortes transversales y paradermales a mano alzada. Las secciones vegetales se colocaron en portaobjetos, utilizando lactofenol o agua como medio de montaje, y se cubrieron con cubreobjetos. Todos los preparados se observaron en microscopio óptico (Nikon, modelo Eclipse Si RS trinocular, aumentos x4, 10, 40 y 60), acoplado a un kit de polarización simple y a una cámara digital en color para microscopía (AmScope, modelo MU-853B). Las micrografías obtenidas fueron procesadas utilizando el software AmScope, proporcionado por el mismo fabricante.
La identificación se realizó utilizando monografías de referencia (por ejemplo, Cañigueral et al., 1998), patrones aportados por las empresas solicitantes del análisis y materiales de referencia disponibles en el Labot (catálogo de muestras previamente identificadas por investigadores del laboratorio).
Asignación de la calidad de las muestras y registro
Para determinar la calidad botánica de las muestras, se tomó como referencia el Decreto 289/018 del MSP, que establece que el porcentaje de elementos extraños no debe ser superior al 2 % de la masa muestreada, salvo indicación contraria (Organización Mundial de la Salud, 2011). En este estudio, se consideró que una muestra era de calidad aceptable cuando el contenido de elementos extraños era igual o inferior al 2 % en masa. Las muestras con un contenido superior fueron clasificadas como no aceptables. No se establecieron subcategorías adicionales de calidad.
Se elaboró el Registro de Asesoramientos, en el cual se documentó cada muestra analizada registrando: número de muestra, empresa solicitante, origen de la muestra y resultado del análisis, indicando estado de la muestra, calidad y presencia de adulterantes en los casos en que correspondiera. Además, para aquellas muestras que el resultado del análisis no fue aceptable, se analizaron las causas, estableciéndose 6 categorías para contabilizarlas: 1) adulteración con la misma especie, 2) adulteración con otra especie, 3) adulteración con la misma especie y adulteración con otra especie simultáneamente, 4) presencia de insectos, hongos, gramíneas o material inorgánico, 5) adulteración con la misma especie y presencia de insectos, hongos, gramíneas o material inorgánico simultáneamente, y 6) especie incorrecta. La organización y el procesamiento de estos datos se llevaron a cabo mediante planillas electrónicas.
Adulteraciones con otras especies con caracteres morfoanatómicos similares
Los casos donde se detectaron adulteraciones con otras especies que presentaban caracteres morfoanatómicos similares a los de la especie declarada en la droga vegetal fueron objeto de un análisis más detallado. Este tipo de adulteración suele ocurrir cuando el adulterante comparte unidades de clasificación (como familia o género) con la especie declarada, lo cual dificulta su diferenciación, especialmente en materiales fragmentados. Se seleccionaron para este trabajo aquellas adulteraciones que, según la experiencia acumulada en el laboratorio durante los últimos diez años, se presentan con mayor frecuencia en muestras comerciales. En particular, se analizaron adulteraciones entre las siguientes especies: 1) anís (Pimpinella anisum L., Apiaceae) e hinojo (Foeniculum vulgare Mill., Apiaceae); 2) especies de tilos (Tilia sp., Malvaceae); 3) manzanilla (Matricaria chamomilla L., Asteraceae) y marcela (Achyrocline saturejoides (Lam.) DC., Asteraceae).
Las muestras de hojas de Tilia cordata Mill. (Malvaceae), utilizadas para mostrar las diferencias anatómicas con las otras especies de Tilia, se obtuvieron del catálogo de patrones del Labot. En particular se eligió a Tilia cordata como patrón por ser una de las especies aceptadas por la Farmacopea Europea.
Resultados y Discusión
Frecuencia de análisis de drogas vegetales
Durante el año 2023 se recibieron 42 solicitudes de análisis de drogas vegetales, correspondientes a 41 muestras simples y una mezcla compuesta por 8 especies distintas. Del total de drogas vegetales analizadas, las hojas de menta (Mentha × piperita L., Lamiaceae) fueron las más frecuentes, con 8 muestras recibidas (18 %), seguidas por los capítulos florales de manzanilla (Matricaria chamomilla L., Asteraceae), con 7 muestras (16 %), y las hojas de té (Camellia sinensis (L.) Kuntze, Teaceae), con cuatro muestras (9 %) (Figura 1). El restante 57 % de los materiales analizados correspondió a 17 especies, de las cuales se recibieron tres muestras en cuatro especies, dos muestras en cuatro especies y una muestra en nueve especies.
En el caso del té, se analizaron conjuntamente hojas sometidas a distintos procesos de oxidación y estacionamiento, correspondientes a té verde, té negro y té rojo. La única muestra considerada de calidad no aceptable, correspondiente a té negro, presentó una elevada proporción de tallos. Tanto el té negro como el té rojo se someten a procesos de oxidación más prolongados que el té verde (Valenzuela, 2004), lo que podría explicar una mayor proporción de tallos en estos tipos. Durante el procesamiento, la oxidación avanzada tiende a reducir el volumen del material vegetal asociado a las partes más blandas de las hojas, lo que resulta en una representación relativamente mayor de estructuras más resistentes, como los tallos.
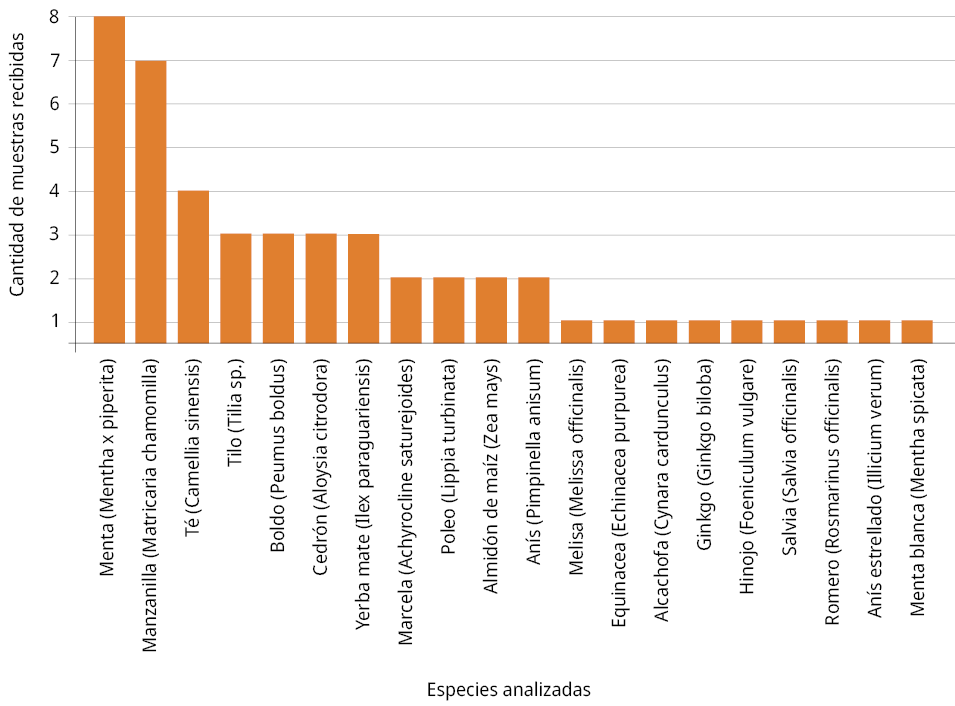
Figura 1. Frecuencia de análisis de drogas vegetales en 2023: cantidad de muestras analizadas en función de la especie a la que corresponden.
Calidad de las muestras
Se determinó que la mayor proporción de muestras de calidad aceptable fueron de las siguientes drogas vegetales: hojas de boldo (Peumus boldus Molina, Monimiaceae), hojas de cedrón (Aloysia citrodora Paláu, Verbenaceae) y hojas de yerba mate (Ilex paraguariensis A. St.-Hil., Aquifoliaceae). En los tres casos, la totalidad de las muestras analizadas (n = 3 para cada especie) presentaron un contenido de elementos extraños igual o inferior al 2 % en masa, por lo cual fueron clasificadas como de calidad aceptable.
Para las siguientes drogas vegetales: inflorescencias de tilo (Tilia sp., Malvaceae, n = 3) y capítulos florales de marcela (Achyrocline saturejoides (Lam.) DC., Asteraceae, n = 2), ninguna de las muestras recibidas fue de calidad aceptable.
En el caso del tilo, ninguna de las especies identificadas en las muestras coincidió con las especies reconocidas como medicinales en las farmacopeas. Según la Farmacopea Europea, las especies de tilo medicinales son: Tilia cordata Mill., Tilia platyphyllos Scop., Tilia x vulgaris Hayne y sus híbridos interespecíficos (Agencia Europea de Medicamentos, 2012). Esta adulteración podría estar relacionada con las dificultades que enfrentan algunas empresas locales para acceder o importar material vegetal perteneciente a las especies reconocidas como medicinales, recurriendo en su lugar a especies ornamentales disponibles en el mercado regional.
La identificación botánica de las muestras de Tilia se basó en el análisis de fragmentos de hojas nomófilas presentes entre las inflorescencias, utilizando claves dicotómicas específicas para el género (Parodi et al., 1959). Si bien las hojas nomófilas se consideran un adulterante en la droga vegetal del tilo, su presencia en las muestras es frecuente y sus caracteres anatómicos resultan útiles para la diferenciación de especies dentro del género. En uno de los casos, la especie identificada fue Tilia tomentosa Moench, coincidiendo con la especie declarada por la empresa solicitante del análisis (aunque no es reconocida como medicinal en farmacopeas). En los dos casos restantes, las empresas declararon únicamente “tilo” sin especificar la especie. Los análisis permitieron identificar una mezcla de Tilia tomentosa y Tilia × viridis (Bayer) Simonk. notosubsp. moltkei (Dippel) Xifreda, híbrido ornamental comúnmente cultivado en espacios públicos de Argentina, país desde donde se importaron todas las muestras. Esta última entidad, antiguamente conocida como Tilia moltkei “Späth ex Schneider”, fue identificada en base a caracteres anatómicos de las hojas nomófilas y a la terminología taxonómica actualizada (Xifreda, 1998; Argentina, s.d.).
En el caso de la marcela (Achyrocline saturejoides), la principal causa por la que las muestras no fueron consideradas de calidad aceptable fue la presencia de una alta proporción de tallos, partes que no corresponden a la droga vegetal definida para esta especie. Esta situación podría explicarse por la ausencia de un proceso de separación manual de los capítulos florales respecto a otras partes aéreas de la planta antes de la molienda, posiblemente asociado al mayor costo operativo de dicha práctica.
En el caso de otras drogas vegetales, como las hojas de menta (Mentha × piperita) y los capítulos florales de manzanilla (Matricaria chamomilla), también se registraron tres muestras de calidad no aceptable para cada una. Sin embargo, estas representan únicamente el 38 % del total de muestras analizadas de menta y el 43 % en el caso de la manzanilla.
De las 42 muestras analizadas, el 69 % fueron clasificadas como de calidad aceptable. La causa más frecuente de no conformidad fue la adulteración con estructuras vegetales de la misma especie que no forman parte de la droga vegetal, como tallos u hojas nomófilas (Figura 2). Este tipo de adulteración se registró en el 60 % de las muestras no aceptables, pudiendo estar presente de forma exclusiva o junto con otros tipos de adulterantes. En orden decreciente, las causas más frecuentes de adulteración fueron: (1) estructuras vegetales de la misma especie no pertenecientes a la droga vegetal definida, (2) esta misma adulteración combinada con la presencia de insectos, hongos, gramíneas o material inorgánico, y (3) el uso de especies incorrectas. Esta distribución se presenta en la Figura 2, donde se grafican las categorías de causas de mala calidad de las muestras según su proporción relativa.
La alta frecuencia de la primera categoría podría explicarse por las dificultades logísticas en el manejo poscosecha de las plantas recolectadas, que muchas veces impiden separar eficientemente los órganos deseados, y por el interés en reducir los costos asociados al procesamiento. Además, debe considerarse que la mayoría de las drogas vegetales se comercializan fragmentadas, lo cual dificulta la detección visual de partes no constitutivas de la droga cuando se encuentran en proporciones reducidas, aunque superiores al umbral del 2 %. Este hallazgo coincide con lo reportado por Figliolo et al. (2023), quienes identificaron este tipo de adulteración como el principal problema de calidad botánica. Por su parte, otros estudios han señalado que las adulteraciones más comunes en plantas medicinales incluyen la presencia de materiales inorgánicos, insectos, y estructuras pertenecientes a especies vegetales diferentes (Acosta et al., 2017; Cuassolo et al., 2010; Madrigal-de la Selva et al., 2019; Turano y Cambi, 2009).
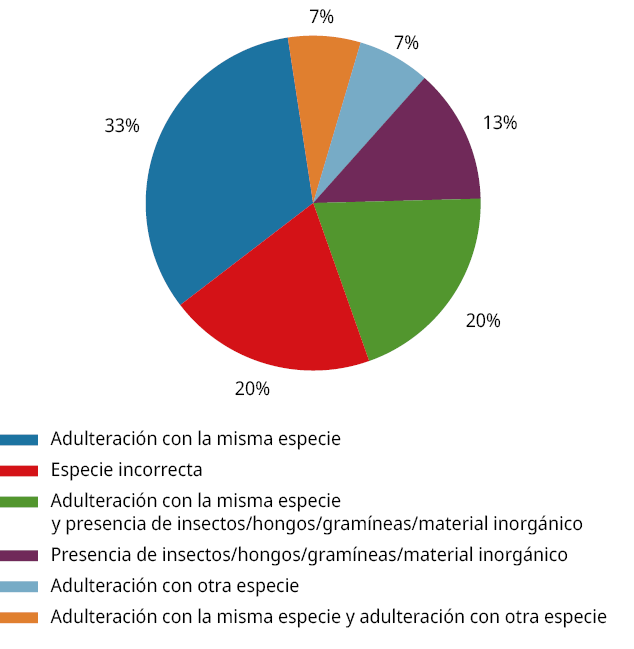
Figura 2. Causas de muestras no aceptables.
Casos de adulteración con otra especie de caracteres morfoanatómicos similares
Anís e hinojo
Tanto para el hinojo (Foeniculum vulgare Mill., Apiaceae) como para el anís (Pimpinella anisum L., Apiaceae), la droga vegetal corresponde a los frutos, los cuales son esquizocarpos formados por dos mericarpos (Cañigueral et al., 1998). Los esquizocarpos del hinojo son de una longitud aproximada de 3,0 a 12 mm, con un color que va desde verde amarillento hasta amarillo-parduzco. Carecen de pubescencia y presentan costillas prominentes (Cañigueral et al., 1998). En el caso del anís, los esquizocarpos miden aproximadamente 2,5 a 3,0 mm de largo, tienen una forma piriforme invertida y un color que varía de gris verdoso a pardo-grisáceo. Son finamente pubescentes, ligeramente comprimidos lateralmente y presentan finas costillas (Cañigueral et al., 1998). Al comparar ambas especies, los frutos enteros pueden diferenciarse macroscópicamente por su forma, tamaño y color.
Para la identificación botánica de los frutos fragmentados de hinojo y anís, se observaron diferencias en la anatomía del epicarpo y del mesocarpo, particularmente en la disposición y el tamaño de las vitas y costillas. En las secciones transversales de los frutos de hinojo se observaron dos mericarpos, cada uno con un epicarpo compuesto por una epidermis externa glabra, y un mesocarpo que presentaba cinco costillas prominentes y seis vitas de gran tamaño (Figura 3A), en concordancia con las descripciones de Bercu y Broască (2012) y Kljuykov et al. (2021). En las secciones transversales de los frutos de anís (Figuras 3B y 3C), también se identificaron dos mericarpos, con un epicarpo que presentaba una epidermis externa provista de numerosas papilas y pelos no glandulares, cortos y unicelulares. El mesocarpo contenía múltiples vitas y costillas de menor tamaño que el hinojo, tal como fue descrito por Bercu y Broască (2012) y Kljuykov et al. (2021).
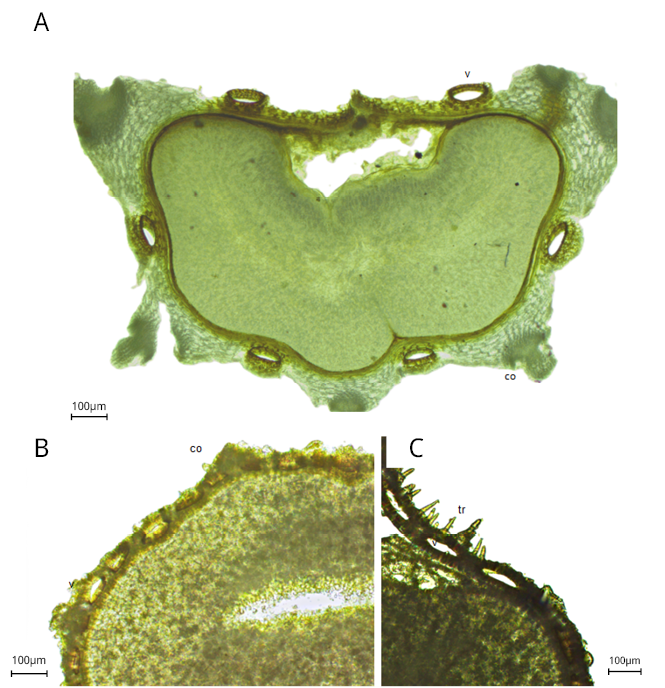
Figura 3. A) Corte transversal de uno de los mericarpos del fruto de Foeniculum vulgare. Se observan seis vitas grandes y elípticas entre las costillas. B) Corte transversal de uno de los mericarpos del fruto de Pimpinella anisum. Se observan numerosas vitas en la parte dorsal del mesocarpo. C) Detalle de los tricomas no glandulares en el epicarpo de Pimpinella anisum; co: costilla, tr: tricomas de recubrimiento, v: vita.
Tilo
Se determinó que ninguna de las muestras de tilo analizadas correspondía con las especies de Tilia reconocidas por las farmacopeas. El análisis de los caracteres superficiales de las hojas de Tilia permite diferenciar entre las distintas especies del género (Parodi et al., 1959; Ramírez-Díaz et al., 2024; Strelnikov y Gürdal, 2024). Las hojas nomófilas no son parte de la droga vegetal, pero aportan información valiosa en la determinación de la especie. En una de las muestras la especie identificada fue Tilia tomentosa, mientras que en los dos casos restantes se determinó que las muestras eran una mezcla de Tilia tomentosa y Tilia x viridis notosubsp. moltkei. Ninguna de estas especies es reconocida como medicinal por las monografías de referencia para especies medicinales de Tilia (Agencia Europea de Medicamentos, 2012; Cañigueral et al., 1998). En particular, para Tilia tomentosa hay recomendaciones de no utilizar sus inflorescencias en medicina humana (Parodi et al., 1959), y sin embargo es una especie muy usada de forma popular como planta medicinal (Mitrović et al., 2023; Paniagua-Zambrana et al., 2024; Strelnikov y Gürdal, 2024).
En el envés de las hojas nomófilas de Tilia tomentosa se observaron tricomas estrellados pluricelulares de varias ramas en una alta densidad, dispersos por toda la epidermis (Figura 4A). Para Tilia × viridis notosubsp. moltkei también se registraron tricomas estrellados en el envés de las hojas nomófilas; sin embargo, su distribución se encontró restringida a las regiones de la epidermis que se ubican sobre las nervaduras (Figura 4B y 4C). Las imágenes correspondientes a estas tres muestras fueron tomadas a partir del material analizado en este estudio. En el caso de Tilia cordata, no se observaron tricomas estrellados en el envés de las hojas nomófilas (Figura 4D); esta microfotografía se obtuvo a partir de una muestra patrón, previamente identificada y conservada como material de referencia en el laboratorio.
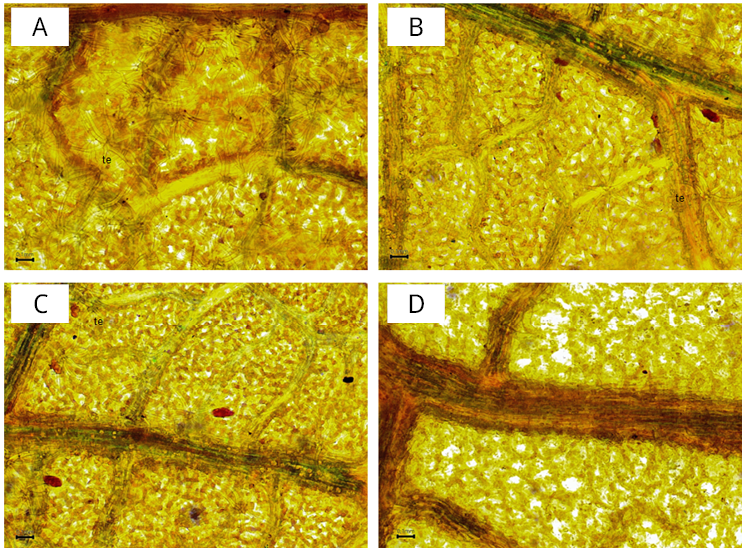
Figura 4. Micrografías del envés de las hojas nomófilas de: A) Tilia tomentosa, B) y C) Para Tilia × viridis notosubsp. moltkei, D) Tilia cordata. te: tricoma estrellado.
Marcela y manzanilla
En muestras de marcela (Achyrocline saturejoides) se encontraron fragmentos de inflorescencias correspondientes a manzanilla (Matricaria chamomilla), evidenciando una adulteración. Esta se determinó mediante el análisis comparativo de las características morfoanatómicas de las estructuras florales de ambas especies. En la marcela se observaron filarias (brácteas presentes en los capítulos florales) lanceoladas, de entre 2,0 y 5,5 mm de longitud, ápice obtuso, margen entero, y base densamente cubierta por numerosos tricomas de recubrimiento flageliformes, además de escasos tricomas glandulares pluricelulares biseriados (Figura 5A y Figura 6), coincidiendo con la descripción de Gattuso et al. (2008) y de Giangualani (1976). En contraste, la manzanilla presentó filarias oblongas, de entre 1,5 y 3,0 mm de longitud, con la zona central engrosada, ápice obtuso, margen entero y la base desprovista de tricomas de recubrimiento (Figura 5B), en concordancia con lo reportado por Amat (1982). Asimismo, se detectaron en las muestras de marcela flores tubulosas hermafroditas, de color amarillo y limbo campanulado, características de M. chamomilla (Figura 7).

Figura 5. A) Filaria de Achyrocline saturejoides; B) Filaria de Matricaria chamomilla.

Figura 6. Tricomas glandulares pluricelulares biseriados de Achyrocline saturejoides.

Figura 7. Flor tubulosa de Matricaria chamomilla.
Conclusiones
Este estudio permitió recopilar y analizar información sobre las drogas vegetales registradas en Uruguay ante el MSP. Los resultados revelan que un porcentaje considerable de las muestras analizadas (31 %) no cumple con los criterios de calidad botánica establecidos en las normas de referencia, lo que evidencia la necesidad de revisar y actualizar la normativa vigente.
Se destaca la relevancia de evaluar la calidad de las drogas vegetales comercializadas en el país, dado que este tipo de análisis es esencial no solo para asegurar el cumplimiento regulatorio, sino también para proteger la salud pública, garantizar la eficacia terapéutica de los productos y fomentar prácticas sostenibles en la industria farmacéutica. La presencia de adulteraciones compromete la calidad y la efectividad de los tratamientos, y puede exponer a los consumidores a sustancias no identificadas o potencialmente peligrosas.
En este contexto, se entiende que resulta necesario fortalecer los mecanismos de control de calidad y regulación, con el fin de asegurar la autenticidad, seguridad y eficacia de las drogas vegetales disponibles en el mercado.
Referencias
Acosta, M.E.; Ladio, A.H. y Vignale, N.D., 2017. Plantas medicinales comercializadas en la ciudad de San Salvador de Jujuy (Argentina) y su calidad botánica. En: Boletín Latinoamericano y del Caribe de Plantas Medicinales y Aromáticas, 16(1), pp. 34-52.
Agencia Europea de Medicamentos, 2012. Assessment report on Tilia cordata Miller, Tilia platyphyllos Scop., Tilia x vulgaris Heyne or their mixtures, flos [En línea]. Ámsterdam: Agencia Europea de Medicamentos. [Consulta: 10 de febrero de 2025]. Disponible en: https://www.ema.europa.eu/en/documents/herbal-report/final-assessment-report-tilia-cordata-miller-tilia-platyphyllos-scop-tilia-x-vulgaris-heyne-their_en.pdf
Amat, A.G., 1982. Morfología y anatomía comparadas de Chamaemelum nobile (L.) All., Chamomilla recutita L. Rausch. y especies adulterantes. En: Acta Farmaceutica Bonaerense, 1(2), pp. 81-94.
Argentina. Gobierno de la Ciudad Autónoma de Buenos Aires, s.d. Tilo [En Línea]. Buenos Aires: Gobierno de la Ciudad Autónoma de Buenos Aires. [Consulta: 10 de febrero de 2025]. Disponible en: https://buenosaires.gob.ar/espaciopublicoehigieneurbana/gestion-comunal/arbopedia/tilo.
Bercu, R. y Broască, L., 2012. Comparative histoanatomical aspects of the fruit of some apiaceae lindl. fruit used for therapeutic purposes. En: Annals of the Romanian Society for Cell Biology, 7(1), pp. 267-271.
Cañigueral, S.; Dellacassa, E. y Bandoni, A.L., 2003. Plantas Medicinales y Fitoterapia: indicadores de dependencia o factores de desarrollo. En: Acta Farmacéutica Bonaerense, 22(3), pp. 265–279.
Cañigueral, S.; Vila, R. y Wichtl, M., 1998. Plantas medicinales y drogas vegetales: para infusión y tisana: un manual de base científica para farmacéuticos y médicos. Milán: OEMF International. ISBN: 88-7076-216-5.
Cuassolo, F.; Ladio, A. y Ezcurra, C., 2010. Aspectos de la comercialización y control de calidad de las plantas medicinales más vendidas en una comunidad urbana del NO de la Patagonia Argentina. En: Boletín Latinoamericano y del Caribe de Plantas Medicinales y Aromáticas, 9(3), pp. 165–176.
D’Ambrogio de Argüeso, A., 1986. Manual de técnicas en histología vegetal. Hemisferio Sur: Buenos Aires, Argentina.
Figliolo, R.; Besil, N.; Luz-Graña, C.D.; Martínez, G.; Porley, G.; Borghini, I.M.; Cesio, V. y Heinzen, H., 2023. Control de calidad preliminar de hierbas in natura comercializadas en Uruguay. Casos de estudio: manzanilla, marcela y tilo. En: INNOTEC (26 jul-dic), e643. DOI: https://doi.org/10.26461/26.05
Gattuso, M.; Cortadi, A.; Rodriguez, M.V.; Mc Cargo, J.; Retta, D.; Bandoni, A.; Ferraro, G. y Gattuso, S., 2008. Caracteres florales en la identificación de Achyrocline satureioides, Achyrocline flaccida y Gnaphalium gaudichaudianum (Asteraceae-Inuleae). En: Boletín Latinoamericano y del Caribe de Plantas Medicinales y Aromáticas, 7(5), pp. 247-256.
Giangualani, R. N., 1976. Las especies argentinas del género Achyrocline (Compositae). En: Darwiniana, 20(3-4), pp. 549–576.
Jiménez, A., 1992. El libro verde; guía de recursos terapéuticos vegetales. Lima: Instituto Nacional de Medicina Tradicional.
Kljuykov, E.V.; Zakharova, E.A.; Ostroumova, T.A. y Tilney, P.M., 2021. Most important carpological anatomical characters in the taxonomy of Apiaceae. En: Botanical Journal of the Linnean Society, 195(3), pp. 532-544. DOI: https://doi.org/10.1093/botlinnean/boaa082
Madrigal-de la Selva, M.; Mata-Monge, A.; González-Suarez, S. y Alfaro-Mora, R., 2019. Adulterantes presentes en plantas medicinales de mercados municipales en Costa Rica. En: Revista Colombiana de Ciencias Químico-Farmacéuticas, 48(2), pp. 385–395.
Mitrović, M.; Kostić, O.; Miletić, Z.; Marković, M.; Radulović, N.; Sekulić, D.; Jarić, S. y Pavlović, P., 2023. Bioaccumulation of potentially toxic elements in tilia tomentosa moench trees from urban parks and potential health risks from using leaves and flowers for medicinal purposes. En: Forests, 14(11), pp. 2204 - 2222. DOI: https://doi.org/10.3390/f14112204
Molinelli, M.L.; Perissé, P.; Fuentes, E. y Planchuelo, A.M., 2014. Calidad botánica de drogas crudas comercializadas como” canchalagua” en Córdoba, Argentina. En: Boletín de la Sociedad Argentina de Botánica, 49(2), pp. 293-316.
Organización Mundial de la Salud, 2002. Estrategia de la OMS sobre medicina tradicional 2002-2005 (WHO/EDM/TRM/2002.1) [En Línea]. Ginebra: OMS. [Consulta: 07 de mayo de 2025]. Disponible en: https://iris.who.int/handle/10665/67314
Organización Mundial de la Salud, 2011. Quality control methods for herbal materials. Ginebra: OMS.
Paniagua-Zambrana, N.Y.; Bussmann, R.W. y Kikvidze, Z., 2024. Tilia cordata Mill. Tilia platyphyllos Scop. Tilia tomentosa Moench Malvaceae. En: Bussmann, R.W.; Paniagua-Zambrana, N.Y. y Kikvidze, Z., eds. Ethnobotany of the mountain regions of Eastern Europe: Carpathians. Cham: Springer Nature. pp. 1–15. ISBN: 978-3-030-98744-2. DOI: https://doi.org/10.1007/978-3-030-98744-2_285-1
Parodi, L.R.; Burkart, A.E.; Dimitri, M.J.; Costa, C.A.; La Porte, J.; Correa, M.N.; Soriano, A.; Agrasar, R.J.; Barret, W.H. y Bellón, C.A., 1959. Enciclopedia argentina de agricultura y jardinería, 1(2). Buenos Aires: Editorial ACME.
Petrovska, B.B., 2012. Historical review of medicinal plants’ usage. En: Pharmacognosy Reviews, 6(11), pp. 1-5. DOI: https://dx.doi.org/10.4103/0973-7847.95849
Pochettino, M.L.; Arenas, P.; Sánchez, D. y Correa, R., 2008. Conocimiento botánico tradicional, circulación comercial y consumo de plantas medicinales en un área urbana de Argentina. En: Boletín Latinoamericano y del Caribe de Plantas Medicinales y Aromáticas, 7(3), pp. 141-148.
Ramírez-Díaz, M.; Gutiérrez, J. y Terrazas, T., 2024. Leaf architecture and anatomy of eight species of Tilia (Malvaceae). En: Acta Botánica Mexicana, 131, e2332. DOI: https://doi.org/10.21829/abm131.2024.2332
Strelnikov, B.G. y Gürdal, B., 2024. Anatomy and micromorphology of Tilia species from Turkey and its taxonomic implication. En: Microscopy Research and Technique, 87(11), pp. 2625–2635. DOI: https://doi.org/10.1002/jemt.24634
Tabakián, G., 2017. Etnomedicina y Etnobotánica en el departamento de Tacuarembó, Uruguay. En: Revista Uruguaya de Antropología y Etnografía, 2(2), pp. 61–72. DOI: https://doi.org/10.29112/2.2.4
Tabakian, G., 2019. Estudio comparativo de plantas medicinales vinculadas a tradiciones indígenas y europeas en Uruguay. En: Bonplandia, 28(2), pp. 135-158.
Turano, F.A. y Cambi, V.N., 2009. Control de calidad de mezclas de hierbas medicinales que se comercializan como adelgazantes y/o reductoras en Bahía Blanca, Argentina. En: Latin American Journal of Pharmacy, 28(1), pp. 10–18.
Uruguay. Decreto 403/016, de 19 de diciembre de 2016. Diario Oficial [En línea], 29 de diciembre de 2016. [Consulta: 10 de febrero de 2025]. Disponible en: https://www.impo.com.uy/bases/decretos-originales/403-2016
Uruguay. Decreto 289/018, de 10 de septiembre de 2018. Diario Oficial [En línea], 19 de septiembre de 2018. [Consulta: 10 de febrero de 2025]. Disponible en: https://www.impo.com.uy/bases/decretos/289-2018
Valenzuela, B., 2004. El consumo de té y la salud: características y propiedades benéficas de esta bebida milenaria. En: Revista Chilena de Nutrición, 31(2), pp. 72-82.
Xifreda, Cecilia C., 1998. Publicación válida, tipificación y jerarquía notosubespecífica para Tilia Xmoltkei (Tiliaceae). En: Darwiniana, 35(1-4), pp. 147-150.


