Se presenta la validación de una metodología para la estimación del biovolumen a nivel de organización celular y filamentoso del fitoplancton en el embalse de Salto Grande. La relevancia de este trabajo radicó en su capacidad para generar datos confiables en el ámbito de la ecología, que respaldan decisiones críticas en la gestión ambiental, a la vez que se alinean con las normativas internacionales y locales sobre el monitoreo de la calidad del agua. Se realizó un esfuerzo por integrar el aseguramiento de la calidad metodológica y la investigación ecológica y sanitaria, coincidiendo con criterios establecidos en normativas como la European Commission (2000) y la Norma UNE 14996:2007 (Asociación Española de Normalización y Certificación, 2007), las cuales contribuyen a una adecuada gestión de los recursos hídricos. El objetivo principal de este estudio radicó en la valoración precisa de los riesgos ecológicos y sanitarios relacionados con los organismos formadores de floraciones identificados en el embalse que impactan en el uso de las áreas recreativas. Los resultados indican que el método analítico validado presenta un alto grado de reproducibilidad y precisión, ambos con valores menores al 10 %, características esenciales para cualquier técnica que aspire a ser utilizada en el monitoreo ambiental.
Palabras clave: monitoreo de rutina, normativa, indicador ecológico, cianobacterias.
Apresenta-se a validação da metodologia para a estimativa do biovolume a nível de organização celular e filamentosa de fitoplâncton no reservatório de Salto Grande. A relevância deste trabalho reside na sua capacidade de gerar dados confiáveis no âmbito da ecologia, que apoiam decisões críticas na gestão ambiental, ao mesmo tempo em que se alinham com as normativas internacionais e locais sobre o monitoramento da qualidade da água. Foi realizado um esforço para integrar a garantia da qualidade metodológica e a pesquisa ecológica e sanitária, coincidindo com critérios estabelecidos por normativas como a European Commission (2000) e a Norma UNE 14996:2007 (Asociación Española de Normalización y Certificación, 2007), as quais contribuem para uma adequada gestão dos recursos hídricos. O objetivo principal deste estudo foi a avaliação precisa dos riscos ecológicos e sanitários relacionados aos organismos formadores de florações identificados no reservatório, que impactam o uso das áreas recreativas. Os resultados indicam que o método analítico validado apresenta alto grau de reprodutibilidade e precisão, ambos com valores inferiores a 10 %, características essenciais para qualquer técnica que aspire a ser utilizada no monitoramento ambiental.
Palavras-chave: monitoramento de rotina, normativa, indicador ecológico, cianobactérias.
Introducción
La validación de métodos analíticos es un proceso crucial para asegurar que un sistema de medición en un laboratorio cumpla con los requisitos establecidos para su uso previsto. Según la Norma ISO 17025:2017 (International Organization for Standarization, 2017a), apartado 3, incisos 3.8 y 3.9, la validación implica la “aportación de evidencia objetiva de que un ítem dado satisface los requisitos especificados, cuando los requisitos especificados son adecuados para su uso previsto”. Este proceso no se limita al método en sí, sino que abarca la capacidad del sistema analítico completo del laboratorio para reproducir un proceso de medición de manera consistente, siguiendo un protocolo de ensayo detallado. Es, en esencia, la confirmación de la aptitud de un método antes de autorizar su uso en el laboratorio, como se menciona en las Directrices para la Acreditación de Laboratorios Ambientales (Red de Laboratorios Ambientales del Uruguay et al., 2009).
En el ámbito de la ecología, la importancia de contar con datos confiables y verificables es cada vez más reconocida, especialmente en el contexto de la actualización de criterios guía y legislación internacional, los cuales establecen niveles de alerta asociados a una gestión del riesgo ante floraciones de cianobacterias, factores claves para una adecuada vigilancia sanitaria en áreas recreativas y en el monitoreo de la calidad del agua para consumo (European Commission, 2000; Chorus y Welker, 2021; Argentina - Uruguay. Comisión Administradora del Río Uruguay, 2019). Es por esta razón que los datos ecológicos obtenidos a partir de programas de monitoreo de la calidad del agua en diversos cuerpos de agua deben ser precisos y estar respaldados por metodologías validadas.
En este sentido, se realizó una búsqueda de normas nacionales e internacionales enfocadas en lineamientos sobre el aseguramiento de la calidad, específicamente de las evaluaciones biológicas y ecológicas. Si bien existen en la región normativas que establecen criterios de calidad de agua, estas no especifican directrices para la validación de metodologías en la determinación de la estimación del biovolumen del fitoplancton. Al respecto, los principios de aseguramiento de la calidad recogidos en la Norma UNE 14996:2007 (Asociación Española de Normalización y Certificación, 2007) son aplicables a todas las organizaciones que producen datos de tipo ecológicos y a todos los trabajos de campo y de laboratorio. La norma proporciona directrices detalladas para el diseño de estudios, muestreo, análisis, validación de resultados, manejo de la incertidumbre y la interpretación de informes. Estas directrices aseguran que las evaluaciones sean precisas, reproducibles y representativas del estado del medio ambiente acuático. Por esta razón la aplicación de la Norma UNE-EN 14996:2007 (Asociación Española de Normalización y Certificación, 2007) en Argentina y Uruguay es novedosa, ya que introduce un enfoque específico y detallado, mejorando significativamente la precisión y consistencia de los monitoreos ambientales en la región, dado que proporciona una guía clara y estructurada para llevar a cabo estas evaluaciones.
El fitoplancton es un indicador clave de la calidad del agua y es uno de los elementos más utilizados para evaluar el estado ecológico de las aguas superficiales (European Commission, 2000). En la actualidad, las autoridades encargadas del monitoreo rutinario de sistemas acuáticos a nivel mundial emplean diversos parámetros del fitoplancton, como la composición, abundancia, biomasa y recurrencia de floraciones, para evaluar la calidad del agua (Ren et al., 2017). Sin embargo, las técnicas convencionales para estimar la biomasa, como la medición de la concentración de clorofila a o el recuento de células mediante el método Uthermöl (Edler y Elbrächter, 2010; Chorus y Welker, 2021), presentan limitaciones significativas. Estas técnicas no capturan la diversidad de tamaños celulares y niveles de organización presentes en las comunidades naturales de fitoplancton, lo que puede llevar a estimaciones erróneas de la biomasa.
La técnica de biovolumen ha emergido como una de las metodologías más adecuadas y ampliamente utilizadas en estudios de ecología acuática (Hillebrand et al., 2015; Saccà, 2017; Aguilera et al., 2023; Bonilla y O’Farrell, 2023), especialmente para evaluar riesgos asociados a algas y cianobacterias que pueden contener metabolitos nocivos o tóxicos. Esta técnica, que sigue las directrices de la Organización Mundial de la Salud y regulaciones como la UNE-EN 16695:2016 (Asociación Española de Normalización y Certificación, 2016), consiste en medir el volumen individual de cada célula o colonia de algas y convertirlo en biomasa mediante un factor específico para cada especie. El uso de formas geométricas estandarizadas y la aplicación de fórmulas adecuadas mejora la comparabilidad de los datos de fitoplancton y representa un avance significativo hacia la implementación de medidas de aseguramiento de la calidad en el análisis del fitoplancton.
En este trabajo se evaluó un método analítico validado para estimar el biovolumen de fitoplancton, a fin de de valorar con precisión los riesgos ecológicos en el embalse de Salto Grande, con el objetivo específico de disponer de una mejor variable para identificar el riesgo asociado a la proliferación de cianobacterias de reconocida toxicidad e incorporar su uso en los monitoreos de rutina de la región. Según la Organización Mundial de la Salud (World Health Organization, 2020), las normativas para aguas recreativas establecen tres niveles de alerta basados en la concentración de clorofila a, el biovolumen de cianobacterias y los niveles de cianotoxinas. Comprender estos factores es clave para una adecuada gestión de los recursos acuáticos y para realizar análisis de riesgo, especialmente en situaciones donde se desarrollan grandes floraciones o acumulaciones de cianobacterias. Esto permite tomar decisiones informadas en el estudio de la biomasa del fitoplancton en el embalse de Salto Grande y contribuye a la gestión sostenible de estos ecosistemas.
Materiales y Métodos
Área de Estudio
El presente trabajo se realizó en el embalse de Salto Grande, cuerpo de agua ubicado en el cauce principal del bajo río Uruguay (29°43′ a 31°12′S; 57°06′ a 57°55′W; Figura 1) en áreas próximas a la represa binacional de Salto Grande, a pocos kilómetros al norte de las ciudades de Concordia (Argentina) y Salto (Uruguay). Es un gran embalse tipo río subtropical, que se caracteriza por su forma alargada y su conexión directa con el cauce fluvial del río Uruguay, lo que influye en su dinámica hídrica y ecosistemas acuáticos asociados. Tiene una superficie de 750 km2, con su eje mayor en dirección NS de 144 km de longitud, una profundidad media de 6,4 m y profundidad máxima de 35 m, y un tiempo medio de retención de 11,3 días (Chalar, 2006; O’Farrell et al., 2012; Bordet et al., 2017).
Los aportes del río Uruguay en este tramo presentan un período de aguas altas de abril a noviembre y una fase de aguas bajas en el verano, entre diciembre y marzo. El embalse es polimíctico, con estratificación en condiciones de descarga baja del río. Es considerado un sistema cálido tropical por su temperatura media anual mayor a 15 ℃ y su temperatura mínima superior a 10 ℃ (Salas y Martino, 1990) y vientos predominantes del NE y SO con promedios anuales de 7 y 14 kmh-1 respectivamente. La descarga media anual de agua es de unos 5.000 m3 s -1, con registros mínimos y máximos de 434 y 29730 m3 s -1 respectivamente (Bordet et al., 2017). Se presenta como un ambiente dendrítico con múltiples brazos, con dos subunidades diferenciadas. Una zona central que abarca el 70 % de la superficie total y cinco brazos laterales con características distintas. Es un cuerpo de agua eutrófico (O’Farrell et al., 2012; Bordet et al., 2017) y en cuanto al fitoplancton, las cianobacterias de identificada toxicidad dominan principalmente en los sitios brazos (arroyos laterales del embalse), representados por especies de Microcystis sp. y Dolichospermum sp. En el cauce principal, con un aporte significativo en la abundancia, se encuentran presentes especies de las clases diatomeas, algas verdes, dinoflagelados (Quirós y Luchini, 1983; De León y Charlar, 2003; Bordet et al., 2017). Este sistema tiene múltiples propósitos: producción de energía, agua potable y actividades recreativas, estas últimas afectadas recurrentemente por floraciones de cianobacterias.
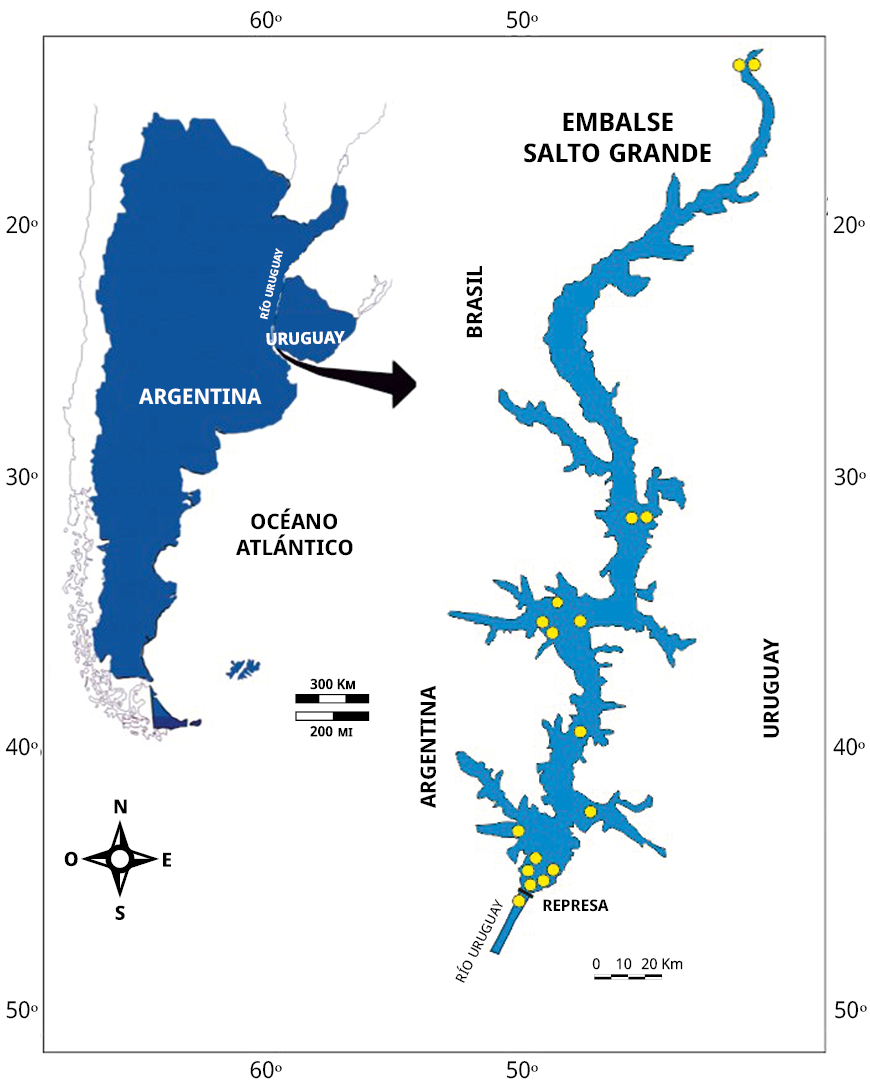
Figura 1. Mapa del Embalse Salto Grande y ubicación de los sitios de muestreo en el río Uruguay, aguas debajo de la presa.
Diseño de muestreo
Las muestras analizadas se obtuvieron del programa de monitoreo sobre la calidad ambiental del embalse que la Comisión Técnica Mixta de Salto Grande desarrolla desde el 2007 dentro de su Plan de Sustentabilidad Ambiental. Dicho programa tiene un enfoque ecológico y sanitario vinculado con las floraciones algales, con énfasis en cianobacterias en el embalse de Salto Grande.
Se procesaron 104 muestras de agua de superficie de acuerdo con las directrices de la Norma UNE 15204:2006 (Asociación Española de Normalización y Certificación, 2006) en su apartado 6; distribuidas en 17 sitios, comprendidos en sitios tipo litoral (playa) y canal (cauce principal y tributarios), en el eje NS y EO, desde la cabecera del embalse próximo a las ciudades de Monte Caseros (Argentina) y Bella Unión (Uruguay) y a unos 2000 m aguas abajo de la represa, en el río Uruguay (ver Figura 1). Las muestras se tomaron con una frecuencia semanal en época cálida (estival) y mensual en época fría (invernal), durante el periodo 2021-2023.
Para el registro de las condiciones en las que se realizó el estudio, se determinaron in situ variables fisicoquímicas mediante sonda multiparamétrica YSI DSPro en los sitios de muestreo, con su correspondiente geolocalización. Los datos hidrológicos y meteorológicos fueron proporcionados por el Área de Hidrología de la Comisión Técnica Mixta de Salto Grande.
Equipos
Para el análisis de rutina del fitoplancton y las mediciones del volumen celular y filamentoso se empleó un microscopio óptico invertido Nikon Eclipse TS100. Los aumentos utilizados en la validación fueron: 40x,100x, 400x, 600x; una cámara LANE optical technologies y el software Pixit Pro.A y Micrometric SE Premium 4, el cual se calibró mediante portaobjetos micrómetro de calibración y micrómetro ocular (Cabrera et al., 2008). Se emplearon cámaras de sedimentación de Utermöhl según la Norma 15204:2006 (Asociación Española de Normalización y Certificación, 2006) en su apartado 5 y, material in vivo fijado con Lugol, de los diferentes sitios del embalse.
Taxonomía, identificación y mediciones
Por el interés de vigilancia sanitaria ante la producción de cianotoxinas en el embalse de Salto Grande, la identificación para cianobacterias se realizó a nivel de especies, considerando la presencia, forma y tamaño de atributos morfológicos siguiendo a Komárek y Anagnostidis (1999; 2005) y Komárek (2013). La identificación taxonómica de C. furcoides, especie formadora de floraciones en el embalse, se llevó a cabo según las descripciones de Calado y Larsen (1997) y Popovský y Pfiester (1990). Para el resto de los individuos observados se llegó a nivel de género siguiendo el criterio de Bourrelly (1966, 1968, 1970); Parra y Bicudo (1995). Una submuestra de especímenes de las muestras y registro fotográfico fueron conservados y permanecen en el laboratorio de Química Ambiental (QA), para referencia de los analistas y como archivos para estudios posteriores.
Las estimaciones del biovolumen se realizaron a nivel celular, filamentoso y colonial, y para dichos cálculos se trabajó con 9 formas geométricas descritas por la Norma UNE-EN 16695:2016 (Asociación Española de Normalización y Certificación, 2016) en su Anexo A, de acuerdo con cada taxón (esfera, esferoide, cilindro, cilindro elíptico, prisma rómbico, esferoide alargado, huso, elipsoide y diámetro de la cintura para Ceratium) (Ver Tabla 1). Cuando una figura geométrica asignada no se ajustó al volumen efectivo, el resultado se multiplicó por un “factor de corrección” de la forma geométrica para estimar de modo preciso el volumen, en base a un listado de taxones establecidos con las formas geométricas, factor de corrección y factor de dimensión oculta (Napiórkowska-Krzebietke y Kobos, 2016; Asociación Española de Normalización y Certificación, 2016).
Tabla 1. Asignación según la taxa del nivel de organización, la forma geométrica y su fórmula correspondiente para el cálculo de medidas lineales requeridas y cálculo del volumen.
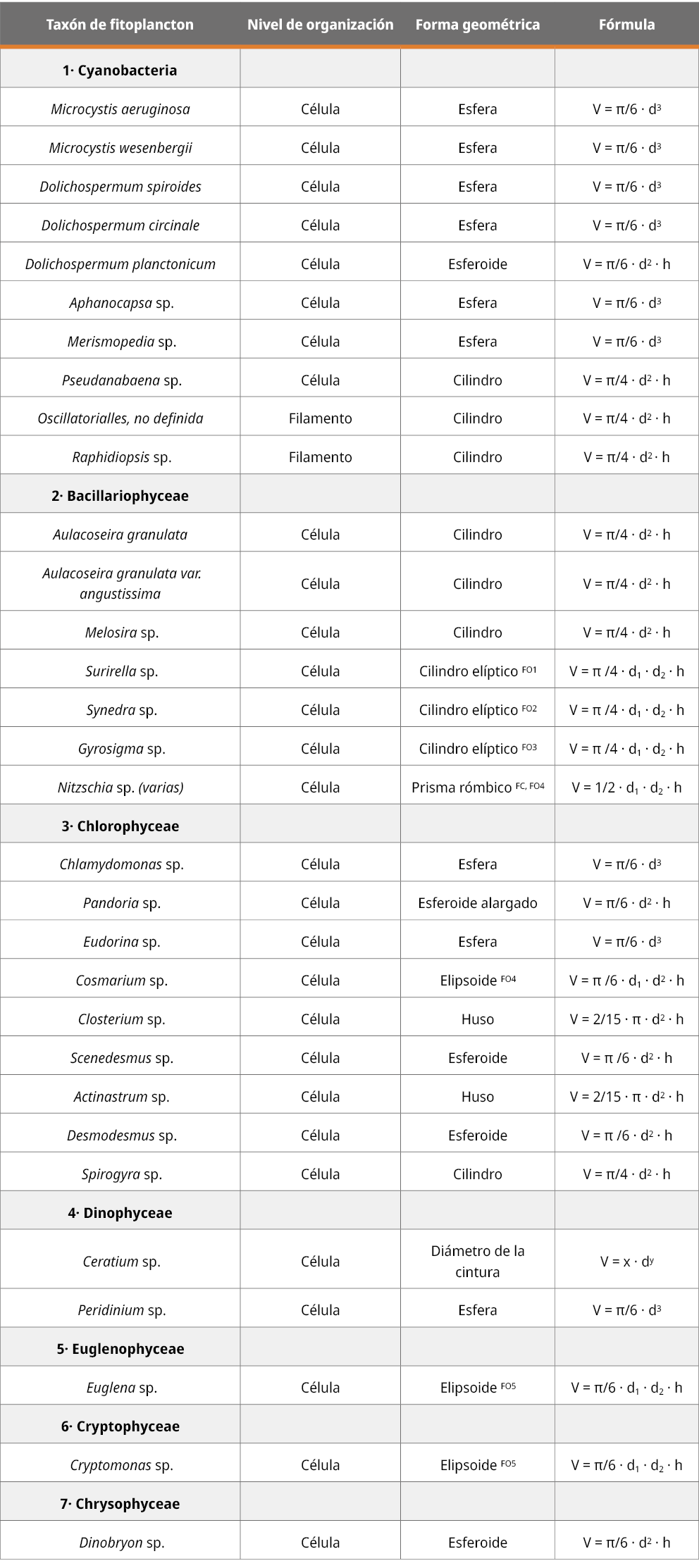
FC: factor de corrección de forma geométrica (por 1,15).
FO: factor de dimensión oculta 1: h = 0,89 x d2; 2: h = 1,00 x d2; 3: h = 0,50 x d2; 4: d2 = 0,60 x d1; 5: d2 = 0,80 x d1.
Las dimensiones (diámetro y altura) requeridas de las formas geométricas relevantes se midieron para cada taxón identificado, en base a las medianas de las medidas. En aquellos organismos que se determinó esfera como forma geométrica, no se realizaron mediciones en estado de división celular. En base a la variabilidad de las muestras analizadas, en los organismos formadores de colonias se midieron varias células de una misma colonia y de varias colonias de diferentes muestras, siendo un promedio de 13 células por taxón en aquellos muestreos donde estuvieron presentes. En las filamentosas (Raphidiopsis spp. y Oscillatoriales spp.) se midió un promedio de 10 fragmentos de filamentos de una longitud fija (100µm) en cada muestreo. En Dolichospermum spp., se midieron en promedio 15 células por filamento y de varios filamentos de diferentes muestras según la Norma UNE-EN 16695:2016 (Asociación Española de Normalización y Certificación, 2016), en su apartado 6.4 y 6.3.
Características de funcionamiento del método
Se seleccionaron para la validación del método los siguientes parámetros de funcionamiento: límite de detección cuantitativo y óptico, repetibilidad (error estándar e intervalos de confianza), reproducibilidad e incertidumbre estándar de la medición.
En relación con el límite de detección cuantitativo y el límite de detección óptico, fueron calculados mediante los criterios establecidos en la Norma UNE-EN 15204:2006 (Asociación Española de Normalización y Certificación, 2006) en su apartado 7.3.2.3. El límite de detección se determinó mediante estadísticas de Poisson, calculándolo a partir del número de determinaciones con probabilidad de P = 0,95 (-In 0,05) para cada volumen de cámara de sedimentación. Siendo el valor más restrictivo alcanzado para la cámara de 25 ml, en donde se obtiene la mínima unidad de medida cuantificable igual a 1 cel-individuo/ml. A partir de este valor de 1 cel-individuo/ml y en función de cada forma geométrica se realizó el cálculo del biovolumen para las diferentes taxas estudiadas, ningún valor de biovolumen calculado por la mínima medida de cuantificación superó 1 mm3/L. A su vez se corrobora el valor de 1 mm3/L como menor valor de referencia establecido en la Organización Mundial de la Salud (Chorus y Welker, 2021), para los niveles de vigilancia sanitaria, por lo que el valor obtenido del 1 mm3/L como límite de cuantificación es apto para el uso normativo.
Para el estudio de repetibilidad se realizó el cálculo de error estándar y límites de confianza (con un intervalo de confianza de un 95 %) para cada taxa identificada, basados en la definición del grado de cercanía entre los resultados obtenidos en sus sucesivas mediciones realizadas en las mismas condiciones de medidas como lo establece la Norma UNE-EN 16695:2016 (Asociación Española de Normalización y Certificación, 2016) en su apartado 6.3.
La reproducibilidad se obtuvo mediante la precisión intermedia, concepto que refiere a la variabilidad observada en un conjunto de mediciones realizadas dentro de un mismo laboratorio, pero bajo condiciones ligeramente diferentes, como pueden ser distintos días, diferentes operadores, diferentes equipos o variaciones ambientales.
Desde una perspectiva metrológica y estadística, la precisión intermedia integra dos componentes clave: la repetibilidad (o repetitividad) y la reproducibilidad. La repetibilidad (Sr) se refiere a la variabilidad entre mediciones obtenidas por el mismo operador bajo condiciones constantes, mientras que la reproducibilidad (SRw) refleja la variabilidad entre mediciones realizadas por diferentes operadores o en diferentes condiciones. La precisión intermedia se calculó a través de la siguiente ecuación:
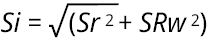
Donde:
Si es la precisión intermedia.
Sr es la desviación estándar de la repetibilidad, calculada a partir de la variabilidad de las mediciones realizadas repetidamente por un solo operador en condiciones controladas.
SRw es la desviación estándar de la reproducibilidad, calculada a partir de la variabilidad de las mediciones realizadas por diferentes operadores o en condiciones variadas de equipos o tiempos.
Este parámetro es crucial para evaluar la confiabilidad de un método de medición en situaciones reales, ya que proporciona una estimación de la variabilidad que puede esperarse cuando se utiliza el mismo procedimiento en condiciones que no son completamente constantes. En este estudio, la precisión intermedia se evaluó a través de la realización de mediciones con dos analistas en distintas condiciones de medida, tales como diferentes tiempos, localizaciones, instrumentos y software, con un total de 36 mediciones por analista. La variabilidad observada en estos estudios permite inferir la robustez y confiabilidad del método de medición en condiciones reales y variadas (Magnusson et al., 2017).
El criterio de aceptación no se encuentra establecido en la Norma UNE-EN 16695:2016 (Asociación Española de Normalización y Certificación, 2016), no establece el criterio de aceptación para la reproducibilidad, por lo que en este trabajo nos basamos en Lund et al. (1958), que establece para un nivel de significancia del 95 % un valor inferior al 20 %.
La estimación de la incertidumbre estándar técnica de la medida en µm (micrómetro), se analizó utilizando la componente del límite de la reproducibilidad intralaboratorio según la definición expresada en la Norma ISO 3534-2:2006 (International Organization for Standarization, 2006) apartado 3.3.10 y 3.3.11, para dos taxa dominantes y de interés en el monitoreo de vigilancia sanitaria del embalse por su identificada toxicidad (Microcystis aeruginosa y Dolichospermum sp.). Por un lado, se realizó la prueba de análisis de varianza (ANOVA) para conocer el comportamiento de distribución de los datos obtenidos, como el de homocedasticidad, estableciendo como fuentes de variación los siguientes factores: analistas, periodo de tiempo, equipos, abundancia y sitios de estudios, como lo establece la Norma ISO 5725-3:2023 (International Organization for Standarization, 2023) en su apartado 6.2.2.
El límite de reproducibilidad intralaboratorio fue calculado de acuerdo a lo definido en la Norma 5725-6:1994 (International Organization for Standarization, 1994), apartado 4; de la siguiente forma: R = t * √2 * σR, en donde t es el valor de Student de dos colas con ѵ (grados de libertad) igual a 30 para los datos obtenidos para Microcystis aeruginosa y, ѵ = 52 para Dolichospermum sp.; con un nivel de confianza del 95 % y la desviación estándar relativa medida bajo las condiciones de reproducibilidad (σR) para Microcystis aeruginosa y Dolichospermum sp. Por otro lado, la incertidumbre expandida U fue calculada como el múltiplo de la reproducibilidad por un factor de cobertura K = 2, con un nivel del 95 % de confianza de acuerdo a lo establecido en la Norma ISO 21748:2017 (International Organization for Standarization, 2017b), en su apartado 6.1 y 6.2.
Resultados
Composición taxonómica
Una vez establecida la metodología, se presentan los resultados sobre los taxones de fitoplancton. Se determinaron 31 taxa de organismos fitoplanctónicos, identificados en muestras del embalse de Salto Grande; de los cuales 10 pertenecen a Cyanobacteria, 7 a Bacillariophyceae, 9 a Chlorophyceae, 2 a Dinophyceae, 1 a Euglenophyceae, 1 a Cryptophyceae y 1 a Chrysophyceae.
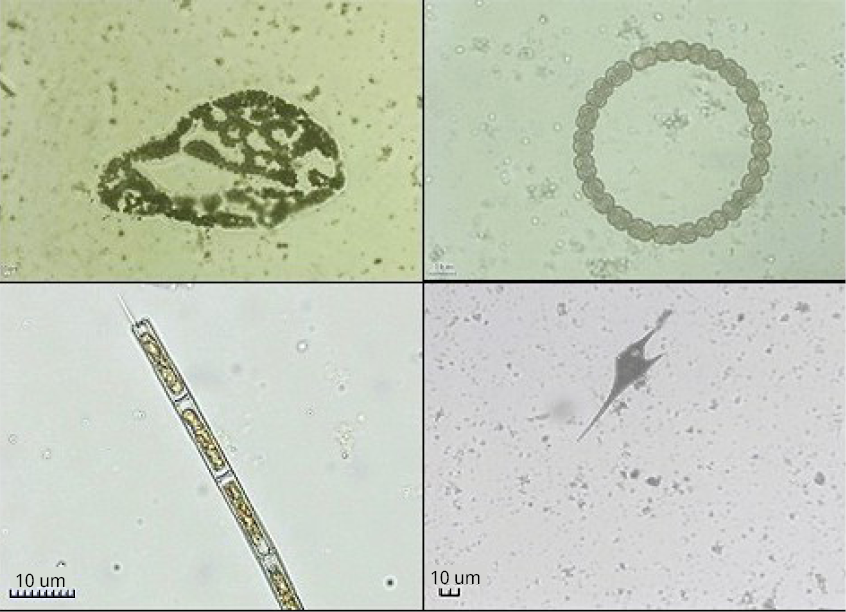
Figura 2. Imágenes de algunos organismos del fitoplancton formadores de floraciones en el embalse de Salto Grande. Microcysistis wesenbergii (10x), Dolichospermum circinale (10x); Aulacoseira granulata (10x) y Ceratium furcoides (10x).
Parámetros de desempeño
Con respecto a los parámetros de desempeño, el límite de detección cuantitativo calculado fue de 1 mm3/L para todas las taxa y el límite óptico, de 2 µm.
El error estándar calculado para los 31 taxones medidos estuvo por debajo del valor del 10 %, en un 87 % (n: 27) y un 13 % (n: 4) igual o mayor a un error estándar de 15 %, con un máximo de 16,1 %. Estos resultados se encuentran asociados a la medición de la cantidad células/individuos, su variabilidad de tamaño, y su frecuencia en el ambiente. A su vez se calcularon los respectivos intervalos de confianza para los 31 taxones, con un nivel de probabilidad del 95 %, (p: 0,05) (Tabla 2).
Tabla 2. Resultados promedio de la estimación de la biomasa, expresados en unidades de volumen celular (µm3) obtenidos para cada taxón, error estándar porcentual según la Norma (≤10 %), cantidad de células/individuos medidos (n) e intervalo de confianza.
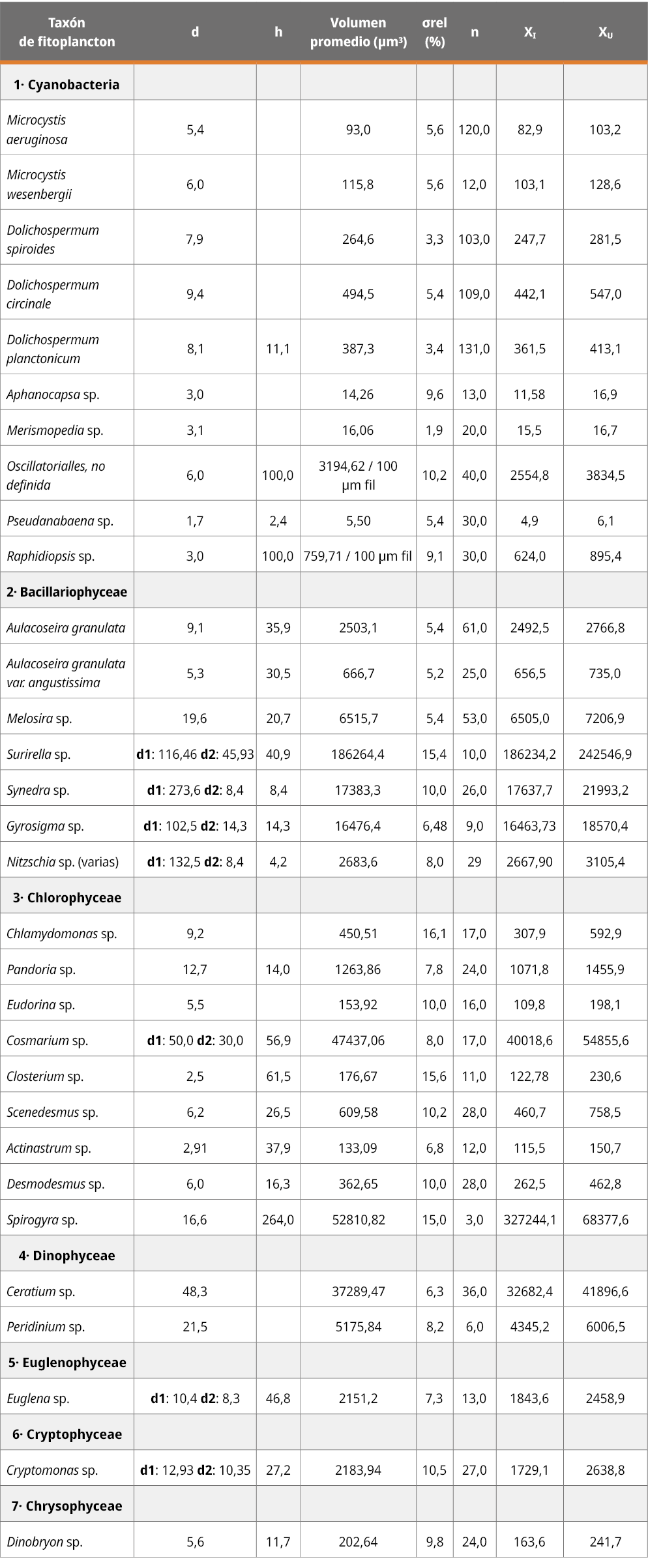
d: mediana de los diámetros medidos en los “n”, respectivos de cada taxón.
h: mediana de las alturas medidas en los “n”, respectivo de cada taxón.
σrel (%): error estándar porcentual.
n: número de cel/individuos medidas correspondientes al taxón.
xi: límite inferior del intervalo de confianza al 95 %.
xu: límite superior del intervalo de confianza al 95 %.
El cálculo del parámetro reproducibilidad experimental del método fue del 10 % con una cantidad de 72 medidas, en condiciones diferentes de análisis.
El valor calculado de la estimación de incertidumbre intralaboratorio para el rango de las medidas en µm del diámetro celular para Microcystis aeruginosa fue de 12 % y para Dolichospermum sp., del 8 % (Tabla 3).
Tabla 3. Resumen de los resultados de la estimación de la incertidumbre a partir del límite de la reproducibilidad intralabortatorio.
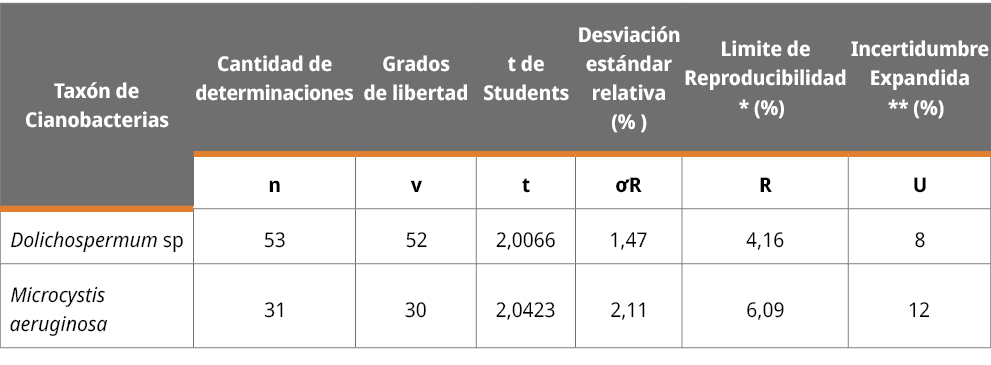
(*) El límite de reproducibilidad intralaboratorio fue calculado de la siguiente forma:
R = t*√ 2*σR, en donde t es el valor de Student de dos colas con ѵ (grados de libertad) igual a 30 para los datos obtenidos para Microcystis aeruginosa y ѵ = 52 para Dolichospermum sp., con un nivel de confianza del 95 %; y σR es la desviación estándar relativa medida bajo las condiciones de reproducibilidad para Microcystis aeruginosa y Dolichospermum sp.
(**) Incertidumbre expandida U: intervalo de incertidumbre se encuentra representado por un factor de cobertura K = 2, con un nivel del 95 % de confianza.
Discusión y Conclusiones
Los resultados obtenidos en este trabajo permitieron validar y establecer los parámetros de desempeño del método de estimación de biovolumen de fitoplancton desarrollado en el laboratorio, contribuyendo al control y precisión del proceso metodológico, incorporando el aseguramiento de la calidad en la estimación de la variable biovolumen.
Se trata de la primera vez que se utiliza una norma como la UNE 14996:2007 (Asociación Española de Normalización y Certificación, 2007) para verificar la calidad de los datos ecológicos obtenidos del medio ambiente acuático en la gestión ambiental del embalse, la cual está diseñada para completar aquellas que indican directrices generales sobre el aseguramiento de la calidad como la Norma ISO 17025:2017 (International Organization for Standarization, 2017a). Con este método validado se logra disponer de la mejor variable para lograr de forma estandarizada y ágil un método que ha mostrado ser óptimo para el análisis cuantitativo del fitoplancton en el embalse, siendo útil en diferentes ámbitos: monitoreo de la calidad del agua (Hoehn et al., 1998), estudios ecológicos funcionales (Reynolds et al., 2002) y clasificación y modelización de ecosistemas como lo menciona la Norma UNE-EN 16695:2016 (Asociación Española de Normalización y Certificación, 2016) en su apartado 0 (Introducción). Además, su aplicación en la identificación de floraciones de cianobacterias y su toxicidad resulta clave para la vigilancia sanitaria (Bonilla y O’Farrell, 2023), porque es la variable que mejor refleja la contribución de las cianobacterias a la biomasa del fitoplacnton, considerando especialmente que estas son la clase dominante del fitoplancton en el embalse durante épocas cálidas con reconocida toxicidad (Chalar et al., 2002; Bordet et al.,&mbsp;2017).
La incorporación de biovolumen como indicador ecológico, estimado mediante metodología basada en las especificaciones de la Norma UNE-EN 16695:2016 (Asociación Española de Normalización y Certificación, 2016), facilita una evaluación precisa y reproducible del estado ecológico del sistema acuático y, es una mejora significativa frente a mediciones tradicionales en monitoreos de rutina de empresas potabilizadoras y organismos de control de la calidad del agua para uso recreativo (clorofila a, o densidad de organismos o células), que podrían subestimar la diversidad y biomasa del fitoplancton. Este enfoque refuerza la importancia del esfuerzo en integrar el uso de estimaciones de biovolumen propias (a distintos niveles de organización y objetivos), evitando la extrapolación de datos de otros ecosistemas que podría introducir sesgos en la evaluación de la biomasa (Olenina et al., 2006); influyendo en la alerta temprana sobre los riesgos sanitarios asociados.
Por esta razón, la incorporación de la medida de la incertidumbre, según lo propuesto por la Norma UNE 14996:2007 (Asociación Española de Normalización y Certificación, 2007) en su apartado 10, asegura que los resultados sean consistentes y comparables internacionalmente respecto a valores guías de la calidad del agua.
La estimación de la incertidumbre intralaboratorio desarrollada en este trabajo persiguió conocer la validez de las mediciones realizadas y la estimación de incertidumbre según la significación estadística de los resultados. Si bien fue calculada a partir del límite de la reproducibilidad, factor que nos brinda información sobre la precisión intermedia de la metodología de medida; es de gran aporte para garantizar la calidad de los datos generados, sobre todo cuando se carece de ensayos de interlaboratorios accesibles y desarrollados en la región.
La estrategia de trabajar integrando las medidas a nivel de especies y géneros fue adoptada en función de los recursos disponibles (habilidades técnicas avanzadas, costos y tiempo del análisis), y el contexto ecológico del embalse (recurrentes floraciones estivales de cianobacterias, y multiples usos). Dentro de este enfoque balanceado, combinando ambos niveles de identificación, se obtuvieron detalles específicos como una comprensión general de las comunidades de fitoplancton en la gestión.
El análisis basado en biovolumen identificó tres grupos algales principales: Cyanophyta, Chlorophyta y Bacillariophyceae, que representaron aproximadamente el 100 % de la biomasa en la mayoría de las muestras. Esto es consistente con registros históricos del embalse tanto en el cauce principal, los brazos, como en distintas estaciones (estival e invernal) y profundidades (Chalar et al., 1993; De León y Chalar, 2003; Bordet, 2004; O’Farrell et al., 2012; Izaguirre et al., 2018; Bordet et al., 2017) y comparable con estudios de otros lagos donde el biovolumen es un indicador clave para la gestión ambiental (Canfield et al., 2019).
Para los taxones de cianobacterias de importancia sanitaria por su producción de toxinas, como Microcystis aeruginosa y Dolichospermum spp., los volúmenes celulares obtenidos se alinean con valores reportados previamente (Bonilla y O’Farrell, 2023; Chorus y Welker, 2021), con ligeras variaciones que reflejan las condiciones específicas del embalse. De manera similar, en Bacillariophyceae, Aulacoseira granulata mostró volúmenes celulares con alta precisión (±5,3 %) y resultados superiores a los reportados en otros estudios (Olenina et al., 2006; Reyes Motavita et al., 2023).
Además, se registró una presencia de Dinophyceae en las estaciones de muestreo del embalse. El caso de Ceratium furcoides, especie registrada con alto biovolumen (Bordet et al., 2017), mostró un volumen similar al de otros estudios con un error estándar menor al 10 %; lo que refleja una precisión mejorada para la estimación de su biomasa (Napiórkowska-Krzebietke y Kobos, 2016). No obstante, se reconoce la necesidad de establecer líneas futuras de trabajo que integren el análisis a nivel de especies en lugar de género, lo cual brindaría estimaciones más precisas del biovolumen y podría influir significativamente en las evaluaciones de biomasa.
En conclusión, el método validado ofrece una herramienta confiable para la estimación del biovolumen de fitoplancton en el embalse con características subtropicales, cumpliendo con las normativas internacionales de calidad. Su aplicación tiene un impacto positivo en la gestión ambiental, pudiendo ser incluido en un protocolo operativo estándar para facilitar su adopción en la vigilancia sanitaria, posicionándolo como una metodología replicable y valiosa para el estudio y la gestión de ecosistemas acuáticos.
Agradecimientos
Los autores agradecen al ingeniero Martín Irigoyen, del Área de Gestión Ambiental de la Comisión Técnica Mixta de Salto Grande (Argentina–Uruguay), por su asistencia en el desarrollo del soporte informático para el registro y los cálculos de la metodología de medida, y a la licenciada en Gestión Ambiental Ernestina Fiorotto y al maestro mayor de obras Gustavo Gilbert, por su asistencia en las campañas de monitoreo en el embalse.
Referencias
Aguilera, A.; Almanza, V.; Haakonsson, S.; Palacio, H.; Benitez Rodas, G. A.; Barros, M. U. G.; Capelo-Neto, J.; Urrutia, R.; Aubriot, L. y Bonilla, S., 2023. Cyanobacterial bloom monitoring and assessment in Latin America. En: Harmful Algae, 125. DOI: https://doi.org/10.1016/j.hal.2023.102429
Argentina - Uruguay. Comisión Administradora del Río Uruguay, 2019. Resolución N° 28/2019. Digesto sobre el uso y aprovechamiento del río Uruguay. [En línea]. Paysandú: CARU. [Consulta: 11 de diciembre de 2024]. Disponible en: https://www.caru.org.uy/web/pdfs_publicaciones
Asociación Española de Normalización y Certificación, 2016. UNE-EN 16695: Calidad de agua. Guía para la estimación del biovolumen de fitoplancton. Madrid: AENOR.
Asociación Española de Normalización y Certificación, 2007. UNE-EN 14996: Calidad del agua. Guía para el aseguramiento de la calidad de las evaluaciones biológicas y ecológicas en el medio ambiente acuático. Madrid: AENOR.
Asociación Española de Normalización y Certificación, 2006. UNE-EN 15204: Guía para el recuento de fitoplancton por microscopía invertida (Técnica Utermöhl). Madrid: AENOR.
Bonilla, S. y O’Farrell, I., 2023. La importancia de usar el biovolumen en estudios de fitoplancton y monitoreo ambiental de cianobacterias. En: Ecología Austral, 33(2), pp. 558–566. DOI: https://doi.org/10.25260/EA.23.33.2.0.2148.
Bordet, F. H., 2004. Estudio del comportamiento estacional de Cianofitas como agente biológico, para la detección de la calidad de agua en el Embalse de Salto Grande (Entre Ríos, Argentina). Santa Fe: UNL. (Tesis de Licenciatura).
Bordet, F.; Fontanarrosa, M. S., y O’Farrell, I., 2017. Influence of light and mixing regime on bloom-forming phytoplankton in a subtropical reservoir. En: River Research and Applications, 33(8), pp. 1315-1326. DOI: https://doi.org/10.1002/rra.3189.
Bourrelly, P., 1966. Les Algues d’eau Douce. 1. Les algues vertes. Paris: N. Boubée & Cie, París.
Bourrelly, P., 1968. Les Algues d’eau Douce. 2. Les algues jaunes et brunes. Paris: N. Boubée & Cie, París.
Bourrelly, P.,1970. Les Algues d’eau Douce. 3. Les algues bleues et rouges. Paris: N. Boubée & Cie.
Cabrera, J. L.; Salas, J. A.; Guardado, J. A. y Juárez, J. M., 2008. Calibración de retícula ocular micrométrica. En: CENAM. Simposio de Metrología 2008. Santiago de Querétaro, (22 al 24 de octubre 2007). México: CENAM. Disponible en: https://www.cenam.mx/simposio2008/sm_2008/.
Calado, A. J. y Larsen, J., 1997. On the identity of the type species of the genus Ceratium Schrank (Dinophyceae), with notes on C. hirundinella. En: Phycologia, 36, pp. 500–505.
Canfield, D. E.; Bachmann, R. W.; Hoyer, M. V.; Johansson, L. S.; Søndergaard, M. y Jeppesen, E., 2019. To measure chlorophyll or phytoplankton biovolume: an aquatic conundrum with implications for the management of lakes. En: Lake and Reservoir Management, 35(2), pp. 181–192. DOI: https://doi.org/10.1080/10402381.2019.1607958.
Chalar, G.; De Leon, L.; De Leon, R.; Fabian, D. y Gorga, J., 1993. Evaluación de la eutrofización del embalse de Salto Grande. Análisis de las relaciones entre los parámetros físico-químicos y biológicos. Limnología de los embalses del Río Negro (noviembre 2000-marzo 2009). Informe Final de la primera etapa. Montevideo: Facultad de Ciencias.
Chalar, G.; De Leon, L.; Brugnoli, E.; Clemente, J. y Paradiso M., 2002. Antecedentes y nuevos aportes al conocimiento de la estructura y dinámica del Embalse Salto Grande. En: Fernández-Cirelli, A. C. G., ed. El agua en Sudamérica: de la limnología a la gestión en Sudamérica. Aprovechamiento y gestión de los recursos hídricos. Buenos Aires: Editorial Eudeba. pp. 123–142.
Chalar, G., 2006. Dinámica de la eutrofización a diferentes escalas temporales: embalse Salto Grande (Argentina - Uruguay). En: Galizia Tundisi, José, Matsumura Tundisi, Takako y Sidagis Galli, Corina, eds. Eutrofização na América do Sul: Causas, conseqüências e tecnologias de gerenciamento e controle. [s.l.]: Instituto Internacional de Ecologia, Instituto Internacional de Ecologia e Gerenciamento Ambiental, Academia Brasileira de Ciências, Conselho Nacional de Desenvolvimento Científico e Tecnológico, InterAcademy Panel on International Issues, InterAmerican Network of Academies of Sciences. pp. 87-101.
Chorus, I. y Welker, M., 2021. Toxic cyanobacteria in water. A guide to their public health consequences, monitoring and management. 2a ed. Boca Raton: CRC Press. DOI: https://doi.org/10.1201/9781003081449.
De León, L. y Chalar, G., 2003. Abundancia y diversidad del fitoplancton en el Embalse de Salto Grande (Argentina-Uruguay). Ciclo estacional y distribución espacial. En: Limnetica, 22(12), pp. 103-113.
Edler, L. y Elbrächter, M., 2010. The Utermöhl method for quantitative phytoplankton analysis. En: Karlson, B.; Cusack, C. y Bresnan, E., eds. Microscopic and molecular methods for quantitative phytoplankton analysis. Paris: UNESCO. (IOC Manuals and Guides, 55). pp. 13–20.
European Commission, 2000. Directive 2000/60/EC of the European Parliament and of the Council of 23 October 2000 establishing a framework for Community action in the field of water policy. En: Official Journal of the European Communities, 327(43), pp. 1-72.
Hoehn, E.; Katelaars, H. A. M. y Ewig, B., 1998. Erfassung und Bewertung von Planktonorganismen. Arbeitsgemeinschaft Trinkwassertalsperren. Technische Informationen 7. München: Oldenburg Verlag.
Hillebrand, H.; Dürselen, C.D.; Kirschtel, D.; Pollingher, U. y Zohary, T., 2015. Biovolume calculation for pelagic and benthic microalgae. En: J. Phycol., 1999, 35, pp. 403–424.
International Organization for Standarization, 2023. ISO 5725-3: Accuracy (trueness and precision) of measurement methods and results – Part 3: Intermediate precision and alternative desings for collaborative stuides. Ginebra: ISO.
International Organization for Standarization, 2017a. ISO 17025: General requirements for the competence of Calibration and Testing Laboratories. Ginebra: ISO.
International Organization for Standarization, 2017b. ISO 21748: Guide to the use of repeatability, reproducibility and trueness estimates in measurement uncertainty estimation. Ginebra: ISO.
International Organization for Standarization, 2006. ISO 3534-2: Vocabulary and Symbols Part 2: Applied Statistics. Ginebra: ISO.
International Organization for Standarization, 1994. ISO 5725-6: Accuracy (trueness and precision) of measurement methods and results – Part 6: Use in practice of accuracy values. Ginebra: ISO.
Izaguirre, I.; Procura, H.; Bordet, F. y Bazzalo, M., 2018. Variaciones espaciales y temporales de la comunidad fitoplanctonica y análisis particular de cianobacterias potencialmente tóxicas en el río Uruguay [En línea]. Paysandú: CARU. [Consulta: 13 de setiembre de 2024]. Disponible en: https://www.researchgate.net/publication/331974817
Komárek, J. y Anagnostidis, K., 1999. Cyanoprokaryota 1: Chroococcales. En: Ettl, H.; Gartner H. G.; HeynGig, D. y Mollenhauer, H., eds. Süsswasserflora von mitteleuropa. Berlín: Spektrum Akademischer Verlag.
Komárek, J. y Anagnostidis, K., 2005. Cyanoprokaryota-2. Teil/2nd Part: oscillatoriales. En: Büdel, B.; Krienitz, L.; Gärtner, G. y Schagerl, M., eds. Süsswasserflora von Mitteleuropa 19/2. Heidelberg: Elsevier/Spektrum.
Komárek, J., 2013. Cyanoprokaryota. 3. Heterocytous genera. En: Büdel, B.; Gärtner, G.; Krienitz, L. y Schagerl M., eds. Süswasserflora von Mitteleuropa/Freshwater flora of Central Europe. Heidelberg: Springer Spektrum Berlin.
Lund, J. W. G.; Kipling, C. y Le Cren, E. D., 1958. The inverted microscope method of estimating algal numbers and the statistical basis of estimations by counting. En: Hydrobiologia, 11, pp. 143-170. DOI: https://doi.org/10.1007/BF00007865
Magnusson, B.; Näykki, T.; Hovind, H.; Krysell, M. y Sahlin, E., 2017. Hanbook for calculation of measurement uncertainty in envitomental laboratories [En línea]. 4a ed. (Nordtest Report TR 537). [Consulta: 13 de setiembre de 2024]. Disponible en: https://www.nordtest.info/wp/2017/11/29/handbook-for-calculation-of-measurement-uncertainty-in-environmental-laboratories-nt-tr-537-edition-4/
Napiórkowska-Krzebietke, A. y Kobos, J., 2016. Assessment of the cell biovolume of phytoplankton widespread in coastal and inland water bodies. En: Water Research, 104, pp. 532-546. DOI: https://doi.org/10.1016/j.watres.2016.08.016
O’Farrell, I.; Bordet F. y Chaparro, G., 2012. Bloom forming cyanobacterial complexes co-occurring in a subtropical large reservoir: validation of dominant eco-strategies. En: Hydrobiologia, 698, pp.175-190. DOI: https://doi.org/10.1007/s10750-012-1102-4.
Olenina, I.; Hajdu, S.; Edler, L.; Andersson, A.; Wasmund, N.; Busch, S.; Göbel, J.; Gromisz, S.; Huseby, S.; Huttunen, M.; Jaanus, A.; Kokkonen, P.; Ledaine, I. y Niemkiewicz, E., 2006. Biovolumes and size-classes of phytoplankton in the Baltic Sea. Helsinki: Helsinki Commission. Baltic Marine Environment Protection Commission. (Baltic Sea Environment Proceedings, No.106).
Parra, O. y Bicudo, C.,1995. Introducción a la biología y sistemática de las algas de aguas continentales. Concepción: Universidad de Concepción
Popovský, J. y Pfiester, L. A., 1990. Dinophyceae (Dinoflagellida). En: Ettl, H.; Gerloff J. y Heynig, H., ed. Süβwasser flora von Mitteleuropa. Heidelberg: Pektrum Akademischer.
Quirós, R. y Luchini, L., 1982. Características limnológicas del embalse de Salto Grande, III: fitoplancton y su relación con parámetros ambientales. I.N.I.D.E.P. En: Rev. Asoc. Cienc. Nat. Litoral, 13, pp. 49-66.
Red de Laboratorios Ambientales de Uruguay; Organismo Uruguayo de Acreditación; Uruguay. Ministerio de Vivienda Ordenamiento Territorial y Medio Ambiente. Dirección Nacional de Medio Ambiente, 2009. Laboratorios ambientales. Directrices para la acreditación [En línea]. Montevideo: RLAU, OUA y DINAMA. [Consulta: poner fecha]. Disponible en: https://www.gub.uy/ministerio-ambiente/sites/ministerio-ambiente/files/2023-10/Directrices_para_la_Acreditacion.pdf
Ren, L.; Belton, T.J.; Schuster, R. y Enache, M., 2017. Phytoplankton index of biotic integrity and reference communities for Barnegat Bay–Little Egg Harbor, New Jersey: a pilot study. En: Journal of Coastal Research, 78, pp. 89-105.
Reyes Motavita, M. C.; Díaz Barrios, M. C. y Hernández Castillo, B. E., 2023. Biodiversidad acuática del sitio demostrativo de ecohidrología PHI-UNESCO DRMI-Sitio Ramsar complejo cenagoso de Zapatosa. Volumen 2 Microalgas y cianobacterias. Fichas de morfoespecies [En línea]. Bogotá: BID. [Consulta: 12 de agosto de 2024]. Disponible en: https://natura.org.co/wp-content/uploads/2023/06/Catalogo-02-Microalgas-y-cianobacterias.pdf
Reynolds, C. S.; Huszar, V.; Kruk, C.; Naselli-Flores, L. y Melo, S., 2002. Toward a functional classification of the freshwater phytoplankton. En: Journal of Plankton Research, 24, pp. 417–428.
Saccà, A., 2017. Methods for the estimation of the biovolume of microorganisms: A critical review. En: Limnology and Oceanography: Methods, 15, pp. 337–348. DOI: http://doi.org/10.1002/lom3.10162.
Salas, H. J. y Martino, P., 1990. Metodologías simplificadas para la evaluación de la eutroficación en lagos cálidos tropicales [En línea]. Washington: OPS, OMS. [Consulta: 15 de noviembre de 2024]. Disponible en: https://iris.paho.org/handle/10665.2/55330
World Health Organization, 2020. Cyanobacterial toxins: Anatoxin-a and analogues; Cylindro-spermopsins; Microcystins; Saxitoxins. Background documents for the development of WHO Guidelines for Drinking-water Quality and Guidelines for Safe Recreational Water Environments [En línea]. Geneva: WHO. [Consulta: 15 de noviembre de 2024]. Disponible en: https://www.who.int/teams/environment-climate-change-and-health/water-sanitation-and-health/water-safety-and-quality/publications


