En la costa norte del estuario Río de la Plata se han registrado densas floraciones de cianobacterias potencialmente tóxicas que afectan la calidad del agua para su uso recreativo o potabilización. En este estudio presentamos resultados de 7 años de monitoreo en una zona costera (Punta del Tigre, San José, Uruguay), en los que se determinó temperatura, conductividad, biomasa y composición de cianobacterias. El principal objetivo fue caracterizar las condiciones de temperatura y salinidad que se asocian a la dominancia de las cianobacterias en el fitoplancton de la zona estudiada. Se cuantificó la concentración de microcistinas totales en algunas muestras seleccionadas. Las floraciones se analizaron también en imágenes satelitales a partir de la detección de umbrales de clorofila a. Las especies más frecuentes fueron potencialmente tóxicas: Microcystis aeruginosa, M. protocystis, M. novacekii, Dolichospermum circinale y D. uruguayense, abarcando frecuentemente grandes áreas en concordancia con el análisis satelital. Las concentraciones de microcistinas totales en general superaron las alertas de peligrosidad de la Organización Mundial de la Salud para agua a potabilizar. Temperaturas del agua superiores a 19 ℃, conductividades inferiores a 2 mS/cm y salinidad menor a 0,5 se asociaron con una mayor dominancia de cianobacterias en la biomasa total de fitoplancton. La alta frecuencia de ocurrencia de estos organismos en condiciones de baja conductividad, usuales en la zona, puede comprometer la calidad del agua para diversos usos, incluyendo el consumo humano.
Palabras clave: microcistina, potabilización, calidad de agua, estuario, floraciones.
Na margem norte do Río de la Plata foram registradas densas florações de cianobactérias potencialmente tóxicas, que afetan a qualidade da água para uso recreativo ou para abastecimento de água potável. Neste estudo apresentamos os resultados de 7 anos de monitoramento em uma região costeira (Punta del Tigre, San José, Uruguai), determinando a temperatura, a condutividade, a biomassa e a composição de cianobactérias. O objetivo principal foi caracterizar as condições de temperatura e salinidade que estão associadas à dominância de cianobactérias no fitoplâncton da área estudada. A concentração total de microcistina foi quantificada em amostras selecionadas. Os blooms foram também analisados por imagens de satélite com base na detecção de valores limite de clorofila a. As espécies mais frequentes, e que são potencialmente tóxicas, foram Microcystis aeruginosa, M. protocystis, M. novacekii, Dolichospermum circinale e D. uruguayense, cobrindo frequentemente grandes áreas, de acordo com a análise por imagens de satélite. As concentrações de microcistinas totais excederam geralmente os alertas de perigo da Organização Mundial de Saúde para a água potável. Temperaturas da água superiores a 19 ℃, condutividades inferiores a 2 mS/cm e salinidade inferior a 0,5 foram associadas a um maior predomínio de cianobactérias na biomassa total de fitoplâncton. A elevada frequência de ocorrência destes organismos em condições de baixa condutividade, comuns na região, pode comprometer a qualidade da água para diversos usos, incluindo o consumo humano.
Palavras-chave: microcistina, purificação, qualidade da água, estuário, florações.
Introducción
La eutrofización afecta los cuerpos de agua de las principales cuencas de Uruguay desde hace dos décadas, con tendencia a intensificarse (Alcántara et al., 2022; Arocena et al., 2018; Conde et al., 2002). Este fenómeno responde a la contaminación del agua, principalmente por fósforo y nitrógeno, como consecuencia de diversas actividades antrópicas dentro de las que se destaca la agricultura (Aubriot et al., 2017; Goyenola et al., 2021). Una de las principales consecuencias de la eutrofización es la aparición de floraciones de cianobacterias potencialmente tóxicas en ríos, lagos y embalses (Bonilla et al., 2015, 2021; Bonilla y Pick 2017). El aumento de la frecuencia de fenómenos meteorológicos extremos de lluvias y sequías, como consecuencia del cambio climático, tiene un impacto en los ecosistemas eutróficos, favoreciendo un aumento en la frecuencia de las floraciones y cambios en su composición hacia la dominancia de especies filamentosas fijadoras de nitrógeno (Ferrari et al., 2011; Moss et al., 2011; Haakonsson et al., 2017; Burford et al., 2020).
Las cianobacterias pueden producir diversas toxinas, siendo las microcistinas las más comúnmente reportadas en ambientes límnicos de América del Sur y el mundo (Svirčev et al., 2019; Aguilera et al., 2023). Las microcistinas son heptapéptidos cíclicos con efectos hepatotóxicos en casos de exposiciones agudas, como alteraciones de los tejidos hepáticos, necrosis celular y hemorragia intrahepática (van Apeldoorn et al., 2007). La exposición crónica a esta toxina, por otro lado, puede promover tumores (Chorus y Welker, 2021) o afectar otros órganos como los riñones en diversos animales (Fischer y Dietrich, 2000; Yi et al., 2019). Las microcistinas tienen la capacidad de permanecer largo tiempo libre en el agua (Brena y Bonilla, 2009), por lo que su peligrosidad puede prolongarse aun cuando hayan desaparecido las floraciones.
Se han reportado densas floraciones de cianobacterias en las costas uruguayas del Río de la Plata (costa norte), desde Colonia hasta Montevideo (De León y Yunes 2001; O’Farrell et al., 2019; Ferrari, 2020; Bonilla et al., 2021), que se originan a cientos de kilómetros de distancia en los embalses de los ríos Uruguay y Río Negro (Kruk et al., 2019; Aubriot et al., 2020). Dichas floraciones responden a la eutrofización en sinergia con condiciones de la estratificación térmica y bajo caudal, que favorecen la acumulación de altas biomasas de cianobacterias acumulativas (Chalar et al., 2002; Bordet et al., 2017; González-Piana et al., 2017). Las floraciones en el Río de la Plata se asocian fuertemente a las descargas de dichos ríos que aportan agua dulce, siendo la baja salinidad un indicador indirecto de condiciones favorables para el crecimiento de estos organismos en las zonas costeras (Aubriot et al., 2020, Haakonsson et al., 2020; 2024).
Las floraciones más frecuentes son de tipo acumulativas en la superficie del agua dominadas por grandes colonias del complejo Microcystis aeruginosa (Haakonsson et al., 2017; Kruk et al., 2019), potencialmente productoras de microcistinas. La mayor información disponible sobre las microcistinas en zonas costeras corresponde a los departamentos de Colonia y Montevideo (De León y Yunes, 2001; Pírez et al., 2013; Kruk et al., 2019; Aubriot et al., 2020), incluyendo un caso de intoxicación humana grave en una playa de Montevideo (Vidal et al., 2017). Se han reportado también poblaciones del género Dolichospermum, potencialmente productoras de neurotoxinas, aunque en menor biomasa, acompañando a las floraciones de las especies coloniales (Haakonsson et al., 2017; O’Farrell et al., 2019).
Los desafíos que enfrenta el país con respecto a la conservación de recursos de agua para potabilización y búsqueda de nuevas fuentes, en el contexto de la incertidumbre climática y el deterioro general de los recursos hídricos (Konapala et al., 2020; Goyenola et al., 2021), vuelven necesario aumentar la información sobre cianobacterias en las costas del Río de la Plata.
El objetivo de este trabajo fue caracterizar las condiciones de temperatura y salinidad que se asocian a la dominancia de las cianobacterias en el fitoplancton en la zona costera de Punta del Tigre (Río de la Plata). Complementariamente, se analizaron microcistinas totales en algunas muestras, asociadas a altos (acumulaciones o espuma) y bajos biovolúmenes de cianobacterias, para abarcar un rango amplio de variación de biomasa de estos organismos y evaluar la presencia de toxinas. Se presentan resultados de biomasa y composición de las cianobacterias, microcistinas, temperatura y conductividad derivados de un monitoreo de 7 años en la zona de Punta del Tigre, San José, Río de la Plata. Asimismo, se obtuvieron mapas de clorofila a superficial a partir de imágenes satelitales que complementan la cobertura espacial del monitoreo.
Materiales y Métodos
Se trabajó en la zona costera de Punta del Tigre, en el estuario del Río de la Plata, Uruguay (35º45’56.0’’S, 56º33’27.7’’W), área próxima a la desembocadura del Río Santa Lucía. Las muestras se colectaron en tres sitios, dos ubicados a 700 m de la costa (1 y 2) y otro en la playa (sitio 3) (Figura 1). Se realizaron muestreos bimestrales (en primavera y verano) y trimestrales (en otoño e invierno), desde noviembre de 2014 a junio de 2021 (n = 144). El área de estudio es poco profunda (<4 m), oligohalina y meso-eutrófica (Brugnoli et al., 2021).
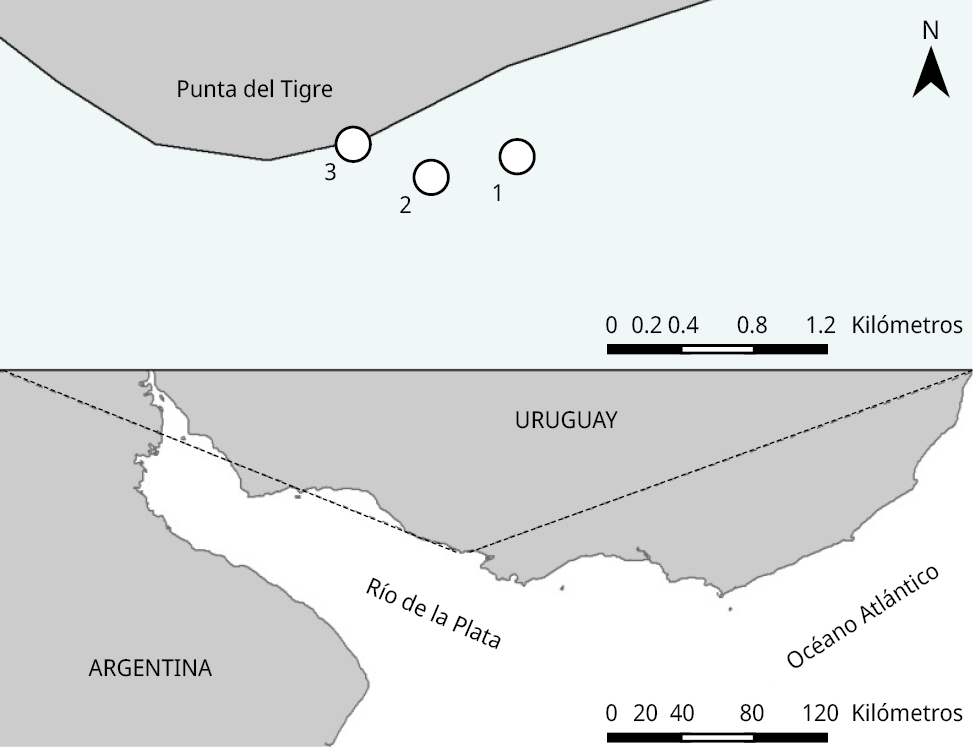
Figura 1. Mapa de la zona de estudio (Punta del Tigre) en el Río de la Plata (panel inferior), y detalle donde se indican los tres sitios de muestreo (círculos blancos) (panel superior).
En cada sitio se estimaron medidas in situ de temperatura (T), salinidad y conductividad (K). Se tomaron muestras subsuperficiales de agua para el análisis cuantitativo del fitoplancton, de las cuales una parte se fijó con solución de Lugol para su cuantificación en microscopio, y la otra se conservó fresca y en oscuridad para filtrarse en el laboratorio por filtros de fibra de vidrio tipo GFF para el análisis posterior de la clorofila a. Los filtros se congelaron a -20 ℃, luego se realizó la extracción de los pigmentos lipídicos con etanol caliente al 90 % y se midió la absorbancia por espectrofotometría para calcular la concentración de la clorofila a (International Organization for Standarization, 1992).
La cuantificación del fitoplancton se realizó con el método de Utermöhl (Sournia 1978), sedimentando las muestras en cámaras de sedimentación, para enumerar a los organismos en microscopio invertido en campos al azar y calcular la abundancia (Sournia, 1978). El tamaño de los organismos, o volumen (µm3), se determinó asumiendo formas geométricas simples, para calcular el biovolumen (abundancia x volumen = mm3/L) como se describe en Bonilla y O’Farrell (2023). También se realizaron arrastres oblicuos con red de plancton de 20 µm de tamaño de poro de modo de obtener muestras cualitativas que se analizaron frescas para la determinación taxonómica, en microscopio Olympus BX 51.
En siete ocasiones, asociadas a la presencia de cianobacterias, se tomaron muestras adicionales para el análisis de toxinas, las que se congelaron de inmediato y enviaron a laboratorio externo para la determinación de microcistinas totales (método ELISA, límite de detección 0,2 µg/L). Se analizaron las relaciones de la temperatura, la salinidad y la conductividad con la proporción de cianobacterias en el total del biovolumen fitoplanctónico, aplicando regresiones locales (Loess por su sigla en inglés), modelos no paramétricos que permiten explorar respuestas potencialmente no lineales (Cleveland & Devlin, 1988). Todos los análisis y gráficos se realizaron con el programa R 4.3.1 (R Core Team 2021) y los paquetes ggplot2 y caret, entre otros.
Para la estimación satelital de umbrales de clorofila a (proxy de biomasa fitoplanctónica) se utilizaron imágenes del sensor MSI (instrumento multiespectral, por su sigla en inglés) a bordo de los satélites Sentinel-2 A y B. Se obtuvieron imágenes de nivel 1C, como se detalla en Maciel et al. (2023a), que fueron corregidas atmosféricamente con el procesador ACOLITE versión 20190326.0 (Vanhellemont, 2019), utilizando el método DSF (ajuste de espectro oscuro, por su sigla en inglés) con la corrección del reflejo solar, para obtener la reflectancia del agua.
Se aplicaron dos índices de clorofila a calibrados para la región de estudio: uno de tres bandas que combina el rojo, borde rojo e infrarrojo cercano (Gitelson et al., 2008) y otro índice del tipo forma espectral que utiliza el pico o valle relativo en la banda roja respecto a las bandas verde y borde rojo. Ambos fueron calibrados para la región de estudio (índice 3BI: R2 = 0.96, RMSE, µg/L = 6.4 e índice SS (665): R2 = 0.96, RMSE, µg/L = 7.2; Maciel et. 2023a) y se obtuvieron mapas de excedencia de distintos umbrales de clorofila a según Maciel et al. (2023b). Esta metodología permite disminuir la detección de falsos positivos causados por interferencia óptica de otros componentes del agua, como sedimentos en suspensión o material disuelto coloreado (Maciel et al., 2023a). Además, el análisis de las muestras tomadas in situ mediante conteo y estimación del biovolumen de los taxa presentes permitió verificar que las concentraciones de clorofila a cercanas a la superficie iguales o mayores a 50 µg/L estaban asociadas a la dominancia de cianobacterias en la zona de estudio, representando más del 90 % del biovolumen fitoplanctónico total (Haakonsson et al., 2024).
Resultados y Discusión
El biovolumen de fitoplancton total varió ampliamente a lo largo del estudio, desde valores muy bajos a muy altos asociados a la presencia de floraciones de cianobacterias (mínimo = 0,02 mm3/L, promedio = 1,25 mm3/L, máximo = 38,5 mm3/L). Las cianobacterias se registraron en el 58,4 % de las muestras analizadas a lo largo de todo el período de estudio, y fueron dominantes en la comunidad de fitoplancton (>50 % del biovolumen total) en los períodos más cálidos (cianobacterias dominantes en el 92 y 67 % de los casos, para verano y otoño, respectivamente).
Las especies de cianobacterias más frecuentes a lo largo de los 7 años fueron las coloniales (orden Chroococcales) Microcystis aeruginosa y M. protocystis, M. novacekii y M. wesenbergii, y las filamentosas (orden Nostocales) Dolichospermum circinale y D. uruguayense (Figura 2, Tabla 1), que pertenecen a los géneros de cianobacterias más frecuentes en formar floraciones en distintos cuerpos de agua eutróficos del país, particularmente en el período estival (Haakonsson et al., 2017).
Se ha demostrado que la presencia de floraciones de cianobacterias en el Río de la Plata puede responder a un efecto del arrastre de biomasa a través de los grandes tributarios que descargan en el estuario (río Negro y río Uruguay) (Chalar, 2009; O’Farrell et al., 2012; Ferrari, 2020; Bonilla et al., 2021). La biomasa de las cianobacterias en el Río de la Plata puede aumentar y acumularse en la costa, por lo que el fenómeno es altamente dependiente de las precipitaciones en la cuenca y la descarga de los grandes ríos (Kruk et al., 2019; Aubriot et al., 2020; Zabaleta et al., 2023).
Las especies M. aeruginosa y M. protocystis son productoras de microcistinas y D. circinale de neurotoxinas (van Apeldoorn et al., 2007). La especie Dolichospermum uruguayense fue descrita recientemente (Kozlíková-Zapomêlová et al., 2016) y aún no hay estudios sobre su toxicidad, aunque es presumible que produzca neurotoxinas (saxitoxinas y análogos o anatoxinas) como otras especies del género (Li et al., 2016). Esto implica que podrían existir concentraciones variables de neurotoxinas en el agua de la zona de estudio asociadas a la presencia de estos taxa. En las siete muestras analizadas para microcistinas se pudo constatar su presencia en todos los casos, variando ampliamente su concentración según la biomasa de cianobacterias y la concentración de clorofila a fitoplanctónica registrada (Tabla 1). Todas las muestras analizadas estuvieron dominadas principalmente por especies del género Microcystis (Tabla 1).
Tabla 1. Microcistinas totales (MC) determinadas en muestras de la costa de Punta del Tigre, San José. Se indica la fecha, tipo de muestra obtenida, concentración de la clorofila a fitoplanctónica (Clo a), biovolumen total de cianobacterias (BV ciano), cociente de microcistinas totales por biovolumen (MC/BV), las especies dominantes en la muestra y las condiciones de temperatura (Temp) y conductividad (K) del agua.
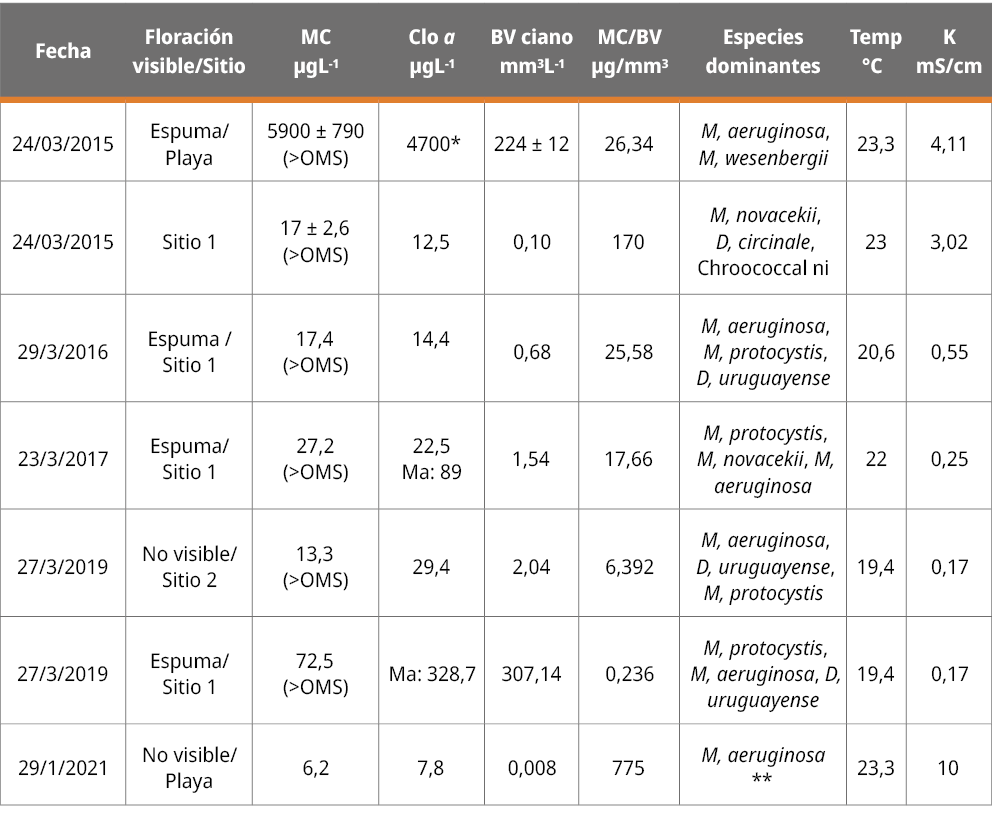
*: dato estimado a partir del biovolumen y clorofila a de otras muestras para ese sitio y fecha. (>OMS): casos en los que la concentración de microcistinas superó algún nivel de alerta de la OMS (Niveles para microcistinas, basado en la variedad LR: 12 µgL-1, Alerta 1: aguas para potabilización y 24 µgL-1, Alerta 2 para aguas para potabilización y recreacionales, (Chorus y Welker, 2021). Ma: mancha (espuma); (**): Alta abundancia de diatomeas: Chaetoceros sp., Coscinodiscus sp.).
La Organización Mundial de la Salud (OMS) establece guías de referencia que indican peligrosidad de exposición a las microcistinas (basadas en la variedad LR), con valores umbrales para aguas recreacionales o para potabilizar (Tabla 1) (Chorus y Welker, 2021). Las muestras de orilla analizadas en este trabajo correspondieron a una alta acumulación de biomasa (“espuma cianobacteriana”), otorgando una evidente coloración al agua (Figura 2, Tabla 1). Se registraron en 3 de 4 casos valores muy elevados de microcistinas, indicando riesgo alto para potabilización y para uso recreacional, superando ampliamente los niveles guía de la OMS (Alerta 2, para aguas a potabilizar y recreacionales: 24 µg/L microcistina-LR; Chorus y Welker, 2021). En las otras fechas donde se analizaron muestras tomadas entre 500 y 1000 m de la costa, se registraron casos que indicaron riesgo moderado para consumo humano, superando el primer nivel de alerta para aguas a potabilizar (OMS, Alerta 1: 12 µg/L microcistina-LR; Chorus y Welker, 2021) (Tabla 1).
Estos resultados indican riesgo potencial de exposición a toxinas para el uso del agua con diferentes fines. El primer registro de Microcystis aeruginosa en el Río de la Plata data de 1981 y el primer reporte de una floración tóxica dominada por esta especie es de febrero de 1999 en costas del departamento de Colonia (concentraciones de microcistinas totales: 102 a 1074 µg/g peso seco) (De León y Yunes 2001). En las playas de Montevideo (Río de la Plata) las floraciones de cianobacterias dominadas por Microcystis spp. se acumulan en la costa por la acción del viento, formando densas espumas cianobacterianas que pueden contenter microcistinas en el orden de miligramos por litro (Gianuzzi et al., 2011; Pírez et al., 2013; Kruk et al., 2019). Esto genera recomendaciones para evitar el contacto con el agua por parte de los bañistas en el marco del programa de monitoreo de la Intendencia de Montevideo (Chorus y Welker, 2021).

Figura 2. A: Playa de Punta del Tigre (24/03/2015) con espuma de cianobacterias cubriendo varios kilómetros. Microfotografias de las especies más frecuentemente encontradas a lo largo del período de estudio, B: colonias de Microcystis aeruginosa (x100 aumentos), C: detalle de colonia de M. protocystis (x200), D: dos filamentos espiralados compactamente de Dolichospermum uruguayense (x100) y E: filamento laxamente espiralado de D. circinale (x400), se observa heterocito (ángulo superior izquierdo). Fotos: Signe Haakonsson y María del Carmen Pérez.
Los mapas obtenidos a partir de las imágenes satelitales (Figura 3) muestran la extensión espacial que pueden alcanzar las floraciones con concentraciones superiores a 50 µg/L de clorofila a, indicando una alta probabilidad de dominancia de cianobacterias (Haakonsson et al., 2024), aunque a valores inferiores también es posible registrar cianobacterias dominando la comunidad fitoplanctónica (Haakonsson et al., 2020; 2024). Entre una y dos semanas antes de los muestreos de marzo de 2016 y enero de 2021 (Tabla 1), ya se observaban zonas con concentraciones de clorofila a mayores a 10 µg/L cercanas a la superficie (Figura 3).
Se destaca la complementariedad de los datos satelitales de febrero de 2019 con los obtenidos de muestreos in situ en marzo, ya que los primeros permitieron detectar altas concentraciones de clorofila a en fechas anteriores a las visitas de campo (Figura 3). Las floraciones de cianobacterias de verano de 2019, identificadas a través de las imágenes satelitales y de los muestreos in situ (Figura 3, Tabla 1) corresponden a uno de los eventos de floraciones masivas más importantes históricamente registrados en las costas del Río de la Plata, ya sea en cuanto a su extensión como a su intensidad (Kruk et al., 2019, Aubriot et al., 2020).
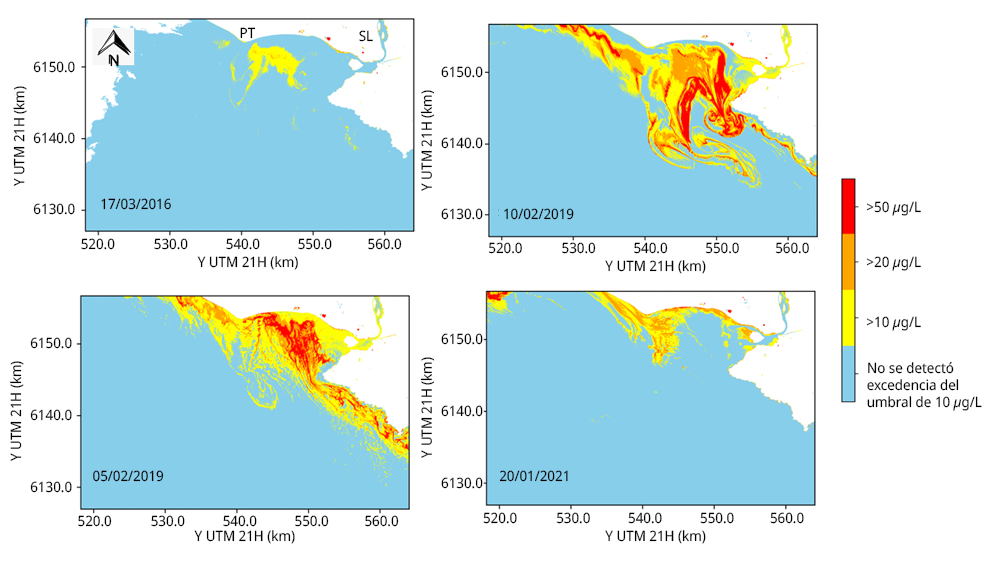
Figura 3. Mapas de la zona de estudio mostrando áreas con la distribución de la concentración de clorofila a superficial según cuatro umbrales (barra de colores a la derecha) en distintas fechas, estimada a partir de imágenes satelitales Sentinel 2-MSI y algoritmos calibrados para la región. En cuadro superior izquierdo, PT: Punta del Tigre y SL: río Santa Lucía.
Los análisis de temperatura, conductividad y salinidad en relación con la proporción del biovolumen de cianobacterias en el fitoplancton total permitieron identificar que las condiciones más favorables para la dominancia de las cianobacterias aparecen por encima de 19 ℃ y por debajo de valores de conductividad de 2 mS/cm y 0,5 de salinidad (Figura 4). Las cianobacterias fueron dominantes en la comunidad de fitoplancton (>50 % del biovolumen total) en el 30 % de los casos, donde la temperatura del agua fue mayor a 19 ℃, mientras que nunca dominaron a temperaturas menores. En condiciones de conductividad y salinidad bajas, la dominancia de cianobacterias ocurrió en el 29 % y 35 % de los casos (para conductividad <2 mS/cm y salinidad <0,5, respectivamente), mientras que no se registraron casos de dominancia de cianobacterias a salinidades superiores a 0,5.
El modelo bayesiano desarrollado por Haakonsson et al. (2020) para la zona de estudio predice que la probabilidad más alta de encontrar biovolúmenes de cianobacterias mayores a 2 mm3/L ocurre a 22,2 ℃ y ~ 0,1 mS/cm. Estas condiciones de alta temperatura y bajas conductividad y salinidad, favorables a la dominancia de las cianobacterias, ocurren también hacia el oeste de Punta del Tigre en el periodo estival, donde se planea la construcción de una toma de agua y planta potabilizadora para complementar el abastecimiento de agua potable de la ciudad de Montevideo (Dias Tadeu et al., 2023).
La zona de estudio es altamente variable en términos de salinidad, respondiendo a los patrones de precipitación y la influencia marina, aspectos que afectan a las comunidades biológicas de la zona en general (Muñoz et al., 2024), sumado a los eventos El Niño/La Niña (Castro y Arocena, 2020; Muñoz et al., 2024). Estas condiciones pueden implicar sinergia entre temperaturas y precipitaciones elevadas que generan escenarios propicios para la ocurrencia de floraciones de cianobacterias en la zona. A pesar de que el Río de la Plata es un ecosistema muy amplio y dinámico, la temperatura y la conductividad pueden ser utilizadas como indicadores robustos de medición simple para ser incorporados en planes de monitoreos de zonas costeras, combinando datos medidos in situ con sensoramiento remoto (Haakonsson et al., 2024). Los vientos y las mareas son variables secundarias, pero pueden explicar la distribución temporal de las floraciones acumulativas de cianobacterias a escala horaria en las zonas costeras del Río de la Plata (Sathicq et al., 2014; Aubriot et al., 2020), lo que debe ser tenido en cuenta en los planes de monitoreo de la calidad del agua.
Las tendencias previstas para el cono sur de América del Sur (Rodell et al., 2018; Torremorell et al., 2021) incluyen la intensificación de la agricultura y el aumento de la variabilidad climática en las próximas décadas. Estos cambios favorecerán el aumento en magnitud y frecuencia de las floraciones de cianobacterias en los grandes ríos y embalses (O’Farrell et al., 2019; Aguilera et al., 2023). Teniendo en cuenta la influencia de las descargas del río Negro y río Uruguay y su transporte de cianobacterias hasta el Río de la Plata (Kruk et al., 2019, Aubriot et al., 2020), es esperable una tendencia similar en las zonas costeras de los departamentos con mayor influencia límnica (departamentos de Colonia, San José y Montevideo).
Siendo un fenómeno complejo y altamente dinámico, el monitoreo de cianobacterias debe ser flexible en cuanto a la frecuencia de obtención de datos y abarcar la estimación de diversos bioindicadores para lograr la detección temprana y planes de contingencia efectivos (Almuhtaram et al. 2021). Esto hace necesario establecer estrategias de monitoreo que integren niveles complementarios de información (por ejemplo: monitoreo visual y sensoramiento remoto), como se ha propuesto recientemente para el Río de la Plata (Haakonsson et al., 2024), lo que podría optimizar la gestión y ahorrar costos.
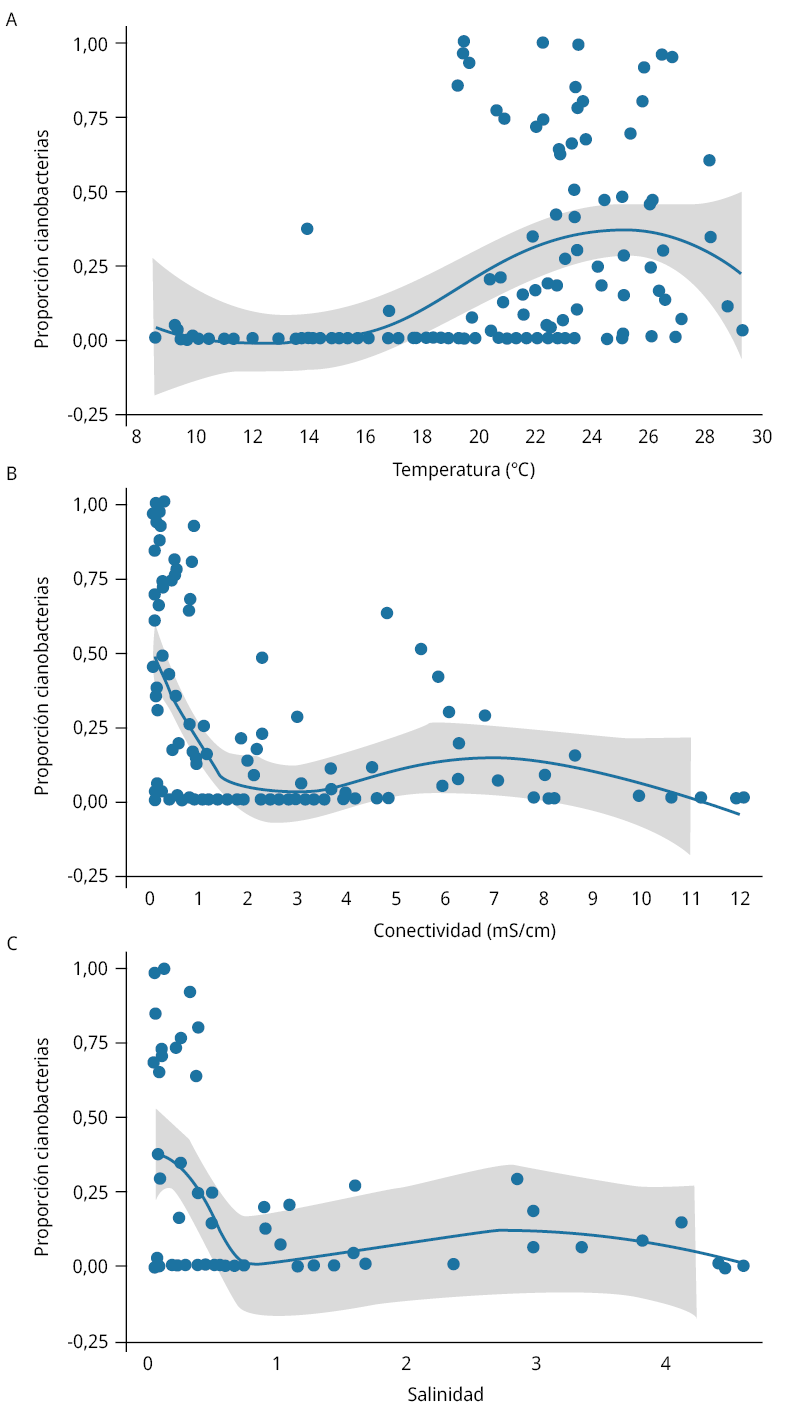
Figura 4. Relación entre la temperatura del agua (A), la conductividad (B) y la salinidad (C) con la dominancia de cianobacterias en el biovolumen fitoplanctónico total ajustado con regresión Loess (línea azul), indicando el intervalo de confianza (área gris).
Conclusiones
En el sitio de estudio (Punta del Tigre, San José) se registraron cianobacterias con identificada toxicidad que representan un riesgo elevado de exposición a cianotoxinas con consecuencias para la salud humana. Las concentraciones de microcistinas totales en agua estuvieron fuertemente relacionadas a la biomasa de cianobacterias. Condiciones estivales de alta temperatura y baja conductividad y salinidad favorecen la aparición de estos organismos en la costa, comprometiendo entonces el uso del agua con fines de potabilización o recreación. Sería necesario realizar estudios de mayor frecuencia contemplando también la detección de neurotoxinas (por ejemplo, anatoxina-a y saxitoxinas) poco estudiadas en el país, reportadas en la literatura en cianobacterias filamentosas del orden Nostocales y que se registran frecuentemente en la zona de estudio. El sensoramiento remoto puede representar un complemento relevante al monitoreo in situ para la gestión de la problemática en las zonas costeras del Río de la Plata.
Agradecimientos
Dedicamos este trabajo a la memoria de nuestra amiga y colega María del Carmen Pérez (1959-2022), referente nacional en taxonomía de fitoplancton y quien líderó ese aspecto en este estudio. Este trabajo fue parcialmente financiado por el Convenio UTE-Facultad de Ingeniería-Facultad de Ciencias, Universidad de la República. A Elena Galvanese por la revisión del portugués. A Manuel Castro, Nathalie Muñoz y Carmela Carballo por la asistencia en los muestreos.
Referencias
Aguilera, A.; Almanza, V.; Haakonsson, S.; Palacio, H.; Benitez Rodas, G. A.; Barros, M.U.G.; Capelo-Neto, J.; Urrutia, R.; Aubriot, L. y Bonilla, S., 2023. Cyanobacterial bloom monitoring and assessment in Latin America. En: Harmful Algae, 125, DOI: https://doi.org/10.1016/j.hal.2023.102429
Alcántara, I.; Somma, A.; Chalar, G.; Fabre, A.; Segura, A.; Achkar, M.; Arocena, R.; Aubriot, L.; Baladán, C.; Barrios, M.; Bonilla, S.; Burwood, M.; Calliari, D.L.; Calvo, C.; Capurro, L.; Carballo, C.; Céspedes-Payret, C.; Conde, D.; Corrales, N.; Cremella, B.; Crisci, C.; Cuevas, J.; De Giacomi, S.; De León, L.; Delbene, L.; Díaz, I.; Fleitas, V.; González-Bergonzoni, I.; González-Madina, L.; González-Piana, M.; Goyenola, G.; Gutiérrez, O.; Haakonsson, S.; Iglesias, C.; Kruk, C.; Lacerot, G.; Langone, J.; Lepillanca, F.; Lucas, C.; Martigani, F.; Martínez de la Escalera, G.; Meerhoff, M.; Nogueira, L.; Olano, H.; Pacheco, J. P.; Panario, D.; Piccini, C.; Quintans, F.; Teixeira de Mello, F.; Terradas, L.; Tesitore, G.; Vidal, L. y García-Rodríguez, F., 2022. A reply to “Relevant factors in the eutrophication of the Uruguay River and the Río Negro.” En: Science of the Total Environment, 818, 151854. DOI: https://doi.org/10.1016/j.scitotenv.2021.151854
Almuhtaram, H.; Kibuye, F. A.; Ajjampur, S.; Glover, C. M.; Hofmann, R.; Gaget, V.; Owen, C.; Wert, E. C. y Zamyadi, A., 2021. State of knowledge on early warning tools for cyanobacteria detection. En: Ecological Indicators, 133, 108442. DOI: https://doi.org/10.1016/j.ecolind.2021.108442
Arocena, R.; Chalar, G. y Pacheco, J. P., 2018. Agriculture and elevation are the main factors for Pampasic stream habitat and water quality. En: Environmental Monitoring and Assessment, 190. DOI: https://doi.org/10.1007/s10661-018-6622-6
Aubriot, L.; Zabaleta, B.; Bordet, F.; Sienra, D.; Risso, J.; Achkar, M. y Somma, A., 2020. Assessing the origin of a massive cyanobacterial bloom in the Río de la Plata (2019): Towards an early warning system. En: Water Research, 181, 115944. DOI: https://doi.org/https://doi.org/10.1016/j.watres.2020.115944
Aubriot, L. E.; Delbene, L.; Haakonsson, S.; Somma, A.; Hirsch, F. y Bonilla, S., 2017. Evolución de la eutrofización en el Río Santa Lucía: influencia de la intensificación productiva y perspectivas. En: INNOTEC, 14, pp. 7–16. DOI: https://doi.org/10.26461/14.04
Bonilla, S.; Haakonsson, S.; Somma, A.; Gravier, A.; Britos, A.; Vidal, L.; De León, L.; Brena, B.; Pírez, M.; Piccini, C.; Martínez de la Escalera, G.; Chalar, G.; González-Piana, M.; Martigani, M. y Aubriot, L., 2015. Cianobacterias y cianotoxinas en ecosistemas límnicos de Uruguay. En: INNOTEC, 10, pp. 9–22. DOI: https://doi.org/10.26461/10.01
Bonilla, S. y Pick, F. R., 2017. Freshwater bloom-forming cyanobacteria and anthropogenic change. En: Limnology and Oceanography e-lectures, 7, pp. 1–62. DOI: https://doi.org/10.1002/loe2.10006
Bonilla, S.; Aubriot, L.; Haakonsson, S.; Illarze, M.; Díaz, I. y Brena, B. M., 2021. Las floraciones de cianobacterias tóxicas comprometen el uso del agua del Río Negro, Uruguay. En: INNOTEC, 22, e577. DOI: https://doi.org/https://doi.org/10.26461/22.08
Bonilla, S. y O’Farrell, I. 2023. La importancia del uso del biovolumen en estudios de fitoplancton y monitoreo ambiental de cianobacterias. En: Ecología Austral, 33, pp. 558-566. DOI: https://doi.org/10.25260/EA.23.33.2.0.2148
Bordet, F.; Fontanarrosa, M. S., y O’Farrell, I., 2017. Influence of light and mixing regime on bloom-forming phytoplankton in a subtropical reservoir. En: River Research and Applications, 33, pp. 1315–1326. DOI: https://doi.org/10.1002/rra.3189
Brena, B. M. y Bonilla, S., 2009. Producción de toxinas y otros metabolitos. En: Bonilla, S., ed. Cianobacterias planctónicas del Uruguay. Manual para la identificación y medidas de monitoreo. Montevideo: UNESCO, PHI-VII. (Documento técnico, 16). pp. 16-18. ISBN: 978-92-9089-138-3.
Brugnoli, E.; Arocena, R.; Cabrera-Lamanna, L. y Muniz, P., 2021. Management and monitoring of eutrophication: Trophic state indexes on the Río de la Plata northern coast. En: Leal Filho, W.; Azul, A. M.; Brandli, L.; Lange Salvia, A. y Wall, T., eds. Life below water. Encyclopedia of the UN Sustainable Development Goals. Cham: Springer. DOI: https://doi.org/10.1007/978-3-319-71064-8_114-1
Burford, M. A.; Carey, C. C.; Hamilton, D. P.; Huisman, J.; Paerl, H. W.; Wood, S. A. y Wulff, A., 2020. Perspective: Advancing the research agenda for improving understanding of cyanobacteria in a future of global change. En: Harmful Algae, 91, 101601. DOI: https://doi.org/10.1016/j.hal.2019.04.004
Castro, M. y Arocena, R., 2020. Exotic bivalves respond differently to sediment supply. En: Panamerican Journal of Aquatic Sciences, 15, pp. 163–172.
Chalar, G.; De León L.; Brugnoli E.; Clemente J. y Paradiso M., 2002. Antecedentes y nuevos aportes al conocimiento de la estructura y dinámica del Embalse Salto Grande. En: Fernandez-Cirelli, A. y Chalar G., eds. El agua en Iberoamérica: de la Limnología a la Gestión en Sudamérica. CYTED, aprovechamiento y gestión de los recursos hídricos. Bs. As.: Editorial Eudeba. pp. 123–142.
Chalar, G., 2009. Embalse Salto Grande: la diversidad del fitoplancton como herramienta para la gestión de las floraciones de Microcystis. En: Bonilla, S., ed. Cianobacterias planctónicas del Uruguay. Manual para la identificación y medidas de monitoreo. Montevideo: UNESCO. PHI-VII. (Documento técnico, 16). pp. 76–78. ISBN: 978-92-9089-138-3.
Chorus, I. y Welker, M., 2021. Toxic cyanobacteria in water. A guide to their public health consequences, monitoring and management. 2a ed. Boca Raton: CRC Press. DOI: https://doi.org/10.1201/9781003081449
Conde, D.; Arocena, R. y Rodríguez, L., 2002. Recursos acuáticos superficiales de uruguay: ambientes, algunas problemáticas y desafíos para la gestión las aguas superficiales continentales. En: Ambios, pp. 5–9.
Cleveland, W. S. y Devlin, S. J., 1988. Locally weighted regression: an approach to regression analysis by local fitting. En: Journal of the American Statistical Association, 83, pp. 596–610. DOI: https://doi.org/10.1080/01621459.1988.10478639
De León, L. y Yunes, J. S., 2001. First report of a microcystin-containing bloom of the cyanobacterium Microcystis aeruginosa in the La Plata river, South America. En: Environmental Toxicology, 16, pp. 1989–1990.
Dias Tadeu, N.; Trimble, M.; Lázaro, M.; Venturini, P. y Venegas, M., 2023. Divergent perspectives about water security: hydrosocial transformations in the metropolitan region of Montevideo (Uruguay). En: Frontiers in Sustainable Cities, 5. DOI: https://doi.org/10.3389/frsc.2023.1207652
Ferrari, G.; Pérez, M. C.; Dabezies, M.; Míguez, D. y Saizar, C., 2011. Planktic Cyanobacteria in the Lower Uruguay River, South America. En: Fottea, 11, pp. 225–234. DOI: http://dx.doi.org/10.5507/fot.2011.021.
Ferrari, G., 2020. Water flow and temperature as main factors that regulate phytoplankton and cyanobacterial blooms in a large subtropical river. En: INNOTEC, 20, pp. 30–66.
Fischer, W. J. y Dietrich, D. R., 2000. Pathological and biochemical characterization of microcystin-induced hepatopancreas and kidney damage in carp (Cyprinus carpio). En: Toxicology and Applied Pharmacology, 164, pp. 73–81. DOI: https://doi.org/10.1006/taap.1999.8861
Giannuzzi, L.; Sedan, D.; Echenique, R. y Andrinolo, D., 2011. An acute case of intoxication with cyanobacteria and cyanotoxins in recreational water in Salto Grande dam, Argentina. En: Marine Drugs, 9, pp. 2164–2175. DOI: https://doi.org/10.3390/md9112164
Gitelson, A. A.; Dall’Olmo, G.; Moses, W.; Rundquist, D. C.; Barrow, T.; Fisher, T. R.; Gurlin, D. y Holz, J., 2008. A simple semi-analytical model for remote estimation of chlorophyll-a in turbid waters: Validation. En: Remote Sensing of Environment, 112, 3582–3593. DOI: https://doi.org/10.1016/j.rse.2008.04.015
González-Piana, M.; Fabián, D.; Piccardo, A. y Chalar, G., 2017. Dynamics of total microcystin LR concentration in three subtropical hydroelectric generation reservoirs in Uruguay, South America. En: Bulletin of Environmental Contamination and Toxicology, 99, pp. 488–492. DOI: https://doi.org/10.1007/s00128-017-2158-7
Goyenola, G.; Kruk, C.; Mazzeo, N.; Nario, A.; Perdomo, C.; Piccini, C. y Meerhoff, M., 2021. Producción, nutrientes, eutrofización y cianobacterias en Uruguay armando el rompecabezas. En: INNOTEC, 22, pp. 1–33. DOI: https://doi.org/10.26461/22.02
Haakonsson, S.; Rodríguez-Gallego, L.; Somma, A. y Bonilla, S., 2017. Temperature and precipitation shape the distribution of harmful cyanobacteria in subtropical lotic and lentic ecosystems. En: Science of the Total Environment, 609, pp. 1132–1139. DOI: https://doi.org/10.1016/j.scitotenv.2017.07.067
Haakonsson, S.; Rodríguez, M. A.; Carballo, C.; Pérez, M. del C.; Arocena, R. y Bonilla, S., 2020. Predicting cyanobacterial biovolume from water temperature and conductivity using a Bayesian compound Poisson-Gamma model. En: Water Research, 176. DOI: https://doi.org/10.1016/j.watres.2020.115710
Haakonsson, S.; Maciel, F.; Rodríguez, M. A.; Ponce de León, L.; Rodríguez-Gallego, L.; Arocena, R.; Pedocchi, F. y Bonilla, S., 2024. Monitoring cyanobacterial blooms: a strategy combining predictive modeling and remote sensing approaches. En: Environmental Earth Sciences, 83. DOI: https://doi.org/10.1007/s12665-024-11488-3
International Organization for Standarization, 1992. ISO 10260: Water quality -- Measurement of biochemical parameters -- Spectrometric determination of the chlorophyll-a concentration. Ginebra: ISO.
Konapala, G.; Mishra, A. K.; Wada, Y. y Mann, M. E., 2020. Climate change will affect global water availability through compounding changes in seasonal precipitation and evaporation. En: Nature Communications, 11, pp. 1–10. DOI: https://doi.org/10.1038/s41467-020-16757-w
Kozlíková-Zapomêlová, E.; Ferrari, G. y Pérez, M. C., 2016. Dolichospermum uruguayense sp. nov.; a planktic nostocacean cyanobacterium from the Lower Uruguay River, South America. En: Fottea, 16, pp. 189–200. DOI: https://doi.org/10.5507/fot.2016.009
Kruk, C.; Martínez, A.; Martínez de la Escalera, G.; Trinchin, R.; Manta, G.; Segura, A. M.; Piccini, C.; Brena, B.; Fabiano, G.; Pirez, M.; Gabito, L.; Alcántara, I. y Yannicelli, B., 2019. Floración excepcional de cianobacterias tóxicas en la costa de Uruguay, verano 2019. En: INNOTEC, 18, pp. 36–68. DOI: https://doi.org/10.26461/18.06
Li, X.; Dreher, T. W. y Li, R., 2016. An overview of diversity, occurrence, genetics and toxin production of bloom-forming Dolichospermum (Anabaena) species. En: Harmful Algae, 54, pp. 54–68. DOI: https://doi.org/10.1016/j.hal.2015.10.015
Maciel, F. P.; Haakonsson, S.; Ponce de León, L.; Bonilla, S. y Pedocchi, F., 2023a. Challenges for chlorophyll-a remote sensing in a highly variable turbidity estuary, an implementation with sentinel-2. En: Geocarto International, 38(1). DOI:https://doi.org/10.1080/10106049.2022.2160017
Maciel, F. P.; Haakonsson, S.; Ponce de León, L.; Bonilla, S. y Pedocchi, F., 2023b. Satellite monitoring of chlorophyll-a threshold levels during an exceptional cyanobacterial bloom (2018-2019) in the Río de la Plata. En: Ribagua, 10, pp. 62–78. DOI: https://doi.org/10.1080/23863781.2023.2264511
Moss, B.; Kosten, S.; Meerhoff, M.; Battarbee, R.W.; Jeppesen, E.; Mazzeo, N.; Havens, K.; Lacerot, G.; Zhengwen, L.; De Meester, L.; Paerl, H. y Scheffer, M., 2011. Allied attack: climate change and eutrophication. En: Inland Waters, 1, pp. 101–105. DOI: https://doi.org/10.5268/iw-1.2.359
Muñoz, N.; Bonilla, S.; Arocena, R.; Maciel, F.; Haakonsson, S.; Pedocchi, F. y Machado, I., 2024. Estuarine front dynamics drive ichthyoplankton assemblage in the tidal freshwater zone of the Río de la Plata, South America. En: Regional Studies in Marine Science, 73. DOI: https://doi.org/10.1016/j.rsma.2024.103521
O’Farrell, I.; Bordet, F. y Chaparro, G., 2012. Bloom forming cyanobacterial complexes co-occurring in a subtropical large reservoir: Validation of dominant eco-strategies. En: Hydrobiologia 698, pp. 175–190. DOI: https://doi.org/10.1007/s10750-012-1102-4
O’Farrell, I.; Motta, C.; Forastier, M.; Polla, W.; Otaño, S.; Meichtry, N.; Devercelli, M. y Lombardo, R., 2019. Ecological meta-analysis of bloom-forming planktonic Cyanobacteria in Argentina. En: Harmful Algae, 83, pp. 1–13. DOI: https://doi.org/10.1016/j.hal.2019.01.004
Pírez, M.; Gonzalez-Sapienza, G.; Sienra, D.; Ferrari, G.; Last, M.; Last, J.A. y Brena, B.M., 2013. Limited analytical capacity for cyanotoxins in developing countries may hide serious environmental health problems: Simple and affordable methods may be the answer. En: Journal of Environmental Management, 114, pp. 63–71. DOI: https://doi.org/https://doi.org/10.1016/j.jenvman.2012.10.052
R Core Team, 2021. R: A language and environment for statistical computing. Vienna: R Foundation for Statistical Computing. [Consulta: 1 de marzo de 2023]. Disponible en: https://www.R-project.org/
Rodell, M.; Famiglietti, J. S.; Wiese, D. N.; Reager, J. T.; Beaudoing, H. K.; Landerer, F. W. y Lo, M. H., 2018. Emerging trends in global freshwater availability. En: Nature, 557, pp. 651–659. DOI: https://doi.org/10.1038/s41586-018-0123-1
Sathicq, M. B.; Gómez, N.; Andrinolo, D.; Sedán, D. y Donadelli, J. L., 2014. Temporal distribution of cyanobacteria in the coast of a shallow temperate estuary (Río de la Plata): some implications for its monitoring. En: Environmental Monitoring and Assessment, 186, pp. 7115–7125. DOI: https://doi.org/10.1007/s10661-014-3914-3
Svirčev, Z.; Lalić, D.; Bojadžija Savić, G.; Tokodi, N.; Drobac Backović, D.; Chen, L.; Meriluoto, J. y Codd, G. A., 2019. Global geographical and historical overview of cyanotoxin distribution and cyanobacterial poisonings. En: Archives of Toxicology, 93, pp. 2429-2481. DOI: https://doi.org/10.1007/s00204-019-02524-4
Sournia, A., 1978. Phytoplankton manual. Paris: UNESCO. (Monographs on Oceanographic Methodology, 6). DOI: https://doi.org/10.1002/iroh.19800650312
Torremorell, A.; Hegoburu, C.; Brandimarte, A. L.; Rodrigues, E. H. C.; Pompêo, M.; da Silva, S. C.; Moschini-Carlos, V.; Caputo, L.; Fierro, P.; Mojica, J. I.; Matta, Á. L. P.; Donato, J. C.; Jiménez-Pardo, P.; Molinero, J.; Ríos-Touma, B.; Goyenola, G.; Iglesias, C.; López-Rodríguez, A.; Meerhoff, M.; Pacheco, J. P.; de Mello, F. T.; Rodríguez-Olarte, D.; Gómez, M. B.; Montoya, J. V.; López-Doval, J.C. y Navarro, E., 2021. Current and future threats for ecological quality management of South American freshwater ecosystems. En: Inland Waters, 11, pp. 125–140. DOI: https://doi.org/10.1080/20442041.2019.1608115
van Apeldoorn, M. E.; Van Egmond, H. P.; Speijers, G. J. A. y Bakker, G. J. I., 2007. Toxins of cyanobacteria. En: Molecular Nutrition & Food Research, 51, pp. 7–60. DOI: https://doi.org/10.1002/mnfr.200600185
Vanhellemont, Q., 2019. Adaptation of the dark spectrum fitting atmospheric correction for aquatic applications of the Landsat and Sentinel-2 archives. En: Remote Sensing of Environment, 225, pp. 175–192. DOI: https://doi.org/10.1016/j.rse.2019.03.010. [Consulta: 2 de abril de 2019]. Disponible en: https://github.com/acolite/acolite
Vidal, F.; Sedan, D.; D’Agostino, D.; Cavalieri, M. L.; Mullen, E.; Parot Varela, M. M.; Flores, C.; Caixach, J. y Andrinolo, D., 2017. Recreational exposure during algal bloom in carrasco beach, uruguay: A liver failure case report. En: Toxins, 9, pp. 1–12. DOI: https://doi.org/10.3390/toxins9090267
Yi, X.; Xu, S.; Huang, F.; Wen, C.; Zheng, S.; Feng, H.; Guo, J.; Chen, J.; Feng, X. y Yang, F., 2019. Effects of chronic exposure to microcystin-LR on kidney in mice. En: International Journal of Environmental Research and Public Health, 16. DOI: https://doi.org/10.3390/ijerph16245030
Zabaleta, B.; Haakonsson, S.; Achkar, M. y Aubriot, L., 2023. High-frequency zones of phytoplankton blooms in the Río de la Plata Estuary associated with El Niño-Southern Oscillation. En: Estuarine, Coastal and Shelf Science, 286, 108342. DOI: https://doi.org/10.1016/j.ecss.2023.108342



