El género Microcystis (Cyanobacteria) es de gran interés dada su capacidad de formar floraciones en embalses y otros cuerpos de agua. Sus células poseen vesículas de gas que le permiten regular su flotabilidad. Numerosos estudios indican que el ultrasonido, aplicado a ciertas frecuencias y potencias, provoca el colapso de las vesículas de gas, aunque este efecto aún no se ha comprendido completamente. El objetivo de este trabajo fue determinar cuantitativamente el efecto que ejerce esta tecnología en las vesículas de gas y en la abundancia total de Microcystis spp. extraídas del Embalse San Roque, en Córdoba, Argentina. Para ello, se expusieron 20 L de muestra a 124 kHz y 20 W de tratamiento ultrasónico (T), y luego se analizó la abundancia celular y el colapso de las vesículas cuantificando su área y determinando su porcentaje relativo de las células sedimentadas por microscopía electrónica de transmisión. No hubo variaciones en la abundancia, y se produjo un 10 % de sedimentación para T, donde el porcentaje de vesículas de las células tuvo una disminución significativa. Los datos numéricos del colapso de vesículas aportan relevancia a este estudio; sin embargo, dado el bajo porcentaje de sedimentación, es importante seguir investigando los efectos del ultrasonido sobre la pérdida de flotabilidad de Microcystis spp. y su radio de acción.
Palabras clave: floraciones algales, cianobacterias, flotabilidad, frecuencia de ultrasonido.
O gênero Microcystis (Cyanobacteria) é de grande interesse devido à sua capacidade de formar florações em reservatórios e outros corpos d’água. Suas células possuem vesículas gasosas que permitem regular sua flutuabilidade. Vários estudos indicam que o ultrassom, aplicado a certas frequências e potências, provoca o colapso das vesículas gasosas, embora esse efeito ainda não tenha sido completamente compreendido. O objetivo deste trabalho foi determinar quantitativamente o efeito que essa tecnologia exerce nas vesículas gasosas e na abundância total de Microcystis spp. extraídas do Reservatório San Roque, Argentina. Para isso, foram expostos 20 L de amostra a 124 kHz e 20 W de tratamento ultrassônico (T), e então foram analisadas a abundância celular e o colapso das vesículas, quantificando sua área e determinando sua porcentagem relativa das células sedimentadas por meio de microscopia eletrônica de transmissão. Não houve variações na abundância, e ocorreu uma sedimentação de 10 % para T, onde a porcentagem de vesículas nas células teve uma diminuição significativa. Os dados numéricos sobre o colapso das vesículas conferem relevância a este estudo; no entanto, dada a baixa porcentagem de sedimentação, é importante continuar investigando os efeitos do ultrassom sobre a perda de flutuabilidade em Microcystis spp. e seu raio de ação.
Palavras-chave: florações de algas, cianobactérias, flutuabilidade, frequência de ultrassom.
Introducción
Las proliferaciones masivas de cianobacterias son comunes en cuerpos de agua superficiales en todo el mundo, y causan efectos adversos en ecosistemas acuáticos y en la salud pública (Sosa Benegas et al., 2020). Estos eventos son promovidos principalmente por la eutrofización cultural y se proyecta que serán aún más intensos, frecuentes y generalizados debido al efecto del cambio climático, ya que el aumento de la temperatura y la estratificación de la columna de agua favorecen el crecimiento de las poblaciones de cianobacterias (Dick et al., 2021). Los embalses de la provincia de Córdoba experimentan desde hace varias décadas un fuerte y continuo proceso de contaminación de origen antrópico que los ha llevado a un estado de eutrofización avanzado (Rodríguez y Ruiz, 2016; Halac et al., 2020; Bonansea et al., 2021; Mengo et al., 2024).
El Embalse San Roque (ESR) fue construido entre 1888 y 1944, principalmente para abastecimiento de agua, generación de energía eléctrica, riego y control de crecidas. En la actualidad es uno de los ambientes acuáticos continentales más problemáticos del país debido a su avanzado grado de eutrofización (O’Farrell et al., 2019; Daga et al., 2021). Presenta frecuentes anoxias hipolimnéticas, eventos de muerte de peces y dominancia de especies de cianobacterias (entre ellas Microcystis aeruginosa) (Rodríguez y Ruiz, 2016; Halac et al., 2019), además de la alteración de propiedades organolépticas del agua y afectación de las actividades recreativas.
No se ha descubierto aún el método más eficiente para el tratamiento contra las floraciones de cianobacterias sin generar grandes gastos económicos ni efectos secundarios ambientales. Ante esto, el ultrasonido se considera como alternativa, pero no está demostrado que sea factible su producción a nivel industrial (Romero et al., 2022). Se han documentado antecedentes sobre sus efectos negativos en la fotosíntesis, daño de la membrana celular, pérdida de flotabilidad por ruptura de las vesículas de gas (Kong et al., 2019; Peng et al., 2020), pero quedan numerosas preguntas por responder.
Las vesículas de gas son estructuras intracelulares que permiten que las colonias regulen su posición vertical en la columna de agua en función de diferentes condiciones ambientales, como la radiación solar disponible y la concentración de nutrientes. Son estructuras rígidas, inertes, huecas, llenas de gas, que regulan la flotabilidad, pero pueden colapsar cuando se encuentran a una presión hidrostática elevada o cuando existe una diferencia de presiones interna y externa (Romero et al., 2022). Según Huang et al. (2020), al exponer las vesículas de gas a bajas frecuencias de ultrasonido (20-200 kHz), el colapso puede estar dado por un fenómeno denominado cavitación acústica, proceso que puede resumirse como la generación, vibración mecánica y el consiguiente colapso de diminutas burbujas (Huang et al., 2020).
Este estudio tuvo el objetivo de poner a prueba el efecto del ultrasonido con un transductor de elaboración propia (Romero et al., 2022) sobre la abundancia celular y vesículas de gas de Microcystis spp., enfatizando en determinar cuantitativamente el colapso de estas estructuras. Para ello, se realizaron ensayos donde se evaluaron la pérdida de flotabilidad y la abundancia celular, y se calculó el porcentaje de las vesículas de gas de células sedimentadas, mediante microscopía electrónica, en muestras extraídas del ESR sometidas a tratamiento ultrasónico en baja frecuencia.
Materiales y Métodos
Muestreo, aclimatación de muestras naturales y diseño experimental
Las muestras de poblaciones naturales de Microcystis spp. fueron extraídas de la costa cercana al “Club de Remo” del ESR (31°24’17.3”S 64°29’26.9”W), durante un evento de floración en marzo de 2023. Inmediatamente luego de la extracción, se comprobó que estas muestras estuvieran conformadas por Microcystis spp. en un porcentaje mayor al 90 % y a posteriori se mantuvieron en el laboratorio en condiciones naturales de luz y temperatura ambiente (24 ± 1 ℃), en recipientes transparentes opacos de 10 L, durante 24 h previas al ensayo.
El ensayo consistió en colocar 20 L de muestra en dos recipientes de vidrio prismáticos de 60 L de capacidad (35 x 35 x 50 cm), cada uno con un transductor en el fondo en posición vertical y en el centro (Figura 1). Estos transductores fueron obtenidos de la empresa Ginpertec, con dimensiones de 59.5 mm de diámetro y 98 mm de altura, y fueron alimentados con un amplificador desarrollado en el laboratorio (Romero et al., 2022) (Figura 2). El control (C) mantuvo el transductor apagado a lo largo del ensayo y el tratamiento (T) correspondió al recipiente con el transductor a una frecuencia de 124 kHz y potencia de 20 W. El tiempo de exposición, el volumen y la frecuencia establecidos fueron determinados en ensayos previos, evaluando el mismo volumen de muestras a diferentes frecuencias, registrando el tiempo aproximado al cual las células sedimentan completa e irreversiblemente. En base a esto, el tiempo de exposición definido fue de 24 h, manteniendo las condiciones naturales de luz (ambiente ampliamente iluminado sin irradiación solar directa) y temperatura constante a 24 ± 1 ℃ mediante control por aire acondicionado y utilizando un sistema de sensado y datalogger de temperatura (sensores DS18B20 fabricados por Dallas Semiconductors y una raspberry-pi). Los parámetros de frecuencia y potencia del transductor fueron registrados a lo largo del experimento en el software Hércules v.3.2.8 (HW Group, 2014).
Para el análisis de Microscopía Electrónica de Transmisión (MET), se extrajeron muestras de 15 ml de cada recipiente en el tiempo inicial previo al encendido del transductor (Ci y Ti), y al final del ensayo (Cf y Tf). Las muestras de Ci, Ti y Cf se extrajeron homogeneizando el contenido del recipiente, mientras que las de Tf se extrajeron, sin homogeneizar, del fondo del recipiente (es decir, de las colonias que hubieran sedimentado). Se realizó de esta manera ya que el objetivo principal fue determinar el porcentaje de vesículas colapsadas por tratamiento ultrasónico, por lo que se enfatizó en extraer muestras de las células que perdieran flotabilidad, exclusivamente. Para la determinación de la abundancia celular se extrajeron 200 ml de homogeneizado tanto para Ci y Ti como para Cf y Tf. Luego de la homogeneización para la extracción de las muestras iniciales, se permitió que las colonias migraran a la superficie para posteriormente dar comienzo al ensayo.

Figura 1. Recipientes C (izquierda) y T (derecha) con las muestras de Microcystis spp. suspendidas en superficie y transductores en soportes orientados hacia ellas.

Figura 2. Dispositivo de ultrasonido utilizado, con su transductor (derecha) y amplificador conectado, con frecuencia y potencia medidas en osciloscopio y registradas en software (izquierda).
Obtención de micrografías electrónicas y procesamiento de imágenes
Las muestras de 15 ml obtenidas al inicio y al final del ensayo fueron llevadas, inmediatamente después de su extracción, al Centro de Microscopía Electrónica de la Universidad Nacional de Córdoba para realizar el tratamiento correspondiente y obtener micrografías de las células de Microcystis spp. Allí, las muestras se lavaron con PBS (tampón fosfato salino) y se fijaron en una mezcla de Karnovsky que contenía formaldehído al 4 % (p/v) y glutaraldehído al 2 % (p/v) en tampón de cacodilato 0,1 M, durante 2 h. Luego, las células fijadas se centrifugaron y el material sedimentado se lavó y trató con OsO4 al 1 % durante 1 h, antes de ser teñido en bloque con acetato de uranilo al 1 % en tampón de acetato 0,1 M pH 5,2 durante 20 min.
Después de la deshidratación con una serie de cetonas frías graduadas, las células se incluyeron en resina Spurr y, a partir de una polimerización de 48 hs a 60 ℃, se cortaron secciones ultrafinas de 0,1 μM usando un ultramicrótomo JEOL con un cuchillo de diamante. Finalmente, las rejillas se tiñeron con acetato de uranilo/citrato de plomo y se examinaron en un MET (Zeiss LEO906, Oberkochen, Alemania) operado a un voltaje de aceleración de 80 kV y fueron fotografiadas con una cámara Megaview G3 (EMSIS GmbH, Münster, Alemania).
A partir de las micrografías obtenidas, se seleccionaron al azar 20 células de cada una, considerando que no estuvieran en proceso de división celular. Para el análisis de las vesículas de gas se utilizó el software ImageJ (ImageJ, 2023). Se seleccionaron y registraron todas las áreas de las vesículas de gas de las células seleccionadas y el área total de cada célula (Figura 3), y luego se calculó el porcentaje relativo del área de las vesículas de gas en cada una de las 20 células por muestra. Además, previo y posterior al ensayo se obtuvieron fotografías en vista superior y de perfil a los recipientes para analizar la flotabilidad. Con las fotografías en vista superior se realizó la determinación del porcentaje de colonias sedimentadas de los recipientes en el tiempo final (Cf y Tf), midiendo el área de las colonias en superficie con ImageJ (ImageJ, 2023). En el software RStudio v6.1.0 (Posit, 2023) se realizaron pruebas de normalidad y de homogeneidad de varianza para verificar el cumplimiento de supuestos estadísticos; posteriormente se realizó un ANOVA con un test post hoc de Tukey, con un intervalo de confianza del 95 %, para corroborar diferencias significativas entre los tratamientos C y T.
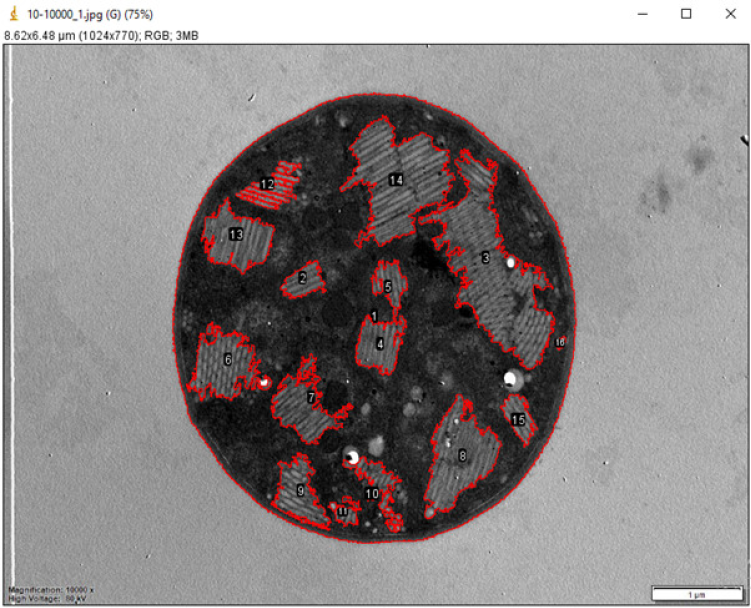
Figura 3. Imagen obtenida por MET de una célula del recipiente C de Microcystis spp., representativa del análisis realizado con ImageJ (ImageJ, 2023) del área relativa de vesículas de gas por célula, delimitadas en rojo.
Determinación de la abundancia celular de Microcystis spp.
Para la determinación de la abundancia celular (cél.ml-1) de las poblaciones de Microcystis spp., de las muestras de 200 ml obtenidas en tiempo inicial (Ci y Ti) y en tiempo final (Cf y Tf), se realizó un conteo celular en una cámara de Fuchs Rosenthal (marca Marienfeld, Alemania) por microscopía óptica (Leica DM750 con cámara ICC50 W, Alemania). Este consistió en contar unidades de recuento ocupadas por colonias de Microcystis spp. (1 unidad de recuento = ¼ de celda de la cámara, correspondiente a un promedio de 584 células) (Ferreyra et al., 2023; Figura 4), registrándolas junto con el número de campos contados, y repitiendo este procedimiento tres veces por cada muestra. Luego, estos datos fueron aplicados en la fórmula (1) para obtener el número de células por mililitro (American Public Health Association et al., 2017).
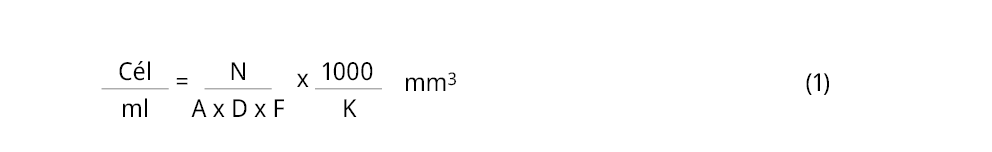
Donde:
N: n° de unidades de recuento.
A: área del campo (mm2).
D: profundidad del campo (mm).
F: n° de campos contados.
K: factor de concentración (Volumen de muestra/Volumen concentrado).
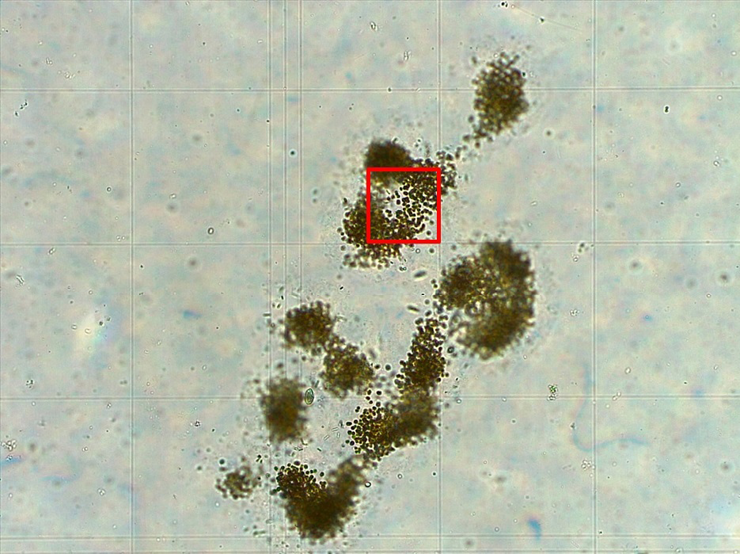
Figura 4. Colonia de Microcystis spp. visualizada en microscopio óptico (10x) en cámara de Fuchs Rosenthal, representando la unidad de recuento (cuadro rojo), según Ferreyra et al. (2023).
Resultados
Los datos registrados del funcionamiento del transductor, con respecto a potencia y frecuencia, evidenciaron que la frecuencia promedio fue de aproximadamente 122 ± 1 kHz en todo el ensayo, y la potencia configurada en 20 ± 1 W se mantuvo estable.
En las siguientes imágenes se observan los recipientes Cf y Tf, donde se distinguen las colonias sedimentadas (Figura 5) y el porcentaje total de las colonias en superficie y de las que perdieron flotabilidad (Figura 6a y 6b).

Figura 5. Fotografía tomada postratamiento del recipiente T, donde se pueden observar en el fondo las células (en colonias) sedimentadas (flecha).

Figura 6. Fotografías de la superficie de las muestras de Microcystis spp. en ambos recipientes tomadas luego del tratamiento, en donde se observa el área sedimentada del recipiente T, por encima del transductor ultrasónico (a: control; b: tratamiento. Contorno amarillo: área total; contorno rojo: área de sedimentación).
Los resultados obtenidos a partir del procesamiento de estas imágenes mostraron que al final del experimento el control (Cf) presentó un porcentaje de sedimentación de células de 0,38 %, mientras que en el tratamiento (Tf) fue de un 10,11 %.
En cuanto al porcentaje de vesículas de gas, en la figura 7 se puede observar una micrografía representativa de cada muestra (Figura 7), donde la flecha indica las vesículas de cada célula. En la comparación de los dos tratamientos se determinó que en Tf estas estructuras representaron una proporción del área total de la célula menor que al inicio (Ti) y que en el control (Ci y Cf). Además, Tf fue la única muestra que presentó las vesículas de gas en forma desagregada. En la Figura 8 se expresan los porcentajes de área representada por vesículas de gas en cada muestra, siendo del 32 ± 6 % para Ci, Cf y Ti, y un porcentaje significativamente menor para Tf (10 ± 4 %) (Figura 8). La disposición desagregada y el porcentaje de las vesículas obtenido en Tf responden concretamente al colapso y la consecuente pérdida de flotabilidad generada por el tratamiento en estas células.
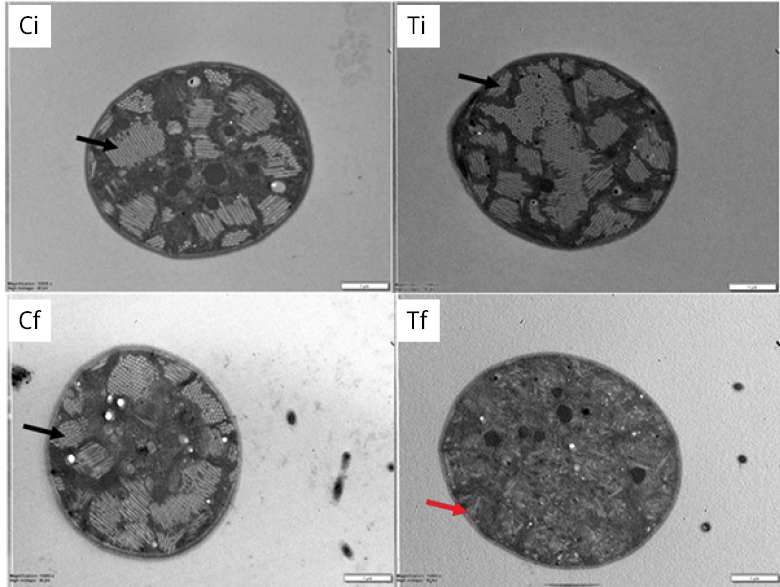
Figura 7. Micrografías de células de Microcystis spp. obtenidas por MET donde se distinguen las vesículas de gas intactas y las colapsadas. Flecha negra: vesículas de gas sin tratamiento ultrasónico. Flecha roja: vesículas de gas con tratamiento ultrasónico (colapsadas). Ci: control inicial; Ti: tratamiento inicial; Cf: control final; Tf: tratamiento final (células sedimentadas).
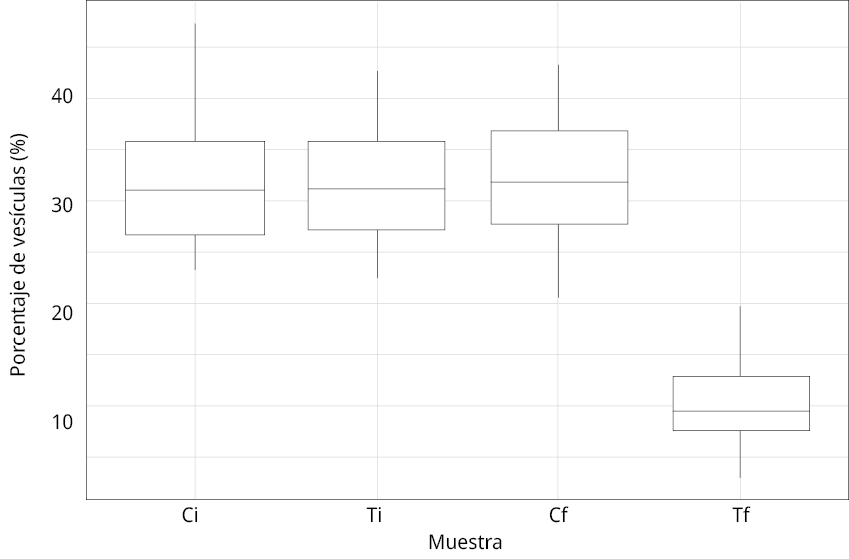
Figura 8. Valores promedio y desviación estándar del porcentaje de vesículas de gas (eje y) del área celular por muestra. Ci: control inicial; Ti: tratamiento inicial; Cf: control final; Tf: tratamiento final (células sedimentadas).
La abundancia celular total no arrojó diferencias significativas entre los tratamientos, pero se pudo observar que fue menor en el Ci y Cf en comparación a Ti y Tf (Figura 9), lo cual se atribuye a una diferencia inicial en la abundancia de las muestras del C con el T, dada por la heterogeneidad de las muestras ambientales. Se realizó un segundo análisis de estas muestras, determinando la diferencia de abundancia entre Ci y Cf y entre Ti y Tf. Los resultados reflejaron una disminución del 40 % de las células del C, mientras que no se observaron diferencias entre Ti y Tf. Cabe destacar que en esta última, como se observa en la figura 9, el valor de desvío estándar es considerablemente alto en comparación a las otras muestras, por lo que resultaría importante realizar nuevamente el análisis con mayor cantidad de réplicas.
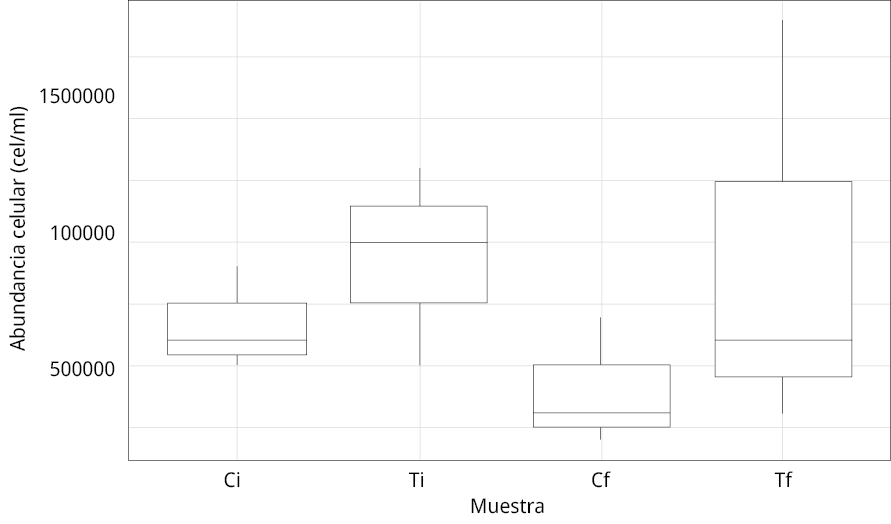
Figura 9. Promedio y desvío estándar de los valores de la abundancia celular (eje y) de Microcystis spp. obtenidos en las muestras. Ci: control inicial; Ti: tratamiento inicial; Cf: control final; Tf: tratamiento final (homogeneizado).
Discusión
En primera instancia, los valores de frecuencia y potencia de los transductores ultrasónicos se mantuvieron en los rangos esperados, por lo que se pudo descartar la influencia de un mal funcionamiento de los equipos en los resultados de Microcystis spp.
Los resultados de abundancia celular total no reflejaron efectos bajo tratamiento ultrasónico, ya que se mantuvieron en valores similares entre el tiempo inicial y el tiempo final, tanto para el C como para el T, sin diferencias significativas entre Cf y Tf. En el trabajo de Kieffer et al. (2015), donde utilizaron una frecuencia de 20 kHz y 9 W sobre un volumen de 230 ml durante 60 min, solo persistieron algunas colonias de M. aeruginosa que fueron reduciéndose en tamaño y cantidad de células a medida que aumentaba el tiempo de exposición.
Otros autores realizaron análisis a una frecuencia de 120 kHz, 0.045 W/ml (22 W) en cultivos monoespecíficos de 500 ml, y obtuvieron también una reducción de la densidad celular (aunque fue significativamente mayor en frecuencias altas, 1120 kHz) en un lapso de 10 min (Kong et al., 2019). Sin embargo, estos trabajos fueron realizados en volúmenes mucho menores (de 50 a 100 veces menores) y uno de ellos en cultivos monoespecíficos de M. aeruginosa. Al respecto, se ha reportado que bajo condiciones naturales las células de M. aeruginosa se agregan secretando material intracelular, formando colonias amorfas (Yu et al., 2013), y esta agregación favorece su supervivencia ante predadores (Yang et al., 2008).
Los cultivos en laboratorio tienen mayor número de células aisladas que agrupadas y menor cantidad de material extracelular segregado, lo que favorece su daño y/o destrucción (Kieffer et al., 2015). Lo anterior indica que el tipo de muestra en la que se realice el tratamiento es un factor determinante, por lo que es necesario proyectar experimentos a futuro con cultivos monoespecíficos y evaluar la diferencia de resultados con muestras naturales. Por otro lado, haciendo énfasis en el volumen utilizado, otros autores han hecho ensayos en 20 L de volumen a bajas frecuencias ultrasónicas (20 a 200 kHz) sin obtener resultados significativos con respecto a la densidad celular (Hobson et al., 2012). También existen revisiones aplicando esta herramienta en volúmenes mucho mayores (estanques de hasta 300000 L), tanto en bajas como en altas frecuencias (20 a 1700 kHz), donde afirman que en volúmenes más grandes se transmite significativamente menos energía y, en consecuencia, el impacto sobre las cianobacterias es mucho menor (Lürling et al., 2016).
A partir de los antecedentes y resultados obtenidos, tal como se mencionó anteriormente, se consideró importante repetir el análisis de abundancia celular utilizando un mayor número de réplicas para reforzar estos datos.
Con respecto a los resultados de las vesículas de gas por MET, se pudo observar una marcada disminución y desagregación intracelular en las células tratadas, a raíz de su colapso. Sin embargo, solo un 10 % de las colonias del total del recipiente perdió flotabilidad. Una revisión realizada por Míguez (2016) afirma que un modelo de dispositivo de la empresa LG Sonic permite tratar superficies de agua con una cobertura de hasta 500 m de diámetro y en dos o tres semanas se trataría un tajamar mediano, pero eso se debe determinar experimentalmente en cada caso. Esto sugiere que la distancia del dispositivo a la superficie y el volumen de muestra deberían estudiarse en profundidad para determinar el rango y mecanismo de acción del dispositivo y poder explicar el bajo porcentaje de células sedimentado.
La ruptura de las vesículas no produce la muerte de las células dado que pueden regenerarse bajo condiciones adecuadas de iluminación. La aplicación de esta metodología sería efectiva en sitios donde la profundidad de la columna de agua fuera superior a la de la zona fótica, ya que el descenso de las células representaría un impacto negativo sobre el proceso de fotosíntesis (Kieffer et al., 2015). Como se mencionó en la sección de Materiales y Métodos, previo al ensayo se realizaron otros estudios con el mismo dispositivo para corroborar la sedimentación irreversible de las células (Romero et al., 2022), por lo que en trabajos futuros se podría indagar en recipientes con menor irradiación de luz al fondo y evaluar la viabilidad celular. Asimismo, en estas condiciones, el escalado en el volumen resultaría importante para obtener un mayor acercamiento a la determinación de la efectividad del tratamiento.
Kong et al. (2019) obtuvieron resultados en los que se observaron disminuciones en el tamaño, la granularidad interna, la integridad y la actividad de las células, revelando que el ultrasonido ejerció un daño severo en su estructura y función. En base a esto, podrían realizarse análisis en otros parámetros a nivel intracelular por MET, además del colapso de las vesículas, comparando la integridad celular en las células tratadas. En otros estudios, la microscopía de transmisión mostraba que las vesículas se recuperaban y quedaban intactas tal como antes de haber sido colapsadas. La eficiencia del ultrasonido en suspensiones dependía tanto de la frecuencia como de la potencia acústica, considerando rangos de frecuencia entre 20 y 1146 kHz y distintas potencias, pero estas dependían de las propiedades mecánicas de las células de cada especie (Míguez, 2016).
Si bien en los resultados obtenidos por Romero et al. (2022) se observó que las células sedimentadas no recuperaban flotabilidad, el análisis por MET de las vesículas de gas en mayor tiempo postratamiento ampliaría considerablemente los resultados acerca de su comportamiento.
Según estos antecedentes, quedan por explorar diversos factores, como el rango de acción del dispositivo ultrasónico, para investigar el motivo del bajo porcentaje de células sedimentadas, evaluando tanto el volumen empleado como la distancia del transductor a la superficie. De esta manera podría ampliarse el conocimiento del mecanismo de acción del dispositivo e indagar en su factibilidad a mayor escala. También enfatizar en el efecto a posteriori del tratamiento por MET para indagar en la posible regeneración de las vesículas y en los daños en otras estructuras celulares.
Conclusiones
En líneas generales, los resultados indicaron que, en las condiciones ensayadas y a 124 kHz y 20 W, hubo una disminución muy marcada en la composición de vesículas de gas (del 30 % de células sanas a 10 % en células tratadas), con su consecuente pérdida de flotabilidad. La obtención de datos numéricos concretos a nivel intracelular sobre el colapso de las vesículas de gas aporta una gran relevancia al estudio realizado, dada la escasez de resultados similares en los antecedentes.
Esto abre nuevas puertas a la implementación de esta metodología para el análisis de otras variables intracelulares y diferentes escenarios. La pérdida irreversible de flotabilidad a mayor escala de las células de Microcystis podría significar una posible aplicación de este tratamiento como complemento a herramientas para la regulación de floraciones de este género, pero resulta crucial profundizar sobre los efectos en las variables y condiciones discutidas anteriormente.
Agradecimientos
Se agradece la colaboración de Aguas Cordobesas S.A. También a la Administración Provincial de Recursos Hídricos por brindar los recursos necesarios para la elaboración de las actividades de laboratorio y de campo; a la Universidad Nacional de Córdoba por proveer el espacio, insumos e instalaciones, tanto desde la Facultad de Ciencias Exactas, Físicas y Naturales como la Facultad de Ciencias Químicas, y al personal del Laboratorio de Hidráulica por su cooperación intelectual y administrativa. Se hace mención especial y se agradece también al Centro de Microscopía Electrónica de la Universidad Nacional de Córdoba, que proveyó el instrumento y servicio específico de Microscopía Electrónica de Transmisión para la obtención de las micrografías.
Referencias
American Public Health Association; American Water Works Association y Water Environment Federation, 2012. Standard methods for the examination of water and wastewater. 23rd ed. Washington: APHA. Standard Method 10200.
Bonansea, M.; Bazán, R.; Germán, A.; Ferral, A.; Beltramone, G.; Cossavella, A. y Pinotti, L., 2021. Assessing land use and land cover change in Los Molinos reservoir watershed and the effect on the reservoir water quality. En: J. South Am. Earth Sci., 108, 103243. DOI: https://doi.org/10.1016/j.jsames.2021.103243
Daga, I. C.; Fernández Belmonte, M. C. y Reyna, S. M., 2021. Composición algal y bioindicadores de calidad de agua. Caso de estudio: Embalse San Roque, Córdoba. Argentina. En: Cuadernos del CURIHAM., 26, pp. 1-11. DOI: http://dx.doi.org/10.35305/curiham.v26i0.143
Dick, G. J.; Duhaime, M. B.; Evans, J. T.; Errera, R. M.; Godwin, C. M.; Kharbush, J. J.; Nitschky, H. S.; Powers, M. A.; Vanderploeg, H. A.; Schmidt, K. C.; Smith, D. J.; Yancey, C. E.; Zwiers, C. C. y Denef V. J., 2021. The genetic and ecophysiological diversity of Microcystis. En: Environmental Microbiology, 23(12), pp. 7278-7313. DOI: https://doi.org/10.1111/1462-2920.15615
Ferreyra, A.; Romero, F. E.; Rodriguez, M. I.; Juaneda Allende, M.; Ruiz, M. A. y Rodriguez, A., 2023. Propuesta de protocolo de recuento Microcystis sp. (resumen extendido) [En línea]. En: Instituto Nacional del Agua. XXVII Congreso Nacional del Agua CONAGUA. Bs. As., Argentina, (28-30 de Agosto de 2023). Buenos Aires: Argentina. pp. 568. [Consulta: 7 de marzo de 2024]. Disponible en: https://conagua.ina.gob.ar/archivos/Libro-resumenes-CONAGUA2023.pdf
Halac, S. R.; Bazán, R. D. V.; Larrosa, N. B.; Nadal, A. F.; Ruibal-Conti, A. L.; Rodriguez, M. I.; Ruiz, M. A. y López, A. G., 2019. First report on negative association between cyanobacteria and fecal indicator bacteria at San Roque reservoir (Argentina): impact of environmental factors. En: Journal of Freshwater Ecology, 34(1), pp. 273-291.
Halac, S.; Mengo, L.; Guerra, L.; Lami, A.; Musazzi, S.; Loizeau, J. L.; Ariztegui, D. y Piovano, E. L., 2020. Paleolimnological reconstruction of the centennial eutrophication processes in a sub-tropical South American reservoir. En: Journal of South American Earth Sciences, 103, 102707. DOI: https://doi.org/10.1016/j.jsames.2020.102707
Hobson, P.; Dickson, S.; Burch, M.; Thorne, O.; Tsymbal, L.; House, J.; Brookes, J.; Chang, D.; Kao, S.; Lin, T.; Bierlein, K. y Little, J., 2012. Alternative and innovative methods for source water management of algae and cyanobacteria [En linea]. Denver: The Water Research Foundation. [Consulta: 30 de octubre de 2023]. Disponible en: https://www.waterrf.org/resource/alternative-and-innovative-methods-source-water-management-algae-and-cyanobacteria-0
Huang, Y. R.; Li, L.; Wei, X. M.; Li, H. Z.; Zeng, J. Y. y Kuang, R., 2020. An investigation of mechanisms for the enhanced coagulation removal of Microcystis aeruginosa by low-frequency ultrasound under different ultrasound energy densities. En: Ultrasonics Sonochemistry, 69, 105278. DOI: https://doi.org/10.1016/j.ultsonch.2020.105278
HW Group, 2014. Hercules - Software for serial port terminal [En línea]. Versión 3.2.8. Praga: HW Group. [Consulta: 1 de septiembre de 2024]. Disponible en: https://www.hw-group.com/product-version/hercules
ImageJ, 2023. ImageJ [En línea]. Versión 1.8.0. [s.l.]: [s.n.]. [Consulta: 1 de septiembre de 2024]. Disponible en: https://imagej.net/
Kieffer, L. A.; de la Sierra, P. M.; Devercelli, M.; Luna, J. A.; Claret, M. y Leiz, E., 2015. Ensayos en laboratorio para el control de floraciones algales mediante ultrasonido [En línea]. En: Ciencia, Docencia y Tecnología, (50), pp. 224-243. [Consulta: 30 de octubre de 2023]. Disponible en: https://dialnet.unirioja.es/servlet/articulo?codigo=5092631
Kong, Y.; Peng, Y.; Zhang, Z.; Zhang, M.; Zhou, Y. y Duan, Z., 2019. Removal of Microcystis aeruginosa by ultrasound: Inactivation mechanism and release of algal organic matter. En: Ultrasonics Sonochemistry, 56, pp. 447-457. DOI: https://doi.org/10.1016/j.ultsonch.2019.04.017
Lürling, M.; Waajen, G. y de Senerpont Domis, L. N., 2016. Evaluation of several end-of-pipe measures proposed to control cyanobacteria. En: Aquatic Ecology, 50, pp. 499-519. DOI: https://doi.org/10.1007/s10452-015-9563-y
Mengo, L.; Deon, J.; Halac, S.; Foray, G.; Loizeau, J. L.; Ariztegui, D.; Chiavassa, S.; Adatte, T.; Pasquini, A.; Spangenberg, J.; Costamagna, I. y Piovano, E., 2024. Deciphering the intricate link between watershed-level land use changes and reservoir eutrophication in central Argentina over the 20th-21st century. En: Anthropocene, 100437. DOI: https://doi.org/10.1016/j.ancene.2024.100437
Míguez Caramés, D. M., 2016. Tecnologías de control de floraciones de cianobacterias y algas nocivas en cuerpos de agua, con énfasis en el uso de irradiación por ultrasonido. En: INNOTEC, (12), pp. 54-61. DOI: https://doi.org/10.26461/12.06
O’Farrell, I.; Motta, C.; Forastier, M.; Polla, W.; Ota~no, S.; Meichtry, N. y Lombardo, R., 2019. Ecological meta-analysis of bloom-forming planktonic Cyanobacteria in Argentina. En: Harmful Algae, 83, pp. 1–13. DOI: https://doi.org/10.1016/j.hal.2019.01.004
Peng, Y.; Zhang, Z.; Kong, Y.; Li, Y.; Zhou, Y.; Shi, X. y Shi, X., 2020. Effects of ultrasound on Microcystis aeruginosa cell destruction and release of intracellular organic matter. En: Ultrasonics Sonochemistry, 63, 104909. DOI: https://doi.org/10.1016/j.ultsonch.2019.104909
Rodríguez, M. I. y Ruiz, M. A., 2016. Limnology of the San Roque Reservoir. En: Wunderlin, D. A., ed. The Suquía River Basin (Córdoba, Argentina). Cham: Springer. (The Handbook of Environmental Chemistry, vol. 62). DOI: https://doi.org/10.1007/698_2016_467
Romero, F. E.; Ferreyra, A.; Marasas, M. S.; Juaneda Allende, M.; Gómez, M. G.; Constanzo, D.; Marconi G.; Vitulich C. A.; Ruiz Diaz, P.; Ceballos, M. L.; Rodríguez González S. A.; Halac, S. R.; Amé M. V.; Rodríguez, M. I. y Rodríguez, A., 2022. Elaboración de un dispositivo ultrasónico para control de floraciones algales del género Microcystis en el embalse San Roque, Córdoba: primeros pasos para evaluación de sus efectos. En: IEEE. 2022 IEEE Biennial Congress of Argentina (ARGENCON). San Juan, Argentina (7-9 setiembre 2022). San Juan: IEEE. DOI: https://doi.org/10.1109/ARGENCON55245.2022.9939993
Posit, 2023. RStudio [En línea]. Boston: Posit. Versión 6.1.0. [Consulta: 1 de septiembre de 2024]. Disponible en: https://posit.co/download/rstudio/
Sosa Benegas, G. R.; Fernandes Bernal, S. P.; Maia de Oliveira, V. y Zambrano Passarini, M. R., 2020. Inibição do crescimento de Microcystis Aeruginosa e degradação da cianotoxina microcistina LR por extratos de microrganismos do continente antártico [En línea]. Foz do Iguaçu: UNILA. [Consulta: 25 de julio de 2023]. Disponible en: https://dspace.unila.edu.br/handle/123456789/6029
Yang, Z.; Kong, F.; Shi, X.; Zhang, M.; Xing, P. y Cao, H., 2008. Changes in the morphology and polysaccharide content of Microcystis aeruginosa (Cyanobacteria) during flagellate grazing. En: Journal of Phycology, 44(3), pp. 716-720. DOI: https://doi.org/10.1111/j.1529-8817.2008.00502.x
Yu, G.; Zhao, C.; Liu, B.; Li, Q. y Gao, H., 2013. Removal of algae from raw water by ultrasonic irradiation and flocculation: a pilot scale experiment [En línea]. En: J Environ Biol., 34, pp. 331-335. [Consulta: 30 de octubre de 2023]. Disponible en: http://www.jeb.co.in/journal_issues/201304_apr13_supp/paper_07.pdf


