A partir del verano de 2023, la Laguna Garzón registró un crecimiento excesivo de plantas sumergidas de Myriophyllum quitense, cubriendo toda la laguna, lo que afectó varios usos del sistema y generó preocupación social. Este trabajo describe la proliferación de plantas acuáticas, sus efectos en otras comunidades biológicas, las condiciones ambientales que la promovieron, y realiza recomendaciones para su gestión. La especie tolera salinidades bajas a moderadas y éste es el primer registro de una proliferación de esta magnitud en la laguna. La cobertura de plantas aumentó la transparencia y los nutrientes del agua, disminuyó el fósforo del sedimento y generó cambios en la comunidad bentónica. La proliferación podría deberse a la alta disponibilidad de nutrientes en comparación con datos de la década del 2000 y al prolongado período con agua dulce en la laguna debido a la falta de conexión con el mar. Se sugiere realizar aperturas artificiales de la barra para descargar agua, sedimentos y plantas, permitiendo la entrada de agua salada que afecta a plantas y cianobacterias por su intolerancia a altas salinidades. La cosecha mecánica puede ser una medida complementaria en sitios puntuales. Se trata de medidas basadas en el funcionamiento natural del sistema y de bajo costo.
Palabras clave: eutrofización, lagunas costeras, Myriophyllum quitense.
A partir do verão de 2023, a Laguna Garzón registrou um crescimento excessivo de plantas submersas de Myriophyllum quitense, cobrindo toda a lagoa, o que afetou diversos usos do sistema e gerou preocupação social. Este trabalho descreve a proliferação de plantas aquáticas, seus efeitos em outras comunidades biológicas, as condições ambientais que a promoveram e faz recomendações para seu manejo. Esta espécie tolera salinidades baixas a moderadas e este é o primeiro registro de uma proliferação desta magnitude na lagoa. A cobertura vegetal aumentou a transparência da água e dos nutrientes, reduziu o fósforo nos sedimentos e gerou alterações na comunidade bentônica. A proliferação pode dever-se à elevada disponibilidade de nutrientes face aos dados da década de 2000 e ao período prolongado com água doce na lagoa devido à falta de ligação ao mar. Sugere-se fazer aberturas artificiais na barra com níveis de água suficientes para escoamento de água, sedimentos e plantas, permitindo a entrada de água salgada que afeta plantas e cianobactérias devido à sua intolerância às salinidades elevadas. A colheita mecânica pode ser uma medida complementar em locais específicos. Estas são medidas baseadas no funcionamento natural do sistema e de baixo custo.
Palavras-chave: eutrofização, lagunas costeras, Myriophyllum quitense.
Introducción
La causa fundamental del desarrollo explosivo de productores primarios en ecosistemas acuáticos es la eutrofización, que se define como el enriquecimiento natural o artificial de nutrientes de los cuerpos de agua, principalmente con nitrógeno y fósforo (National Academy of Science, 1969; Quinlan et al., 2020). El aumento de la disponibilidad de nutrientes acelera el crecimiento del fitoplancton y de plantas acuáticas, que puede tener consecuencias a largo plazo muy nocivas para los ecosistemas como la presencia de especies de cianobacterias tóxicas, reducción del oxígeno en agua, mortandad de peces y pérdida de biodiversidad en general (Heisler et al., 2008; O’Neil et al., 2012). Esto reduce progresivamente la resiliencia del ecosistema acuático, volviéndose más vulnerable frente a perturbaciones naturales y al cambio climático (Scheffer et al., 2001; Moss et al., 2011; Meerhoff et al., 2022).
La eutrofización es la amenaza principal de los sistemas acuáticos a nivel mundial (Hwang, 2020; Meerhoff et al., 2022), y en las lagunas costeras de Sudamérica en particular (Esteves et al., 2008). En lagunas costeras, que se caracterizan por el intercambio intermitente del agua con el océano a través de la apertura de un canal en una barra arenosa (Kjerfve, 1994; McSweeney et al., 2017), y en estuarios en general, la eutrofización promueve una sucesión o alternancia a lo largo del tiempo de productores primarios, que puede derivar en la proliferación de plantas sumergidas, algas filamentosas epífitas, microalgas coloniales y macroalgas marinas; finalmente puede terminar dominando el fitoplancton potencialmente tóxico (McGlathery, 2001; O’Neil et al., 2012). La alternancia de productores primarios ha sido observada en las cuatro lagunas costeras de Uruguay (José Ignacio, Garzón, de Rocha y de Castillos) (Rodríguez- Gallego et al., 2017 y observaciones no publicadas) y reportada mundialmente (McGlathery, 2001; Pérez-Ruzafa et al., 2019). Estos cambios alteran el funcionamiento ecológico, las tramas tróficas y la provisión de servicios ecosistémicos, comprometiendo las pesquerías costeras (McGlathery, 2001).
El proceso de eutrofización se considera relativamente reversible si la carga externa de nutrientes que reciben los cuerpos de agua desde la cuenca se reduce. Sin embargo, dependiendo del sistema y de la carga de nutrientes en los sedimentos y los suelos de la cuenca, la recuperación puede demorar cientos de años (Carpenter et al., 2005). El proceso de apertura de la barra en las lagunas costeras puede comportarse como un mecanismo natural de remoción de nutrientes y materia orgánica, debido al arrastre y eyección de sedimentos y grandes volúmenes de agua enriquecida en nutrientes hacia el mar, y el posterior ingreso de agua marina pobre en nutrientes.
Rodríguez-Gallego et al. (2017) registraron una relación inversa entre la concentración de nutrientes en agua y sedimento con la salinidad en las lagunas costeras de Uruguay. Debido a esto, el manejo antrópico de la barra de la Laguna de Rocha busca imitar lo máximo posible al sistema natural de apertura y conexión con el océano. Es decir, cuando se alcanzan los máximos valores de nivel del agua en la laguna -sin que generen afectaciones en viviendas y campos ganaderos- se habilita la apertura artificial de la barra, en caso de que no se produzca previamente una apertura natural (Conde et al., 2019). Un manejo con criterios similares es el propuesto en la Laguna Garzón por el Ministerio de Ambiente (protocolo de manejo de la barra en proceso de aprobación). A diferencia de los lagos sin conexión al mar, en las lagunas costeras el mecanismo de intercambio de agua con el mar permite regular, por un lado, la carga de nutrientes del sistema y, por otro, la abundancia de productores primarios debido a la variabilidad de la salinidad que los afecta (Odebrecht et al., 2008; Abreu et al., 2009). Por ejemplo, las cianobacterias tienen baja tolerancia a la salinidad y a su variabilidad (Cabrera et al., 2013), al igual que las plantas sumergidas (Rodríguez-Gallego et al., 2015), por lo que se hipotetiza que el manejo de la barra de las lagunas costeras puede ser determinante en el mantenimiento de la calidad del agua.
En la Laguna Garzón se registró un crecimiento excesivo de plantas sumergidas a partir del verano de 2023, causado por la especie Myriophyllum quitense Kunth de la familia Haloragaceae. Este crecimiento ha afectado severamente varios usos del sistema como la pesca artesanal y los deportes náuticos como el kitesurf, y ha generado preocupación en la opinión pública. El desarrollo de la planta comenzó en los bolsones de la desembocadura de los afluentes A° La Cruz y Aº Garzón, en el noreste de dicha laguna; desde entonces avanzó hacia la laguna en el verano de 2023 y ya en otoño cubrió prácticamente todo el cuerpo de agua hasta el brazo de la desembocadura y la Laguna de Anastasio, situación que se mantuvo hasta marzo de 2024.
Se trata del primer registro de una proliferación de esta magnitud en la Laguna Garzón, ya que no hay reportes históricos de habitantes locales (pescadores artesanales y productores agropecuarios, comunicación personal) ni en estudios del registro histórico de polen (Rodríguez-Gallego et al., 2012). Incluso Carvalho et al. (2024), en un exhaustivo estudio paleolimnológico de esta laguna que abarcó un período de 5024 años hasta el presente, reportaron que la composición de la materia orgánica fue muy estable entre milenios sin registro de picos de materia orgánica, polen u otros indicadores de aumento severo de la producción primaria en el sistema. Esto indicaría que otros procesos están ocurriendo en la cuenca y en la laguna que podrían promover el crecimiento de estas plantas.
Myriophyllum quitense es una especie sumergida enraizada de la que emerge hacia afuera del agua únicamente el tramo final del tallo con hojas modificadas y flores. Tolera niveles de salinidad bajos a medios (Orchard, 1981), no mayores a 14 (McAlpine et al., 2007). En Uruguay fue registrada en tres lagunas costeras con conexión al mar (Garzón, de Rocha y de Castillos, Rodríguez observación personal) y en la Laguna del Diario (Kruk et al., 2006), aunque también hay registros históricos en humedales de Montevideo y San José (Alonso-Paz y Bassagoda, 2006). En la Laguna de Rocha, la especie alcanzó sus máximas abundancias con salinidades menores a 10, pero llegó a tolerar salinidades de 16, aunque con valores de biomasa marginales (Rodríguez-Gallego et al., 2015).
En la Laguna del Diario fue registrada ocupando gran parte de la superficie y columna de agua (Vianna, 2012), pero en condiciones de muy baja salinidad (promedio de 0.3, datos convertidos de conductividad a salinidad). En la Laguna de Rocha fue reportada una proliferación de plantas sumergidas en verano de 2003 en el bolsón noreste, donde fue predominante en las bahías más cercanas a la orilla, con valores de biomasa de hasta 307 gPSm-2 (Rodríguez-Gallego et al., 2010, 2015). Esta proliferación de plantas desapareció a partir de una apertura de la barra, coincidiendo con el aumento de la salinidad. Proliferaciones similares habían sido reportadas previamente en 1997 y 2001 (Rodríguez-Gallego et al., 2010), en especial de Egeria densa Planch. en la desembocadura del A° Rocha, aunque ninguna tan extensa. Desde 2003 no fueron registradas proliferaciones similares en la Laguna de Rocha.
En coincidencia temporal con la proliferación en Garzón, en invierno de 2023 se registró una abundancia inusual de M. quitense en el bolsón del Chafalote, en la Laguna de Castillos, la que alcanzó su máxima cobertura en verano de 2024 a salinidades entre 0 y 1, cubriendo prácticamente la totalidad del bolsón. Esto indicaría que los procesos que están fomentando la proliferación de plantas sumergidas pueden estar ocurriendo -con diferentes magnitudes- en todas las lagunas costeras del país, y por lo tanto entender las causas permitiría aplicar medidas de manejo antes de que los cambios sean irreversibles.
Este trabajo tiene como objetivo describir la proliferación de plantas sumergidas en la Laguna Garzón desde su aparición y hasta el verano de 2024, las condiciones ambientales actuales y los cambios en el tiempo que podrían explicar su desarrollo, así como los efectos en otras comunidades acuáticas y las posibles medidas de gestión para mitigar este impacto.
Área de estudio
La Laguna Garzón se ubica en la costa Este de Uruguay y constituye el límite departamental entre Rocha y Maldonado; tiene una superficie de 1.750 ha y una cuenca que se extiende por 56.000 ha (Figura 1). Está categorizada como Área de Manejo de Hábitats y/o Especies Decreto 341/014 (Uruguay, 2014) del Sistema Nacional de Áreas Protegidas, e integra la Reserva de Biosfera Bañados del Este. Esta laguna recibe la desembocadura del Aº Garzón y la Cañada de la Cruz que forman ensenadas muy extensas, mientras que la Cañada de Anastasio en el sector noroeste tiene dos bolsones asociados -uno de ellos denominado Laguna de Anastasio- que poseen una importante influencia salina desde la laguna.
Estas zonas presentan importantes humedales de agua dulce y salobre, y muy alta biodiversidad de plantas acuáticas (Rodríguez-Gallego et al., 2023) y aves. En la Figura 1 se muestra el mapa de coberturas y usos del suelo de la cuenca, donde se destaca la superficie de bosque nativo y matorral psamófilo, principalmente en la cuenca alta asociada a la serranía y a los cursos de agua, y en la cuenca baja asociada a la laguna y zona costera. También se observan humedales que ocupan el 3.5 % de la superficie de la cuenca. Las dunas y arenales se ubican en la costa marina y desembocadura de la laguna. El campo natural es el ecosistema predominante (68.3 % de la superficie) y se utiliza para la ganadería extensiva, mientras que los siguientes usos productivos del suelo en importancia son la forestación para fines comerciales (8.6 % de la cuenca) y la agricultura (8.2 %).
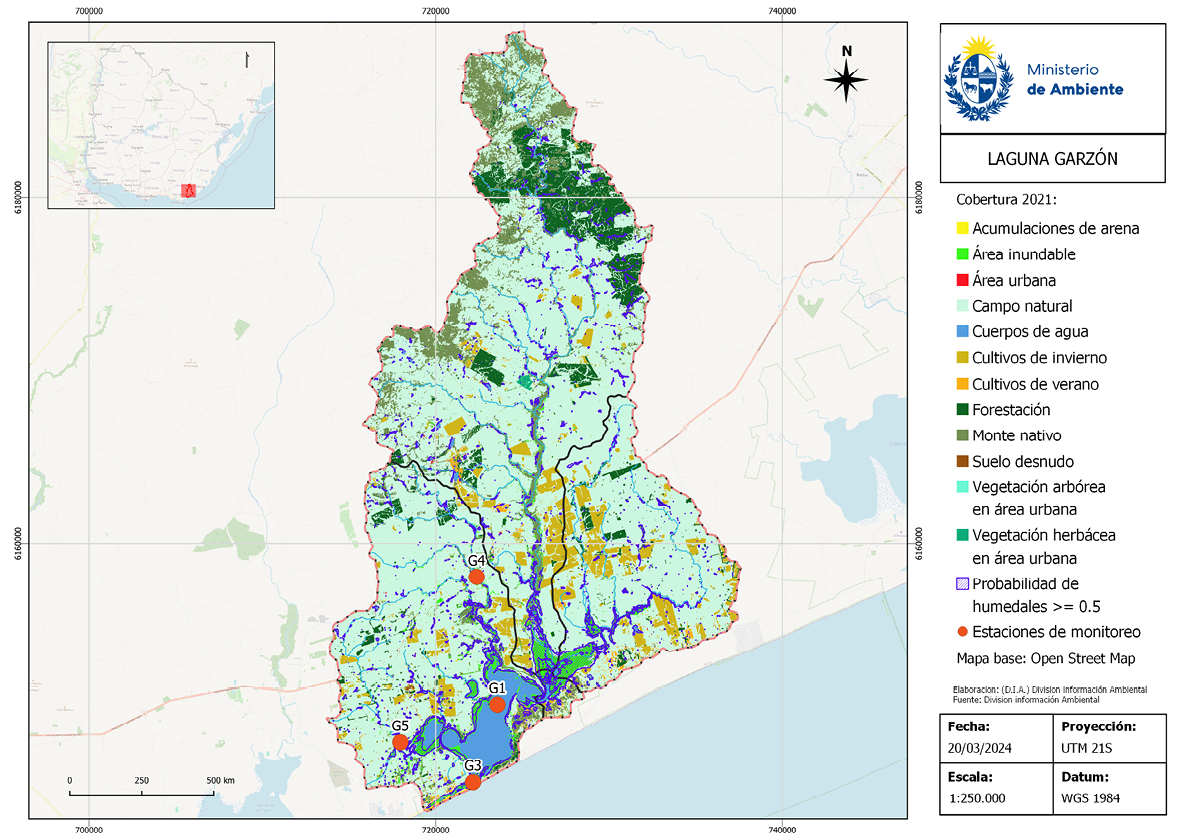
Figura 1. Coberturas vegetales y usos del suelo en la cuenca de la Laguna Garzón. Los puntos rojos indican los sitios de muestreo. Fuente: elaborado por la División Información Ambiental del Ministerio de Ambiente (DIA-MA).
Materiales y Métodos
La información presentada y analizada en este trabajo surge del Convenio interinstitucional de colaboración técnico-científica entre el Ministerio de Ambiente (MA, Dirección Nacional de Calidad y Evaluación Ambiental, DINACEA) y la Universidad de la República (Centro Universitario Regional Este, CURE) para el monitoreo de la calidad ambiental de las lagunas costeras. Este monitoreo se realiza estacionalmente desde 2017 en la Laguna Garzón, aunque el CURE registra relevamientos estivales desde 2015. Los sitios de muestreo se ubican en el sur, cercano al puente, y en la zona norte (Figura 1). Los datos del monitoreo se reportan en el Observatorio Ambiental Nacional.
Asimismo, se compararon los datos fisicoquímicos históricos existentes con un período de datos actuales pero anteriores a la aparición de las plantas. Los datos históricos fueron generados entre 2002 y 2006 por la Sección Limnología de la Facultad de Ciencias (Conde et al., 2003; Rodríguez-Gallego et al., 2017), ver (Uruguay. Ministerio de Ambiente et al., 2021) para una descripción detallada de los datos analizados. La comparación se realizó con los valores disponibles entre febrero de 2015 y diciembre de 2020, para reducir el efecto del desbalance de datos en la comparación y además evitar el sesgo introducido por la presencia de plantas.
Esta comparación se realizó empleando análisis de varianza de una vía, previo testeo de la homocedasticidad y normalidad, y la comparación se realizó mediante el test de Tukey de acuerdo con Zar (1999). De no cumplirse alguno de dichos supuestos se empleó test de Kruskal y Wallis. Adicionalmente, se realizaron correlaciones de spearman entre variables. Los análisis se realizaron con el software R versión 2.15.1 (R Development Core Team, 2012).
El relevamiento de organismos del sedimento (organismos bentónicos y plantas sumergidas) se realizó empleando una draga Ekman, tomando una única muestra por sitio. Dichas muestras se tamizaron con una malla de 0.5 mm, se preservaron en alcohol 95º hasta su posterior análisis bajo lupa estereoscópica, donde los organismos se clasificaron hasta el menor nivel taxonómico posible. A partir de que aparecieron plantas sumergidas, las muestras de biomasa de plantas se tomaron por triplicado con el uso de un cuadrante de madera flotante (muestreos de mayo, agosto y noviembre de 2023 y febrero de 2024), colectando toda la biomasa contenida en la columna de agua dentro de dicho cuadrante.
La biomasa de plantas sumergidas se determinó a partir del peso de las plantas colectadas en cada sitio de muestreo, luego de escurrir el exceso de agua. La determinación del peso seco consistió en tomar una submuestra de la biomasa fresca, la cual se secó en estufa a 60 ºC durante 48 horas y se registró el peso fresco y seco (Arocena, 2016). Este valor fue posteriormente extrapolado a la muestra entera y a 1 m2.
El contenido de fósforo y nitrógeno de la biomasa de plantas se estimó a partir de valores obtenidos de la bibliografía para Myriophyllum spicatum L. (única del género para la que se reporta dicha información; nitrógeno = 3.5 % del peso seco de plantas (Nichols y Keeney, 1976) y fósforo = 0.25 % (Schmitt y Adams, 1981). Se estimó la masa de nutrientes contenida en la vegetación sumergida para el invierno de 2023, extrapolando el contenido de nutrientes en las plantas por m2 a la superficie vegetada. La superficie vegetada empleada fue de 239 ha, obtenida mediante el análisis de una imagen satelital de Sentinel 2 del 21 de julio de 2023 (información brindada por el Ministerio de Ambiente de Uruguay).
En cada sitio se midió in situ temperatura, salinidad, oxígeno disuelto, saturación de oxígeno, pH y turbidez (sonda Horiba U-52), y se determinó la profundidad del disco de Secchi. Las muestras de agua para determinación de nutrientes, sólidos suspendidos, materia orgánica y clorofila a fueron colectadas por debajo de la superficie del agua con un bidón y trasladadas al CURE en oscuridad y frío para su posterior procesamiento.
Las muestras de sedimento fueron obtenidas de la muestra intacta colectada con la draga Ekman a 0.5 cm de profundidad para clorofila a y a 1 cm para nitrógeno, fósforo y materia orgánica. Se determinaron los siguientes nutrientes para agua: fósforo total PT (Valderrama, 1981 y Murphy y Riley, 1962), nitrógeno total NT (Valderrama, 1981; Mackereth et al., 1978), nitrato NO3 (Mackereth et al., 1978), nitrito NO2 (Bendschneider y Robinson, 1952), amonio NH4 (Koroleff, 1970); y en sedimento: fósforo total PT (Valderrama, 1981 y Murphy y Riley, 1962) y nitrógeno total NT (Valderrama, 1981; Müller y Weideman, 1955). También se cuantificaron los sólidos en suspensión SS (American Public Health Association, et al., 2012) y la materia orgánica asociada MOS (American Public Health Association, et al., 2012), así como la materia orgánica del sedimento, ambas por ignición MO sed (United States Department of Agriculture, Natural Resources Conservation Service, 2014), la concentración de clorofila a del agua Clo-a (Jespersen y Christoffersen, 1987) y del sedimento Clo-a sed (Lorenzen, 1967). Se consideró como nitrógeno inorgánico disuelto (NID) a la suma de nitrato, nitrito y amonio.
El fitoplancton fue colectado de agua superficial y fijado en Lugol, y mediante un arrastre de 2 minutos con una red de 100 μm equipada con flujómetro y fijado en formaldehído al 4 % para la detección temprana de cianobacterias, de acuerdo con Kruk et al., 2015 y Segura et al., 2017. La muestra de fitoplancton obtenida con la red de 100 µm se analizó en el microscopio invertido en cámaras de conteo de Sedgewick Rafter de 1 ml, la identificación de los organismos se realizó hasta el menor nivel de clasificación posible y se estimó la concentración de organismos por volumen de agua filtrada. La muestra de agua subsuperficial se analizó por el clásico método Utermöhl (1958) en cámaras de sedimentación de 25 ml.
Para determinar la extensión de la floración de cianobacterias y de plantas sumergidas en el verano de 2024 se realizó el análisis de imágenes satelitales. Se distinguió entre ambos tipos de organismos utilizando las distintas intensidades de color relacionadas con absorciones espectrales diferenciales de los pigmentos específicos, como la fiocianina (cianobacterias) y la clorofila a (plantas sumergidas).
Asimismo, se describió el estado de la barra arenosa durante el período de estudio, indicando el tiempo que permaneció abierta y cerrada. Los datos fueron brindados por el personal de guardaparques del área protegida, quienes llevan un registro diario del estado de la barra.
Resultados y Discusión
Descripción de la proliferación de plantas sumergidas
La aparición de M. quitense en cantidades inusuales fue registrada en noviembre de 2022, y su crecimiento comenzó a acelerarse desde el verano de 2023, tanto en biomasa como en distribución, dispersándose hacia el centro y sur de la laguna para el otoño siguiente (Figura 2). El máximo valor promedio de biomasa registrado fue de 2815.8 ± 787.6 gPS/m² en primavera de 2023, manteniendo valores muy elevados hasta el verano de 2024. A partir de un evento de lluvia a mediados de febrero de 2024 comenzó un retroceso de M. quitense y para marzo se restringía a la zona centro, sur y la Laguna de Anastasio.
En las etapas iniciales de la proliferación de plantas se registraron, además de M. quitense, dos especies de macroalgas Charophytas (Nitella sp. y Chara sp.) comúnmente encontradas en las Lagunas de Rocha y de Castillos; pero a partir de otoño M. quitense fue la única especie registrada.
Este constituye el primer registro de vegetación sumergida ocupando gran parte del cuerpo de agua en la Laguna Garzón, siendo los registros previos correspondientes a zonas con vegetación sumergida de Zannichellia palustris (Santana y Fabiano, 1999), y áreas con Ruppia maritima en el NE, en 2003 (Rodríguez-Gallego, observación personal). El registro polínico histórico (Rodríguez-Gallego et al., 2012) muestra que especies de la familia de las Haloragaceae y R. marítima estuvieron presentes en el pasado, con fluctuaciones importantes y con una tendencia a reducir su presencia hasta la actualidad. Si bien se han reportado proliferaciones de plantas sumergidas en lagunas de Uruguay, como la de Egeria densa Planch. en la Laguna Blanca (Mazzeo et al. 2003) y de esta misma especie en las lagunas de Rocha (Rodríguez-Gallego et al., 2015) y del Diario (Kruk et al., 2006 y Vianna, 2012), este crecimiento tan rápido y abarcador no había sido reportado previamente.
Es interesante señalar que los estudios de proliferación de plantas en nuestro país indican que ocurrieron luego de eventos de sequía relevantes. Esto fue señalado en la Laguna Blanca (Mazzeo et al., 2003), de Rocha (Rodríguez-Gallego et al., 2015) y del Diario (Inda et al., 2016). Si bien la sequía registrada en Uruguay en 2022 y 2023 (Instituto Uruguayo de Meteorología, 2023) no generó una reducción dramática del nivel de agua de las lagunas, la ausencia de eventos de lluvia no permitió alcanzar los niveles que desencadenan la apertura de las barras y eso habría ocasionado condiciones favorables para el desarrollo de plantas sumergidas (nivel del agua relativamente alto, estable en el tiempo y baja salinidad). Esto explicaría por qué esta especie también proliferó en la Laguna de Castillos, indicando que hay condiciones que no dependen de la situación puntual de cada laguna.
Igualmente, Carvalho et al. (2024) reportaron un evento de sequía en la década del 1970 en el registro paleolimnológico de la Laguna Garzón, pero no observaron cambios en el registro sedimentario que pudieran asociarse a proliferaciones de productores primarios de la magnitud observada actualmente; lo cual indicaría que si bien el clima puede influir existen otros factores que estarían explicando los eventos de proliferación de plantas.
El contenido de nitrógeno y fósforo en la biomasa total estimada de plantas en invierno de 2023 fue de 34.7 ± 12.9 ton para el nitrógeno y 2.5 ± 0.9 ton para el fósforo. Estos valores subestiman la carga total ya que en el muestreo de campo, en una fecha muy cercana a la de la imagen empleada (9 de agosto de 2023), la zona vegetada era considerablemente mayor a la registrada por la imagen. El mapeo de vegetación sumergida empleando imágenes satelitales presenta limitaciones debido a la profundidad y turbidez del agua, por lo cual debe ser considerado una estimación aproximada (Zweig et al., 2015). Igualmente, los resultados muestran la magnitud de los nutrientes acumulados en la biomasa de plantas, que pueden ser rápidamente intercambiados con el sedimento o quedar disponibles en la columna de agua para ser incorporados por otros productores primarios, como perifiton o fitoplancton. Los resultados evidencian el riesgo de empeoramiento de la condición actual de la laguna en caso de que mueran las plantas y se produzca una liberación de nutrientes.
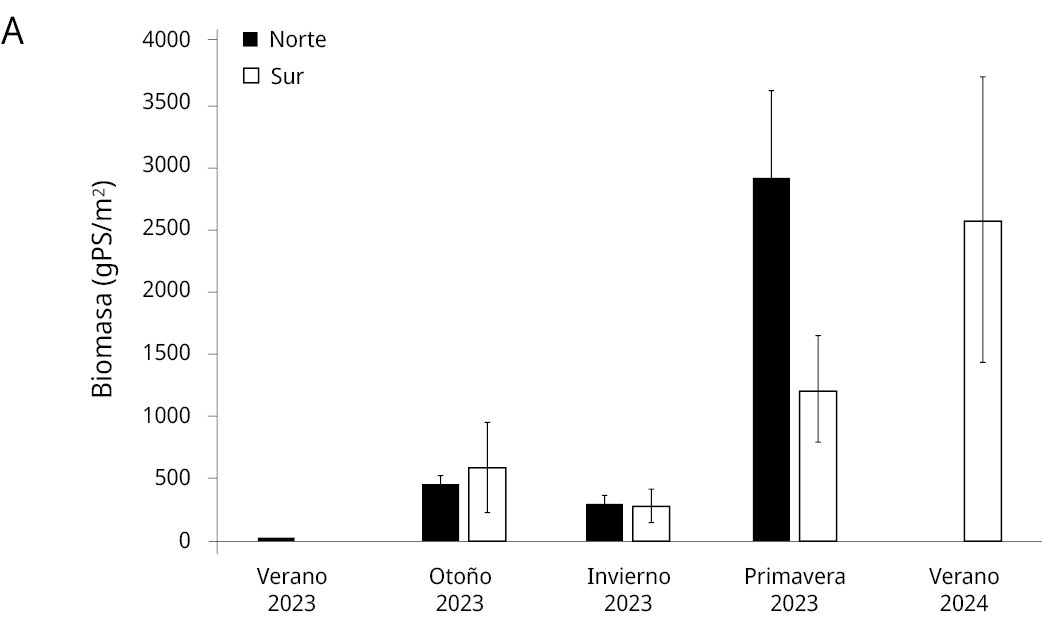

Figura 2. A) Promedio y desvío estándar de biomasa seca de Myriophyllum quitense en la Laguna Garzón expresada en g de peso seco/m² (gPS/m²). B) Foto de la proliferación de plantas tomada con dron. C) Foto de las plantas tomada debajo del agua.
Características ambientales y de otras comunidades biológicas antes y durante la proliferación de plantas sumergidas
En el período con plantas (2023 - 2024) se observó una reducción notoria de los valores de salinidad (Tabla 1 y Figura 3) respecto del período sin plantas. Si bien en términos promedios en el período previo a la proliferación de las plantas la salinidad estuvo dentro del rango de tolerancia de la especie (ca. 10), al mirar los datos brutos se observa que todos los años tuvieron eventos de salinidad elevada y por encima de dicho valor, y que a partir de la primavera de 2022 comenzó un período prolongado de muy baja salinidad que se extendió hasta la actualidad. Aunque la serie de datos no captó un aumento importante de salinidad en la última apertura de la barra en invierno de 2022, fue evidenciado en la comunidad de fitoplancton que mostró una importante influencia marina (se presentó una floración de dinoflagelados marinos que estaba ocurriendo en las aguas costeras en ese momento). Este evento podría haber sido suficiente para evitar la proliferación de plantas sumergidas en ese momento, dado que desde otoño de 2021 la salinidad fue muy baja.
Durante ambos períodos analizados, la profundidad del agua fue relativamente alta (Rodríguez-Gallego et al., 2017). Una diferencia muy notoria entre períodos fue el aumento de la transparencia del agua (Tabla 1), probablemente consecuencia de la presencia de las plantas que reducen la turbulencia del agua provocada por el viento y favorecen la sedimentación. Este efecto se registró en la proliferación de plantas sumergidas en la Laguna de Rocha (Rodríguez-Gallego et al., 2010), y ha sido ampliamente reportado en la bibliografía (James et al., 2004), pero no fue hallado en proliferaciones similares en lagunas de agua dulce de nuestro país (Vianna, 2012, Mazzeo et al., 2003).
También se registró un aumento notorio del pH entre períodos, lo cual es un efecto esperable debido al aumento de la fotosíntesis de las plantas (Bornette y Puijalon, 2011). El oxígeno disuelto y la saturación en agua aumentó levemente, también producto de la fotosíntesis de la masa de plantas, aunque mediciones nocturnas y cercanas al sedimento podrían arrojar menores valores como fue registrado en otros casos en Uruguay (Mazzeo et al., 2003). La temperatura del agua estuvo dentro del rango estacional esperado (Tabla 1).
Tabla 1. Comparación de las condiciones ambientales de la Laguna Garzón en los períodos sin vegetación (izquierda) y con vegetación (derecha) sumergida.
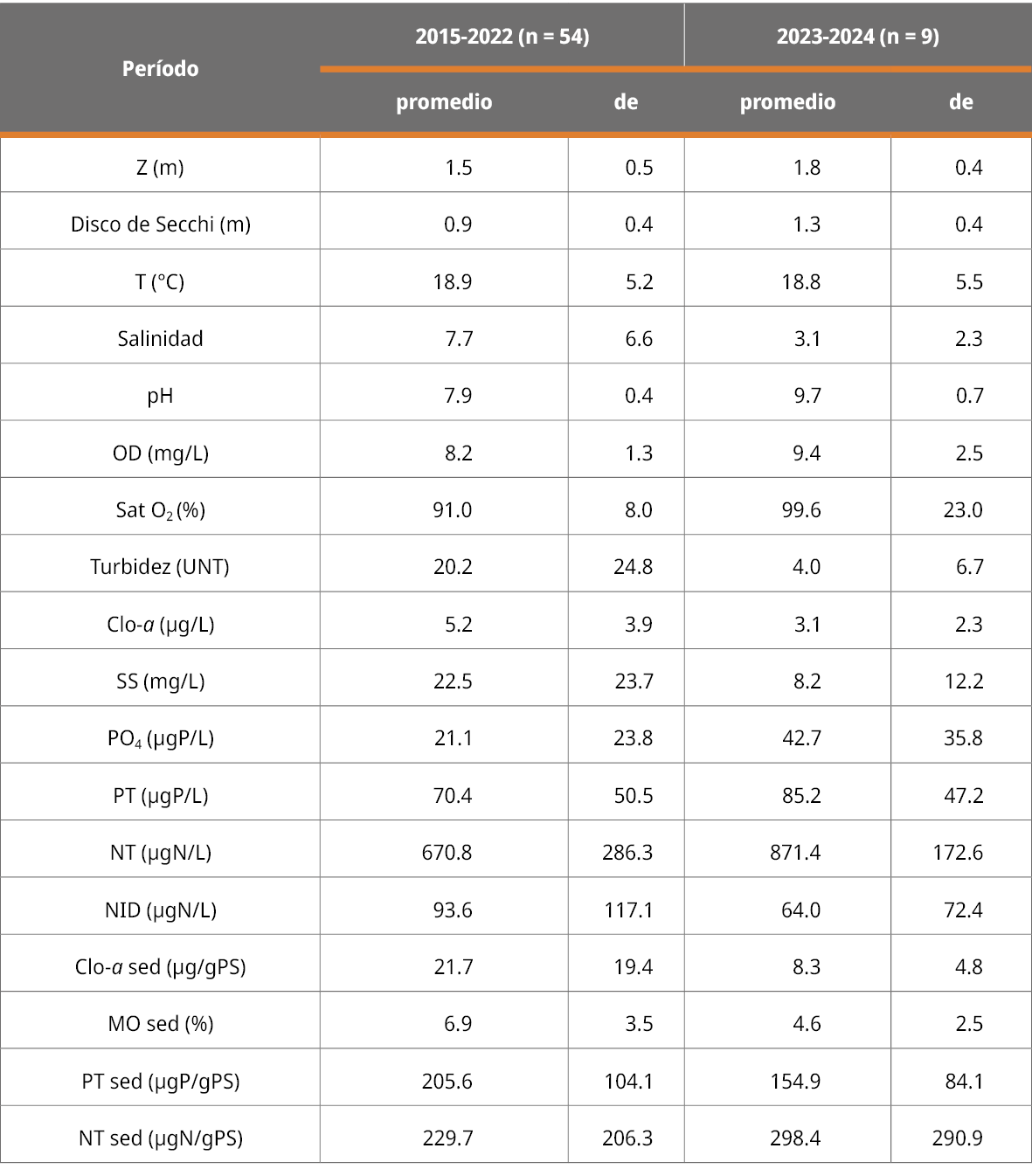
Se observó una tendencia de aumento del fósforo en el agua, especialmente para el fósforo disuelto, aunque menos marcado para el fósforo total. Si bien el nitrógeno total también mostró una tendencia en aumento, el nitrógeno disuelto presentó la tendencia opuesta. A nivel del sedimento el comportamiento de los nutrientes fue el inverso, el fósforo total mostró una disminución mientras que el nitrógeno total mostró un leve aumento, al igual que lo reportado en la proliferación de plantas en la Laguna Blanca (Mazzeo et al., 2003).
Estos resultados muestran la importancia de las plantas sumergidas en la dinámica de los nutrientes del sistema, donde el fósforo reservado en el sedimento se puede mover hacia el tejido de las plantas y de ahí al agua, reduciendo la concentración en el sedimento superficial, pero dejándolo más disponible en la columna de agua. Si bien el nitrógeno también se moviliza entre dichos compartimentos, posiblemente en presencia de macrófitas se favorezcan procesos de fijación de nitrógeno. Por otra parte, la clorofila a en agua y en sedimento se vio reducida comparando el período con y sin plantas.
Mazzeo et al. (2003) y Vianna (2012) no encontraron diferencias significativas en la clorofila a del agua en zonas vegetadas en comparación con zonas no vegetadas, con excepciones en algunos meses. Vanderstukken et al. (2011) describen una serie de interacciones negativas de las plantas sumergidas sobre el fitoplancton en mesocosmos realizados en Uruguay, como ser competencia por nutrientes, alelopatía, reducción de la turbidez, entre otros. Igualmente, esta dinámica debería ser analizada en mayor profundidad.
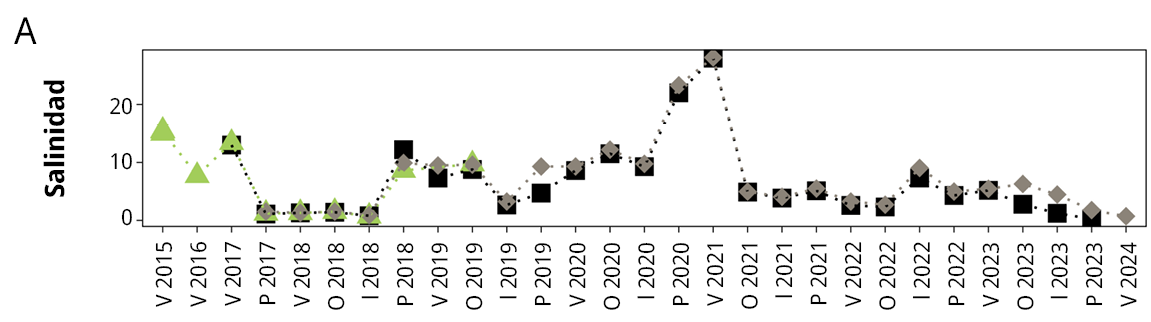
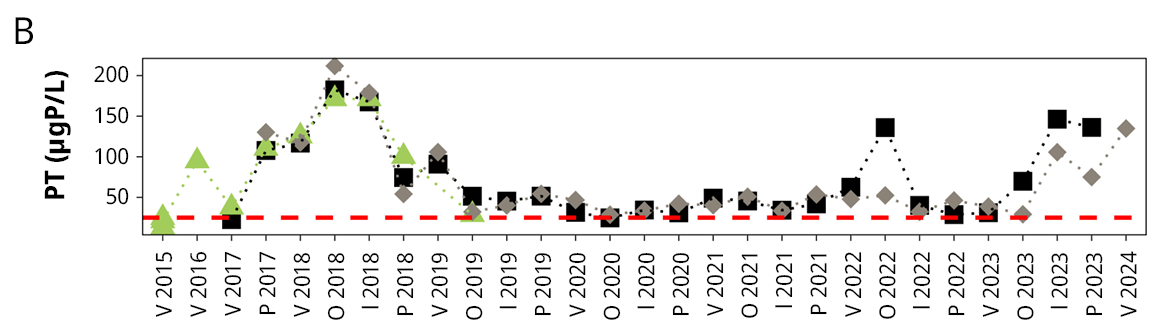
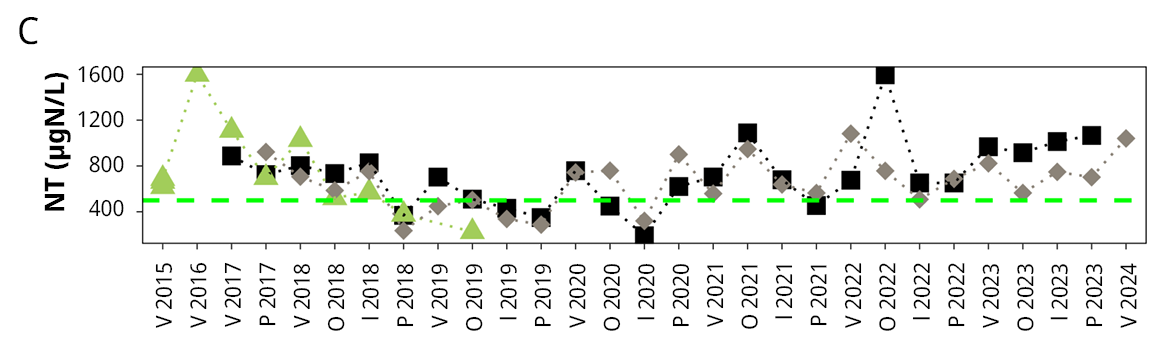
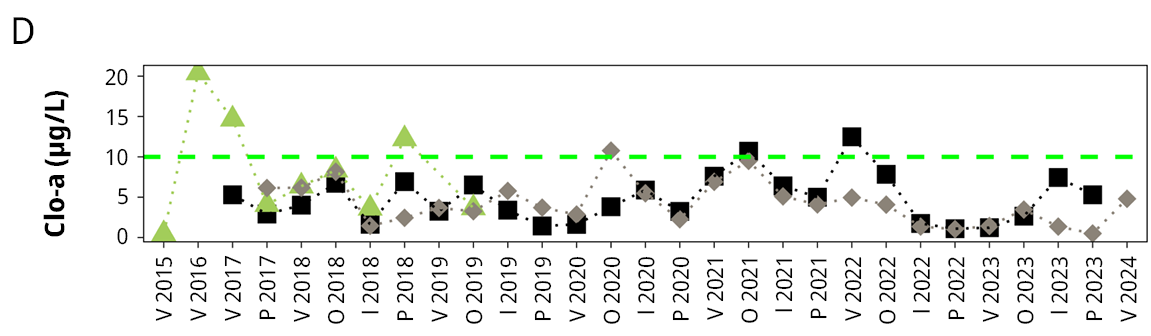
Figura 3. Variación temporal y espacial de: A) salinidad, B) fósforo total (PT), C) nitrógeno total (NT), y D) clorofila a (Clo-a) del agua en el período de monitoreo (de febrero de 2015 a febrero de 2024). La línea punteada roja indica el límite establecido por la clase 3 del Decreto 253/79 (Uruguay, 1979) de calidad del agua. La línea punteada verde indica el valor guía establecido por la Mesa Técnica del Agua (Uruguay. Ministerio de Ambiente, Dirección Nacional de Medio Ambiente, 2017). V: verano, O: otoño, I: invierno, P: primavera.
A lo largo del período muestreado, la comunidad bentónica (2017-2024) en general estuvo dominada por el caracol Heleobia aff. australis, por los poliquetos Heteromastus cf. similis y Nephthys fluviatilis, y en menor medida por el bivalvo Erodona mactroides. Esta composición es típica de comunidades estuarinas de nuestra costa y se ha mantenido muy similar a estudios previos de esta laguna (Meerhoff et al., 2013). Sin embargo, en el período con plantas ocurrieron cambios en la abundancia y composición de los taxa. Se observaron picos de diversidad y abundancia de diversos grupos de crustáceos previamente poco abundantes y de presencia ocasional, como ostrácodos, anfípodos, tanaidáceos e isópodos.
Heleobia aff. australis, ítem dominante del sistema, presentó una marcada disminución en su abundancia, sobre todo en la zona norte, pasando de 4000-6000 ind/m2 a menos de 100 ind/m2 a partir de la primavera de 2023, sumado a la ausencia de registros de H. cf. similis, N. fluviatilis y E. mactroides. A su vez, aparecieron varios taxa no reportados previamente o que aumentaron notoriamente su abundancia relativa, algunos de ellos de sistemas dulceacuícolas y asociados a vegetación acuática, como larvas de quironómidos, ninfas de odonatos, camarones de agua dulce y caracoles dulceacuícolas de género Biomphalaria y Heleobia. Lo mismo ocurrió con la comunidad de fitoplancton que en 2023 presentó organismos más asociados a sistemas típicos de agua dulce, como Volvox sp., Pediastrum spp., Monoraphidium spp., con una gran abundancia de Cryptomonas.
A comienzos de febrero de 2024 (7/2/24 posterior al monitoreo de verano) se detectó la ocurrencia de una floración de cianobacterias en la ensenada del Aº Garzón. El análisis cualitativo de una muestra colectada por los guardaparques del área constató la presencia de varias especies del género Dolichospermum (potencialmente tóxico): D. planctonicum, D. circinalis y D. spiroides, siendo la primera la dominante. Posteriormente, se colectó una muestra del mismo sitio (1/3/2024) para el análisis de toxinas en el Laboratorio de DINACEA (MA). Se registraron concentraciones cuantificables de microcistina LR (4.6 µg/L) y saxitoxina (1.0 µg/L), aunque por debajo de los valores límite recomendados para aguas de recreación, según la Organización Mundial de la Salud (Chorus y Welker, 2021), mientras que fue indetectable la cilindrospermopsina. Cabe mencionar que al momento de la toma de la muestra para toxinas la densidad de la floración había disminuido, correspondiendo al estadio 1 de acuerdo con el monitoreo visual (Uruguay. Ministerio de Ambiente, Dirección Nacional de Calidad y Evaluación Ambiental, 2020).
Por otro lado, se realizó una evaluación de la floración de cianobacterias entre el 06/02/24 y el 07/03/24 a través de imágenes satelitales (Figura 4). Allí se observó que la floración de cianobacterias se ubicó al inicio en la zona norte y de ahí avanzó hacia el centro de la laguna, mientras que la zona sur de la laguna se mantuvo dominada por las plantas sumergidas y sin floración. En febrero (imágenes: 6/02/24 -16/02/24) se estimó para la floración una superficie aproximada de 4.7 km2, lo cual corresponde al 25 % del área de la laguna, aumentando a 32 % (5.7 km2) en el mes de marzo (imagen: 07/03/24). Odebrecht et al. (2005) encontraron en la Laguna de Los Patos que durante una sequía extrema causada por la Niña aumentó la abundancia de cianobacterias debido al reducido aporte de sílice desde la cuenca que habría afectado a las diatomeas, grupo que generalmente predomina en estas lagunas. Es probable que en la Laguna Garzón esté ocurriendo un efecto similar causado por la sucesión de años secos.

Figura 4. Análisis de la floración de cianobacterias en la Laguna Garzón a través de imágenes satelitales, se ordenan por fecha de izquierda a derecha (6/02/24, 16/2/2024, 07/03/2024). El color rosado de la mitad SO dentro de la laguna representa a las plantas sumergidas, mientras que el color verde de la mitad NE dentro de la laguna representa a la floración de cianobacterias.
Efectos del intercambio de agua con el mar
En el período de estudio abarcado, el número de aperturas de la barra de la Laguna Garzón osciló entre una vez (2022) y seis (2018), siendo 2023 el único año en que no tuvo conexión con el mar. En cuanto a la duración de la conexión laguna-mar, se registraron períodos de barra abierta de entre 9 (2018) y 54 días (2019). La frecuencia de apertura y el número total de días de barra abierta es muy variable entre años y también a lo largo del año, pudiendo haber varios meses sin conexión con el océano.
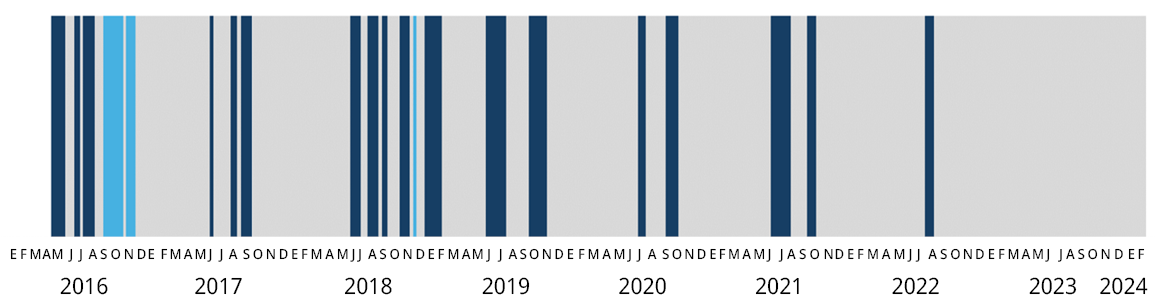
Figura 5. Estado de la barra de la Laguna Garzón desde abril de 2016 hasta marzo de 2024. Gris: estado de barra cerrada, azul oscuro: período de barra abierta (artificialmente), y celeste: período de barra abierta naturalmente.
Actualmente el sistema se encuentra ante el período de barra cerrada más prolongado de la serie de datos. El último evento de apertura culminó en agosto de 2022 y desde entonces se ha mantenido cerrada hasta el presente (30/3/2024), alcanzando un total de 604 días. Previamente se habían registrado otros tres períodos prolongados de barra cerrada: 193 días (primavera 2016- otoño 2017), 255 días (primavera 2017- otoño 2018) y 229 días (primavera 2019 y otoño 2020) (Figura 5).
En general, cuando la barra permaneció cerrada muchos meses la salinidad disminuyó considerablemente, pudiendo permanecer condiciones de agua dulce u oligohalina entre 9 y 18 meses. Esto se observó claramente en los períodos ocurridos desde la primavera de 2017 al invierno de 2018 (0.7 a 1.5) y desde la primavera de 2022 hasta la fecha (0.3 a 6.3). Sin embargo, hubo ocasiones en que la salinidad permaneció muy elevada pese a estar la barra cerrada durante varios meses, lo cual se observó en el período entre primavera de 2020 y el verano de 2021 (22.0 a 28.1). Esto podría deberse a que luego de la descarga de agua e ingreso de agua marina a la laguna la barra se cerró, coincidiendo con el período estival, por lo que la salinidad pudo mantenerse o incluso aumentar debido a la evaporación, situación que se puede prolongar durante largos períodos si la lluvia no es suficiente. Incluso en dicho período se alcanzaron los valores de salinidad más elevados de todo el registro, mostrando que hay algunos intercambios con el océano muy efectivos y que promueven un importante intercambio de masas de agua.
Machado (2022) mostró, mediante modelación hidrodinámica, la relevancia del nivel del mar para el ingreso de agua marina a la Laguna de Rocha, pudiendo ser incluso más importante que la descarga de agua dulce de los ríos y mucho más importante que la intensidad y dirección de los vientos. Esto indicaría que el intercambio efectivo de agua con el mar depende también de la coincidencia de los períodos de barra abierta con eventos de subida del nivel del mar. Asimismo, se observó que las diferencias en salinidad entre la estación de monitoreo sur y norte son mínimas (Figura 3), indicando que la laguna tiene procesos de circulación y mezcla de agua muy importantes que determinan las características del sedimento, del agua y de las comunidades biológicas (Bergamino et al., 2018).
Fue muy notoria la relación inversa entre la salinidad y el fósforo total en el agua (r = -0.72, p < 0.001), donde en los períodos de mayor salinidad el PT fue muy bajo, incluso cercano al límite establecido por la normativa nacional, pero aumentó notoriamente en períodos prolongados de agua dulce (Figura 3). Una relación similar se observó con el nitrógeno total (Figura 3) y en segundo lugar con la clorofila a del agua (Figura 3), aunque con estos dos la relación fue menor y menos significativa (se omite la información estadística). Por su parte, la clorofila a en agua mostró cierta relación con la concentración de nutrientes, ya que si bien estuvo generalmente por debajo del límite guía establecido por la Mesa Técnica del Agua (Uruguay. Ministerio de Ambiente, Dirección Nacional de Medio Ambiente, 2017), los mayores valores coincidieron con valores más elevados de fósforo y/o nitrógeno, y en general en los meses más cálidos.
Comparación del estado de la Laguna Garzón previo a la proliferación de plantas con datos históricos
La comparación entre ambos períodos mostró que el rango de valores de temperatura, pH y conductividad fueron similares (Tabla 2), aunque la salinidad alcanzó valores máximos más elevados en el período 2015-2020. También en ese período la profundidad fue significativamente mayor, mientras que los sólidos suspendidos y la materia orgánica asociada mostraron valores significativamente menores a los datos del período 2002-2006, posiblemente debido a que la mayor profundidad del período actual habría atenuado el efecto del viento en la resuspensión de sedimentos.
Al comparar la concentración de las formas nitrogenadas del periodo 2015-2020 con los datos del 2002-2006, se observó un aumento importante y significativo de los valores medios en todos los casos (Tabla 2). El valor medio de concentración de amonio y nitrito se duplicó, mientras que para el nitrato aumentó casi 6 veces respecto del promedio histórico. Por último, el valor actual de nitrógeno total duplicó el valor histórico.
Además, se observó un aumento importante de los valores medios tanto de fósforo soluble (no significativo) como de fósforo total (significativo), el cual casi se duplicó en 2015-2020. La concentración media de clorofila a en agua en el período 2015-2020 superó el valor recomendado (Uruguay. Ministerio de Ambiente, Dirección Nacional de Medio Ambiente, 2017) en cuatro ocasiones (Figura 3), mientras que en el período histórico (2002-2006) el máximo valor registrado no superó la concentración de 7.9 µg/L.
Tabla 2. Comparación de los indicadores de calidad del agua entre el período de datos históricos (2002-2006) y el período actual (2015-2020). Se presenta la media y el desvío estándar (de). Se indica el valor del estadístico correspondiente y el p valor. ns: no significativo.
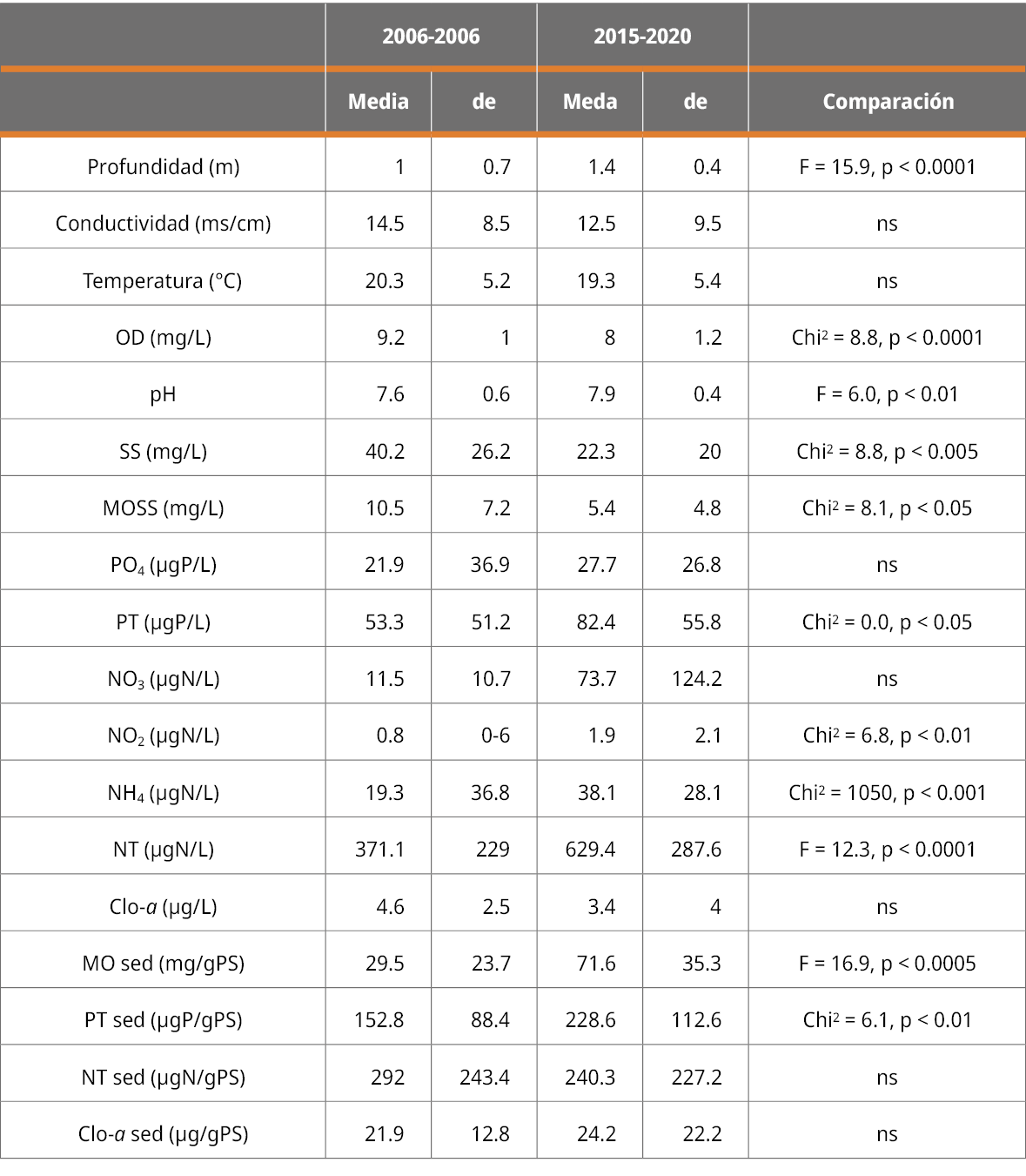
En el sedimento, el valor medio del contenido de materia orgánica se duplicó hacia el período 2015-2020 y el fósforo aumentó, pero en menor medida (Tabla 2). Por el contrario, el nitrógeno y la clorofila a en sedimento presentaron valores medios muy similares entre ambos períodos (Tabla 2), aunque la clorofila a presentó un valor extremo muy elevado en primavera de 2019 que no fue registrado previamente. Posiblemente, los mayores valores de profundidad en el período 2015-2020 atenúen el crecimiento del fitobentos, impidiendo que alcancen valores más elevados pese al aumento de nutrientes.
Estos cambios en las concentraciones de nutrientes dan cuenta del proceso de eutrofización de la laguna, que seguramente generó las condiciones propicias para el crecimiento masivo de plantas sumergidas observado en la actualidad.
Recomendaciones para el manejo
La posibilidad de que pueda ocurrir una mortandad masiva de plantas por diferentes factores es una hipótesis plausible. Incluso, en marzo de 2024 la cobertura de plantas se redujo pese a que en febrero estaban vigorosas y cubrían gran parte de la laguna (observación in situ). Si bien la abundancia de plantas puede reducirse por varios factores endógenos, una de las causas más probables podría ser un aumento en la salinidad del agua una vez que se abre la barra arenosa. Si bien esta especie tolera salinidades intermedias (en torno de 10 a 16 según Rodríguez-Gallego et al., 2015), en esta laguna se reportaron valores más elevados luego de aperturas de la barra (Figura 3 y Uruguay. Ministerio de Ambiente, Dirección Nacional de Calidad y Evaluación Ambiental, et al., 2021). Como consecuencia, existe el riesgo de que se genere una mortandad de plantas y que la carga de nutrientes de sus tejidos quede disponible para el fitoplancton potencialmente nocivo. Por su parte, las cianobacterias tienen baja tolerancia a la salinidad y a su variabilidad (Cabrera et al., 2013), por lo que es posible que el aumento de la salinidad que puede causar la mortandad de plantas podría también inhibir el desarrollo de estas microalgas.
Para que la laguna recupere un estado similar al registrado previo a la proliferación de plantas sumergidas es recomendable la remoción de la mayor cantidad posible de plantas. La forma de lograr esto a escala de toda la laguna, de bajo costo económico y basada en el conocimiento del funcionamiento natural del sistema, sería mediante el manejo de la barra, realizando la apertura artificial con la laguna al máximo nivel de agua posible. Esto podría remover, además de plantas, un gran volumen de agua y sedimentos enriquecidos en nutrientes. Una descarga de este tipo, si es sucedida de un evento de aumento del nivel del mar por tormentas, permitiría el ingreso de agua marina suficiente para elevar la salinidad en toda la laguna, y provocar la mortandad del remanente de plantas, a la vez que inhibir el crecimiento de cianobacterias.
En base a esto, es recomendable que se realice una apertura artificial de la barra en otoño, lo que podría generar un efecto positivo adicional, reduciendo el riesgo de proliferación de cianobacterias por la menor temperatura del agua. Asimismo, la primavera sería una estación muy propicia también, teniendo en cuenta que se encontraron que los incrementos en la salinidad registrados en primavera (estación del año en que los nutrientes disueltos tienden a aumentar) en las lagunas Garzón, Rocha y José Ignacio explicarían la ausencia de cianobacterias en estas lagunas en comparación con la Laguna de Castillos (Uruguay. Ministerio de Ambiente, Dirección Nacional de Calidad y Evaluación Ambiental et al., 2021).
La remoción mecánica de plantas en sitios puntuales podría implementarse como una medida complementaria para mitigar afectaciones a ciertos usos de forma inmediata, por ejemplo, debajo del puente donde las plantas obstruyen en parte la circulación de agua, o en sitios donde afectan algunos usos como el canal de navegación de pescadores, zonas para mejorar la estética paisajística, canchas de kitesurf, entre otros. Sin embargo, considerando la gran superficie afectada por las plantas, el costo de la remoción mecánica en toda la laguna es inabarcable, e incluso generaría otros impactos en el sistema por la circulación de maquinaria en el margen de la laguna. La remoción debe realizarse de manera de evitar que los nutrientes acumulados en las plantas vuelvan al sistema, por ejemplo, depositando las plantas alejadas del cuerpo de agua o evitando que se acumulen por varios días, ya que el lixiviado contiene gran parte del nitrógeno y fósforo reservado en los tejidos (Reddy et al. 1989, 1990). La biomasa removida contribuye a reducir progresivamente la carga de nutrientes del sistema y es un residuo con potencial de uso, para compostaje o como abono fresco (Tucker y DeBusk, 1983).
Debido a que la precipitación es un factor determinante de la dinámica de las lagunas costeras de Uruguay, las condiciones climáticas juegan un rol fundamental, así como las decisiones de manejo basadas en los pronósticos climáticos. El manejo de la barra debería considerar si existen condiciones de año lluvioso o seco (períodos Niño/Niña), que permitan alcanzar niveles de agua en la laguna elevados o mínimos suficientes para que se genere la conexión con el mar. Rodríguez-Gallego et al. (2023) muestran que en la Laguna Garzón los trimestres menos lluviosos tienen mayor nivel del agua, que además se mantiene elevado por más tiempo en comparación con los trimestres que registran mayor precipitación y eventos extremos de alta precipitación en poco tiempo. Esto indicaría que ante un escenario de poca precipitación es posible que el nivel del agua en la Laguna Garzón se mantenga relativamente elevado, pero no alcance los niveles esperados para proceder con la apertura artificial de la barra. Por lo tanto, en escenarios de menor precipitación y dado el aumento del estado trófico de la laguna antes descrito, es recomendable promover intervenciones excepcionales de apertura de la barra a niveles más bajos que el óptimo, que permitan generar un intercambio de agua con el mar y así reducir la biomasa de plantas por el aumento de la salinidad.
Esto está previsto en el protocolo de manejo de la barra propuesto por el SNAP, en proceso de revisión y aprobación por el Ministerio de Ambiente, donde el valor deseado para la apertura de la barra es de 1.9 m, pero a partir de 1.4 m -en caso de crecidas prolongadas y de problemas de calidad del agua- podría ser recomendable realizar aperturas artificiales especialmente ante pronósticos de ascenso del nivel del mar y mayor probabilidad de ingreso de agua marina al sistema. Igualmente, este manejo deberá ser monitoreado y evaluado rigurosamente. Es posible que para restablecer las condiciones previas al desarrollo de las plantas en la laguna se requieran varios ciclos de conexión entre la laguna y el mar, especialmente si no ocurren eventos extremos de lluvia que promuevan intercambios intensos con el océano.
Conclusiones
La proliferación de plantas sumergidas en la Laguna Garzón es un síntoma del proceso de eutrofización. El crecimiento de plantas con una abundancia tan elevada puede deberse a varios factores como las condiciones de alta temperatura del agua, baja salinidad prolongada, profundidad y transparencia adecuadas. Sin embargo, uno de los motivos principales es que existe en el sistema disponibilidad de nutrientes suficiente, principalmente en los sedimentos. En esta laguna se reportó un aumento sustancial de la concentración de nutrientes en agua y sedimento en comparación con datos de la década del 2000, posiblemente vinculado a la construcción del puente, a la intensificación de los usos del suelo en la cuenca y al régimen de manejo de la barra arenosa. Asimismo, las plantas en sí mismas constituyen un reservorio de nutrientes, ya que en sus tejidos acumulan gran cantidad de nitrógeno y fósforo, que por descomposición vuelven a estar disponibles en el sistema y pueden ser fácilmente utilizables por el fitoplancton. Esto podría favorecer el desarrollo de cianobacterias que fueron registradas formando una floración en verano de 2024, por primera vez, en zonas sin plantas acuáticas; las cuales tuvieron toxicidad positiva, aunque aceptable para aguas de recreación.
Asimismo, la proliferación de plantas causó cambios importantes en la comunidad bentónica, tanto en la composición como abundancia, efecto que tendrá que seguir siendo monitoreado para evaluar su alcance a largo plazo en la ecología trófica de la laguna. Los resultados de este trabajo y la evidencia de monitoreo y manejo de las lagunas costeras del país indican que el manejo artificial de la barra de la laguna puede contribuir a mitigar los efectos de la eutrofización si se realiza en condiciones que maximicen el intercambio de agua con el mar.
Agradecimientos
A los guardaparques del área protegida Laguna Garzón y sus vecinos por la colaboración en la obtención de algunas muestras y datos de campo, así como sus aportes de conocimiento local.
Referencias
Abreu, P. C.; Bergesch, M.; Proença, L. A.; Garcia, C. A. E. y Odebrecht, C., 2009. Short- and long-term chlorophyll a variability in the shallow microtidal Patos Lagoon estuary, Southern Brazil. En: Estuaries and Coasts, 33(2), pp. 554–569. DOI: https://doi.org/10.1007/s12237-009-9181-9
Alonso-Paz, E. y Bassagoda, M. J., 2006. Flora y vegetación de la costa platense y atlántica uruguaya. Bases para la conservación y el manejo de la costa uruguaya. En: Menafra, R.; Rodríguez-Gallego, L.; Scarabino, F. y Conde, D., eds. Bases para la conservación y el manejo de la costa uruguaya. Montevideo: Vida Silvestre Uruguay. pp. 71-88.
American Public Health Association, American Water Works Association y Water Environment Federation, 2012. Standard methods for the examination of water and wastewater. 22a ed. Washington: APHA. Standard Method 2540.
Arocena, R., ed., 2016. Principios y métodos de limnología. Montevideo: Universidad de la República. Facultad de Ciencias.
Bendschneider, K. y Robinson, R. J., 1952. A new spectrophotometric method for determination of nitrite in the sea water. En: Journal of Marine Research (11), pp. 87–96.
Bergamino, L.; Rodríguez-Gallego, L.; Pérez-Parada, A.; Chialanza, M. R.; Amaral, V.; Perez, L.; Scarabino, F.; Lescano, C.; García-Sposito, C.; Costa, S.; Lane, C. S.; Tudurí, A.; Venturini, N. y García-Rodríguez, F., 2018. Autochthonous organic carbon contributions to the sedimentary pool: A multi-analytical approach in Laguna Garzón. En: Organic Geochemistry, (125), pp. 55–65. DOI: https://doi.org/10.1016/j.orggeochem.2018.08.015
Bornette, G. y Puijalon, S., 2011. Response of aquatic plants to abiotic factors: a review. En: Aquatic sciences, (73), pp. 1-14. DOI: https://doi.org/10.1007/s00027-010-0162-7
Cabrera, C.; Rodríguez-Gallego, L. y Kruk, C., 2013. Efecto de la salinidad y la concentración de nutrientes en las floraciones de cianobacterias de una laguna costera de Uruguay. En: Cirelli, A. F.; Carrera, A. P. y Volpedo, A., eds. El agua en la producción agropecuaria. II Jornadas Interdisciplinarias Ciclo del Agua en Agroecosistemas. Buenos Aires: Centro de Estudios Transdisciplinarios del Agua de la UBA. pp. 55-71.
Carvalho, V.; Gonzalez, L.; Bueno, C.; Segura, C.; Bottezini, S. R.; Leonhardt, A.; Diniz, D.; Dentzien-Dias, P.; Perez, L.; Evangelista, H.; Licínio, M. V.; Inda, H.; Bergamino, L.; Weschenfelder, J.; Barboza, E. y Garcia-Rodriguez, F., 2024. Holocene organic matter composition in relation to relative sea level stands and associated morphometric changes of a lagoonal system. En: Marine Geology, (469), p. 107-248. DOI: https://doi.org/10.1016/j.margeo.2024.107248
Carpenter, S. R., 2005. Eutrophication of aquatic ecosystems: bistability and soil phosphorus. En: Proceedings of the National Academy of Sciences of the USA, 102 (29), pp. 10002-10005. DOI: http://dx.doi.org/10.1073/pnas.0503959102
Chorus, I. y Welker, M., eds., 2021. Toxic cyanobacteria in water: A guide to their public health consequences, monitoring and management. 2a ed. Boca Ratón: CRC PRESS y World Health Organization.
Conde, D.; Rodríguez-Gallego, L.; de Álava, D.; Chreties, C.; Solari, S.; Verrastro, N.; Piñeiro, G.; Lagos, X.; Teixeira, L.; Vitancurt, J.; Caymaris, H.; Seijo, L. y Panario D., 2019. Ecological and social basis for the development of a sand barrier breaching model in Laguna de Rocha, Uruguay. En: Estuarine, Coastal and Shelf Science, pp. 300-316. DOI: https://doi.org/10.1016/j.ecss.2019.02.003
Conde, D.; Rodríguez-Gallego, L. y Rodríguez-Graña, L., 2003. Análisis conceptual de las interacciones abióticas y biológicas entre el océano y las lagunas de la costa atlántica de Uruguay. PNUD/GEF/RLA/99/G31. Montevideo: UdelaR, Facultad de Ciencias, Sección Limnología. (FREPLATA-Ciencias, 8). ISBN 978-9974-95-147-1.
Esteves, F. A.; Caliman, A.; Santagnelo, J. M.; Guariento, R. D.; Farjalla, V. F. y Bozeli, R. L., 2008. Neotropical coastal lagoons: an appraisal of their biodiversity, functioning, threats and conservation management. En: Brazilian Journal of Biology, 68 (4), pp. 967-981. DOI: https://doi.org/10.1590/S1519-69842008000500006
Hwang, S. J., 2020. Eutrophication and the ecological health risk. En: International Journal of Environmental Research and Public Health, 17(17), pp. 1–6. DOI: https://doi.org/10.3390/ijerph17176332
Heisler, J.; Glibert, P. M.; Burkholder, J. M.; Anderson, D. M.; Cochlan, W.; Dennison, W. C.; Dortch, Q.; Gobler, C. J.; Heil, C. A.; Humphries, E.; Lewitus, A.; Magnien, R.; Marshall, H. G.; Sellner, K.; Stockwell, D. A.; Stoecker, D. K. y Suddleson, M., 2008. Eutrophication and harmful algal blooms: a scientific consensus. En: Harmful Algae, 8(1), pp. 3-13. DOI: https://doi.org/10.1016/j.hal.2008.08.006
Inda, H.; García-Rodríguez, F.; del Puerto, L.; Stutz, S.; Figueira, R. C. L.; de Lima Ferreira, P. A. y Mazzeo, N., 2016. Discriminating between natural and human-induced shifts in a shallow coastal lagoon: a multidisciplinary approach. En: Anthropocene, (16), pp. 1-15. DOI: https://doi.org/10.1016/j.ancene.2016.09.003
Instituto Uruguayo de Meteorología, 2023. Sequía meteorológica en Uruguay 2020-2023. Informe Final. Montevideo: INUMET.
James W.F., J.W. Barko y Butler, M.G., 2004. Shear stress and sediment resuspension in relation to submersed macrophyte biomass. En: Hydrobiologia, (515), pp. 181–191. DOI: https://doi.org/10.1023/B:HYDR.0000027329.67391.c6
Jespersen, A. M. y Christoffersen, K., 1987. Measurements of chlorophyll-a from phytoplankton using ethanol as extraction solvent. En: Archivfur Hydrobiologie, (109), pp. 445–454.
Kjerfve, B., 1994. Coastal lagoons processes. Amsterdam: Elsevier Science Publishers. (Elsevier Oceanography Series, 60).
Koroleff, F., 1970. Direct determination of ammonia in natural waters as indophenol blue. Information on techniques and methods for seawater analysis. En: Interlaboratory Reports, (3), pp. 19–22.
Kruk, C.; Rodríguez-Gallego, L.; Quintans, F.; Lacerot, G.; Scasso, F.; Mazzeo, N.; Meerhoff, M. y Paggi, J.C., 2006. Biodiversidad y calidad de agua de 18 pequeñas lagunas en la costa sureste de Uruguay. En: Menafra, R.; Rodríguez-Gallego, L.; Scarabino, F. y Conde, D., ed. Bases para la conservación y el manejo de la costa uruguaya. Montevideo: Vida Silvestre Uruguay. pp. 599-610.
Kruk, C.; Segura, A.; Nogueira, L.; Carballo, C.; Martínez de la Escalera, G.; Calliari, D.; Ferrari, G.; Simoens, M.; Cea, J.; Alcántara, I.; Vico, P.; Míguez, Di. y Piccini, C. 2015. Herramientas para el monitoreo y sistema de alerta de floraciones de cianobacterias nocivas: Río Uruguay y Río de la Plata. En: INNOTEC, (10), pp. 23-39. DOI: https://doi.org/10.26461/10.02
Lorenzen, C. J., 1967. Determination of chlorophyll and pheopigments: spectrophotometric equations. En: Limnology and Oceanography (12), pp. 343–346. DOI: https://doi.org/10.4319/lo.1967.12.2.0343.
Meerhoff, E.; Rodríguez-Gallego, L.; Giménez, L.; Muniz, P. y Conde, D., 2013. Spatial patterns of macrofaunal community structure in coastal lagoons of Uruguay. En: Marine Ecology Progress Series, (492), pp. 97-110. DOI: https://doi.org/10.3354/meps10472
Meerhoff, M.; Audet, J.; Davidson, T. A.; De Meester, L.; Hilt, S.; Kosten, S.; Zhengwen, L.; Mazzeo, N.; Paerl, H.; Scheffer, M. y Jeppesen, E. 2022. Feedback between climate change and eutrophication: revisiting the allied attack concept and how to strike back. En: Inland Waters, 12(2), pp. 187-204. DOI: https://doi.org/10.1080/20442041.2022.2029317
McAlpine, D. F.; Bishop, G.; Ceska, O.; Moody, M. L. y Ceska, A., 2007. Andean watermilfoil, Myriophyllum quitense (Haloragaceae), in the Saint John River estuary system, New Brunswick, Canada. En: Rhodora, 109(937), pp. 101-107. DOI: https://doi.org/10.3119/0035-4902(2007)109[101:AWMQHI]2.0.CO;2
Machado, I., 2022. Conectividad entre la Laguna de Rocha y la zona marina adyacente: implicancias para el reclutamiento de larvas de peces y decápodos [En línea]. Montevideo: UdelaR, Facultad de Ciencias. (Tesis de doctorado). [Consulta: 6 de abril 2024]. Disponible en: https://www.colibri.udelar.edu.uy/jspui/handle/20.500.12008/35333
Mackereth, F. J. H.; Heron, J. y Talling, J. F., 1978. Water analysis: some revised methods for limnologists. En: The Freshwater Biological Association, (36), pp. 1–120.
Mazzeo, N.; Rodríguez-Gallego, L.; Kruk, C.; Meerhoff, M.; Gorga, J.; Lacerot, G.; Quintans, F.; Loureiro, M.; Larrea, D. y García-Rodríguez, F., 2003. Effects of Egeria densa Planch. beds on a shallow lake without piscivorous fish. En: Hydrobiologia, (506–509), pp. 591-602. DOI: https://doi.org/10.1023/B:HYDR.0000008571.40893.77
McGlathery, K. J., 2001. Macroalgal blooms contribute to the decline of seagrass in nutrient enriched coastal waters. En: Journal of Phycology, (37), pp. 453-456. DOI: https://doi.org/10.1046/j.1529-8817.2001.037004453.x
McSweeney, S. L.; Kennedy, D. M.; Rutherfurd, I. D. y Stout, J. C., 2017. Intermittently Closed/Open Lakes and Lagoons: Their global distribution and boundary conditions. En: Geomorphology, (292), pp. 142-152. DOI: https://doi.org/10.1016/j.geomorph.2017.04.022
Moss, B.; Kosten, S.; Meerhoff, M.; Battarbee, R.; Jeppesen, E.; Mazzeo, N.; Havens, K.; Lacerot, G.; Liu, Z.; De Meester, L. y Paerl, H., 2011. Allied attack: climate change and eutrophication. En: Inland Waters, 1(2), pp.101-105. DOI. https://doi.org/10.5268/IW-1.2.359
Müller, R. y Wiedemann, O., 1955. Die Bestimmung des Nitrat-Ions in Wasser. En: Von Wasser, (22), pp. 247–271.
Murphy, J. y Riley, J. P., 1962. A modified single solution method for the determination of phosphate in natural waters. En: Analytica Chimica Acta, (27), pp. 31-36. DOI: http://dx.doi.org/10.1016/S0003-2670(00)88444-5
National Academy of Sciences, 1969. Eutrophication: causes, consequences, correctives. Washington D.C.: NAS.
Nichols, D. S. y Keeney, D. R., 1976. Nitrogen nutrition of Myriophyllum spicatum: uptake and translocation of 15N by shoots and roots. En: Freshwater Biology, 6(2), pp. 145-154.
Odebrecht, C.; Abreu, P. C.; Möller, O. O.; Niencheski, L. F.; Proença, L. A. y Torgan, L. C., 2005. Drought effects on pelagic properties in the shallow and turbid Patos Lagoon, Brazil. En: Estuaries, 28(5), pp. 675–685. DOI: https://doi.org/10.1007/BF02732906
Odebrecht, C.; Abreu, P. C.; Bemvenuti, C. E.; Copertino, M.; Muelbert, J. H.; Vieira, J. P. y Seeliger, U., 2008. The Patos Lagoon Estuary. Biotic responses to natural and anthropogenic impacts in the last decades (1979 – 2008). En: Coastal Lagoons; Critical Habitats of Environmental Change, pp. 437–460.
O’Neil, J. M.; Davis, T. W.; Burford, M. A. y Gobler, C. J., 2012. The rise of harmful cyanobacteria blooms: The potential roles of eutrophication and climate change. En: Harmful Algae, (14), pp. 313-334.
Orchard, A. E., 1981. A revision of South American Myriophyllum (Haloragaceae), and its repercussions on some Australian and North American species. En: Brunonia, (4), pp. 27–65.
Pérez-Ruzafa, A.; Campillo, S.; Fernández-Palacios, J. M.; García-Lacunza, A.; García-Oliva, M.; Ibáñez, H.; Navarro-Martínez, P. C.; Pérez-Marcos, M.; Pérez-Ruzafa, I. M.; Quispe-Becerra, J. I.; Sala-Mirete, A.; Sánchez, O. y Marcos, C., 2019. Long-term dynamic in nutrients, chlorophyll a, and water quality parameters in a coastal lagoon during a process of eutrophication for decades, a sudden break and a relatively rapid recovery. En: Frontiers in Marine Science, (6), p. 26. DOI: https://doi.org/10.3389/fmars.2019.00026
Quinlan, R.; Filazzola, A.; Mahdiyan, O.; Shuvo, A.; Blagrave, K.; Ewins, C.; Moslenko, L.; Gray. D. K.; O’Reilly, C. M. y Sharma, S., 2020. Relationships of total phosphorus and chlorophyll in lakes worldwide. En: Limnology and Oceanography, (999), pp. 1-13. DOI: https://doi.org/10.1002/lno.11611
R Development Core Team, 2012. R: A language and environment for statistical computing [En línea]. Versión 2.15.1. Viena: R FoundationforStatistical Computing. [Consulta: 8 de marzo de 2022]. Disponible en: http://www.project.org/index.html
Reddy, K. R.; Agami, M. y Tucker, J. C., 1998. Influence of nitrogen supply rates on growth and nutrient storage by water hyacinth (Eichhornia crassipes) plants. En: Aquatic Botany, (36), pp. 33-43.
Reddy, K. R.; Agami, M. y Tucker, J. C., 1990. Influence of phosphorus on growth and nutrient storage by water hyacinth (Eichhornia crassipes (Mart.) Solms) plants. En: Aquatic Botany, (37), pp. 355-365.
Rodríguez-Gallego, L.; Meerhoff, E.; Clemente, J. M. y Conde, D., 2010. Can ephemeral proliferations of submerged macrophytes influence zoobenthos and water quality in coastal lagoons? En: Hydrobiologia, (646), pp. 253–269. DOI: https://doi.org/10.1007/s10750-010-0185-z
Rodríguez-Gallego, L.; Masciadri, S. y Nin, M., 2012. Modern vegetation and pollen analogs in four southwestern atlantic coastal lagoons. En: Estuaries and Coasts, (35), pp. 785–798. DOI: https://doi.org/10.1007/s12237-012-9476-0
Rodríguez-Gallego, L.; Sabaj, V.; Masciardi, S.; Kruk, C.; Arocena, R. y Conde, D., 2015. Salinity as a major driver for submerged aquatic vegetation in coastal lagoons: a multi-year analysis in the subtropical Laguna de Rocha. En: Estuaries and Coasts, (38), pp. 451–465. DOI: https://doi.org/10.1007/s12237-014-9842-1
Rodríguez-Gallego, L.; Achkar, M.; Defeo, O.; Vidal, L.; Meerhoff E y Conde, D., 2017. Effects of land use changes on eutrophication indicators in five coastal lagoons of the Southwestern Atlantic Ocean. En: Estuarine, Coastal and Shelf Science, (188), pp. 116-126. DOI: https://doi.org/10.1016/j.ecss.2017.02.010
Rodríguez-Gallego, L.; Gallego, F.; Mai, P.; Chreties, Ch.; Pollero, A.; Morales, S. y Narbondo, S., 2023. Caracterización Ecológica de la planicie de inundación de la Laguna Garzón. En: Rodríguez-Gallego, L. y Bergamino, L., eds. Producto 3 (final) del Convenio de cooperación técnica y científica para la ejecución de actividades de capacitación e investigación. Rocha: CURE-UDELAR. pp. 83.
Santana, O. y Fabiano, G., 1999. Medidas y mecanismos de administración de los recursos de las lagunas costeras del Litoral Atlántico del Uruguay. Montevideo: INAPE-PNUD.
Scheffer, M.; Carpenter, S.; Foley, J. A.; Folke, C. y Walker, B., 2001. Catastrophic shifts in ecosystems. En: Nature, 413(6856), pp. 591-596.
Schmitt, M. R. y Adams M. S., 1981. Dependence of rates of apparent photosynthesis on tissue phosphorus concentrations in Myriophyllum spicatum L. En: Aquat. Bot., (11), pp. 379-387. DOI: https://doi.org/10.1016/0304-3770(81)90071-1
Segura, A. M.; Piccini, C.; Nogueira, L.; Alcántara, I.; Calliari, D. y Kruk, C., 2017. Increased sampled volume improves Microcystis aeruginosa complex (MAC) colonies detection and prediction using Random Forests. En: Ecological Indicators, (79), pp. 347–354. DOI: https://doi.org/10.1016/j.ecolind.2017.04.047
Tucker, C. S. y DeBusk, T. A., 1983. Seasonal variation in the nitrate content of water hyacinth (Eichhornia crassipes (Mart.) Solms). En: Aquatic Botany, (15), pp. 419-422.
Uruguay. Decreto 341/014, de 21 de noviembre de 2014. Diario Oficial [En línea], 21 de noviembre de 2014, [Consulta: 27 de abril de 2024]. Disponible en: https://www.impo.com.uy/bases/decretos/341-2014.
Uruguay. Decreto 253/979, de 9 de mayo de 1979. Diario Oficial [En línea], 31 de mayo de 1979, [Consulta: 27 de abril de 2024]. Disponible en: https://www.impo.com.uy/bases/decretos/253-1979.
Uruguay. Ministerio de Ambiente, Dirección Nacional de Calidad y Evaluación Ambiental, 2020. Protocolo de monitoreo visual [En línea]. Montevideo: Ministerio de Ambiente. [Consulta: 27 de abril de 2024]. Disponible en: https://www.ambiente.gub.uy/oan/documentos/DCA-PROTOCOLO-MONITOREO-VISUAL-CIANOBACTERIAS-PLAYAS_2020.pdf
Uruguay. Ministerio de Ambiente, Dirección Nacional de Medio Ambiente, 2017. Mesa técnica del agua. Informe de asesoría. Establecimiento de niveles guía de indicadores de estado trófico en cuerpos de agua superficiales. Montevideo: DINAMA. (Documento Nº 1).
Uruguay. Ministerio de Ambiente, Dirección Nacional de Calidad y Evaluación Ambiental, Dirección Nacional de Recursos Acuáticos; Obras Sanitarias del Estado; Intendencia Departamental de Rocha; Centro Universitario Regional Este, 2021. Evaluación Ambiental de las Lagunas Costeras (José Ignacio, Garzón, Rocha y Castillos) y de sus principales tributarios (2017 - 2020). Montevideo: Ministerio de Ambiente.
United States Department of Agriculture, Natural Resources Conservation Service, 2014. Soil survey filed and laboratory method manual. Soil survey investigations report No 51 Version 2.0. Washington: USDA.
Valderrama, J. C., 1981. The simultaneous analysis of total nitrogen and total phosphorus in natural waters. En: Marine Chemistry, (10), pp. 109-122. DOI: http://dx.doi.org/10.1016/0304-4203(81)90027-X
Vanderstukken, M.; Mazzeo, N.; Van Colen, W.; Declerck, S. A. y Muylaert, K., 2011. Biological control of phytoplankton by the subtropical submerged macrophytes Egeria densa and Potamogeton illinoensis: a mesocosm study. En: Freshwater Biology, 56(9), pp. 1837-1849. DOI: https://doi.org/10.1111/j.1365-2427.2011.02624.x
Vianna Boggiani, M., 2012. Efecto de las macrófitas sumergidas Myriophyllum quitense y Potamogeton illinoensis en la estructura de la comunidad de macroinvertebrados bentónicos en un reservorio somero. Laguna del Diario, Maldonado-Uruguay. Montevideo: UdelaR, Facultad de Ciencias. [Consulta: 6 de abril de 2024]. Disponible en: https://www.colibri.udelar.edu.uy/jspui/handle/20.500.12008/1503
Zar, J. H., 1999. Biostatistical analysis. New Jersey: Prentice Hall.
Zweig, C. L.; Burgess, M. A.; Percival, H. F. y Kitchens, W. M., 2015. Use of Unmanned aircraft to delineate fine-scale wetland vegetation communities. En: Wetlands, (35), pp. 303-309. DOI: https://doi.org/10.1007/s13157-014-0612-4


