La declinación de anfibios constituye una preocupación actual, siendo la presencia de especies exóticas invasoras (EEI) una de las principales amenazas a la biodiversidad. En Uruguay, una de las EEI que afecta la biodiversidad autóctona es el anuro exótico invasor Aquarana catesbeiana (rana toro), invadiendo más de 60 charcos en tres localidades. El presente trabajo propone el análisis de la viabilidad del control biológico de larvas de rana toro mediante el uso del pez nativo Rhamdia quelen (bagre negro). Se realizó un ensayo de depredación en laboratorio para evaluar si consume las larvas de la especie exótica invasora rana toro y de la rana nativa Leptodactylus luctator. Los renacuajos en los estadios 24-26 (utilizando el criterio de Gosner) de ambas especies se expusieron a depredación directa y se determinó el número de larvas que consumió cada ejemplar de R. quelen. Cada pez depredó significativamente sobre ambas especies; sin embargo, la intensidad fue menor en las larvas exóticas (5 %) que en nativas (70 %). La introducción de especies de peces autóctonos para el control biológico constituye una oportunidad en cuerpos de agua permanentes donde A. catesbeiana se encuentra bien establecida. En una etapa inicial del proceso de invasión donde hay presencia de otras especies nativas de anfibios, R. quelen no serviría para biocontrol ya que eliminaría a las larvas de la especie nativa, favoreciendo a la rana toro.
Palabras clave: Aquarana catesbeiana, invasión biológica, biomanipulación.
O declínio dos anfíbios é uma preocupação atual, sendo a presença de espécies exóticas invasoras (EEI) uma das principais ameaças à biodiversidade. No Uruguai, uma das EEI que afeta a biodiversidade nativa é o anuro exótico invasor Aquarana catesbeiana (rã-touro), invadindo mais de 60 lagoas em três localidades. O presente trabalho propõe a análise da viabilidade do controle biológico de larvas de rã-touro, através da utilização do peixe nativo Rhamdia quelen (bagre preto). Um ensaio de predação em laboratório foi realizado para avaliar se ele consome larvas da especie rã-touro exotica invasora e da rã nativa Leptodactylus lucctator. Girinos nos estágios 24-26 (usando o critério de Gosner) de ambas as espécies foram expostos à predação direta e o número de larvas consumidas por cada espécime de R. quelen foi determinado. Cada peixe predava significativamente ambas as espécies; no entanto, a intensidade foi menor nas larvas exóticas (5 %) do que nas larvas nativas (70 %). A introdução de espécies de peixes nativas para controle biológico constitui uma oportunidade em corpos d’água permanentes onde A. catesbeiana está bem estabelecida. Numa fase inicial do processo de invasão onde há presença de outras espécies nativas de anfíbios, R. quelen não serviria para biocontrole, pois eliminaria as larvas das espécies nativas, favorecendo a rã-touro.
Palavras-chave: Aquarana catesbeiana, invasão biológica, biomanipulação.
Introducción
Los anfibios ocupan un importante rol en los ecosistemas acuáticos y terrestres como depredadores y presas, actuando como un enlace crítico entre los niveles tróficos más bajos y altos de una comunidad (Brühl al., 2013). Constituyen uno de los grupos zoológicos más diversos y amenazados a nivel global; estudios recientes han concluido que casi un tercio de las especies conocidas están amenazadas de extinción y varias ya se han extinguido (Stuart et al, 2004; de Sá, R. O. 2005; Sodhi et al., 2008; Carreira y Maneyro, 2015; González, 2019). Este fenómeno se ha denominado declinación global de las poblaciones de anfibios (Alford y Richards, 1999; Maneyro y Langone, 2001), donde la introducción de especies exóticas es un factor de riesgo muy significativo para los anfibios autóctonos (Hoffmann et al., 2010; Capdevila et al., 2013).
Las bioinvasiones son uno de los cinco impulsores directos del cambio global (Roy et al. 2024), y presentan consecuencias económicas y ecológicas negativas, representando una seria amenaza a la biodiversidad (Mack et al., 2000). El número de especies exóticas invasoras (EEI) ha aumentado un 70 % desde la década de 1970 (Pagad et al., 2015), y sus impactos sobre la biodiversidad se están acelerando y seguirán aumentando en el futuro (Pyšek et al., 2020).
En Uruguay se reconocen 48 especies nativas de anfibios, donde un 25 % se encuentra amenazada o en riesgo de extinción (Maneyro et al., 2005; Carreira y Maneyro, 2015, 2019). A estos 48 anuros nativos se suma la presencia de una EEI: Aquarana catesbeiana (Maneyro et al., 2005; Laufer et al., 2008, 2009; Ruibal y Laufer, 2012). La rana toro se introdujo en 1986 en Uruguay por el Estado como una producción alternativa para consumo humano, llegando a instalarse 23 criaderos en 11 departamentos del país (Mazzoni y Carnevia, 1996; Uruguay. Instituto Nacional de Investigación Agropecuaria, 2000; Uruguay. Gobierno de Canelones, 2018; Uruguay. Ministerio de Ganadería, Agricultura y Pesca, 2008). La producción no prosperó por motivos económicos, por lo que se cerraron los criaderos, dejando en abandono los ejemplares en cautiverio debido a la ausencia de un protocolo de cierre de los mencionados sistemas productivos. Desde el año 2005 se reportan poblaciones asilvestradas en la naturaleza próximas a los antiguos ranarios (Maneyro et al., 2005; Laufer et al., 2009; Laufer y Gobel, 2017; Iturburu, 2018; Iturburu y Mello, 2022; Laufer et al., 2018, 2023; Iturburu et al., 2024).
A nivel global, esta especie es considerada como una de las 100 EEI más dañinas (Lowe et al., 2000) y como uno de los factores de pérdida de la diversidad de anfibios (Aguilar, 2012). Esta especie presenta un amplio espectro de alimentación compuesto por insectos y crustáceos (Morales, 2021; Hirai, 2004), peces (Gobel, 2013; Mueller et al., 2006), tortugas (Hirai, 2003), aves (López-Flores et al., 2003), serpientes (McAlpine y Dilworth, 1989), mamíferos (Bissattini et al., 2019), murciélagos (Kirkpatric, 1982) y anfibios (Pearl et al., 2004), donde se evidenció canibalismo (Leivas et al., 2012), depredando cualquier organismo de un tamaño menor al tamaño de la boca (Adriaens, et al., 2019). Estudios previos analizaron la alimentación de la rana toro en ambientes acuáticos de Uruguay (Laufer et al., 2021, 2023; Gobel, 2013) y la región (Cordovez et al., 2021). Sin embargo, aún no se conoce el rol de esta especie como presa de otros grupos, mecanismo que podría ser utilizado como control biológico (Louette, 2012). En particular, los peces son reconocidos como un grupo que puede impactar sobre los anfibios por su capacidad de depredación directa de huevos y larvas (Petranka, 1983). Entre las medidas documentadas para mitigar el impacto de esta EEI se señala que el control efectivo requiere abordar la especie en todas las etapas de desarrollo de forma simultánea.
La restauración del hábitat, la biomanipulación y la introducción de depredadores nativos podría ser una opción para mitigar el impacto de la presencia de la rana toro, donde la idoneidad de los sitios de reproducción disminuye (Adriaens et al., 2019). En Uruguay se han implementado acciones para erradicar la rana toro en charcos invadidos por parte de las instituciones oficiales encargadas de la conservación de la biodiversidad, aplicando métodos de control recomendados a nivel internacional (Iturburu et al., 2024), aunque los mismos no incluyen el control biológico como alternativa.
Los peces desempeñan un papel clave en la determinación de la composición de las comunidades de anfibios en ambientes de aguas permanentes, donde depredan más que en ambientes temporales (Woodward, 1983). Las presas y depredadores utilizados en el presente ensayo de laboratorio habitan cuerpos de aguas permanentes como los invadidos por la rana toro en Canelones (Maneyro y Carreira, 2012; Teixeira de Mello et al., 2011). Rhamdia quelen (bagre negro) es una especie nativa de pez Siluriforme, con hábitos omnívoros y amplia distribución en lagunas, arroyos y ríos del país, donde las ranas nativas también podrían ser presas potenciales de esta especie. Su talla muestra un tamaño de moderado a grande (hasta 47 cm), presentando una boca ancha con pequeños dientes que podrían favorecer la muerte o el consumo de las larvas de rana toro; que pueden llegar a un largo de 13 a 18 cm (Vaz Ferreira, 1969, Gomes et al., 2000; Gomiero et al., 2007). Si bien existe poca información sobre la alimentación del bagre negro en ambientes naturales, se produce en Uruguay para su siembra y cultivo, por lo que la hace factible de ser aplicada en diferentes ambientes acuáticos y utilizada como control biológico sobre larvas de una especie invasora, como lo es la rana toro.
El objetivo de este trabajo fue evaluar la depredación de larvas de la especie exótica invasora rana toro (Aquarana catesbeiana) y del anfibio nativo rana criolla (Leptodactylus luctator) por el pez Rhamdia quelen (bagre negro). Se determinó el potencial uso de esta especie de pez como control biológico para incorporarlo a la gestión de la bioinvasión de la rana toro.
Materiales y Métodos
Organismos utilizados
Predador: especie autóctona de pez Rhamdia quelen (Quoy y Gaimard, 1824) (bagre negro) (Figura 1A). Se alimenta principalmente de otros peces, caracoles, cangrejos e invertebrados acuáticos en general (Winemiller, 1989) y de juveniles de zooplancton y zoobentos. A medida que crece incluye peces de mayor tamaño en su dieta. Preferentemente de hábitos nocturnos (Gomes et al., 2000; Gomiero, 2007), tolera un amplio rango de temperaturas (entre 7 y 33 ℃), si bien su óptimo crecimiento lo realiza entre 15 y 23 ℃ (Lermen et al., 2004). La desventaja es su alta diversidad genética y posible presencia de especies crípticas (Ríos, 2018; Ríos et al., 2016); para introducir individuos en un nuevo ambiente se recomienda tener en cuenta el origen geográfico, no traslocando ejemplares de distintas cuencas hidrográficas como medida de precaución (Zarucki et al., 2021).
Presas: larvas de anfibios utilizadas. Leptodactylus luctator (Hudson, 1892), perteneciente a la familia Leptodactylidae, habita zonas templadas y cálidas de Sudamérica. Se usó dicha especie debido a que: 1) puede constituir una presa potencial por su amplia distribución en Uruguay (Maneyro y Langone, 2001); 2) es un anfibio grande y al igual que la rana toro presenta una longitud >10 cm entre hocico y cloaca (Frost, 2024); 3) durante las pruebas preliminares las larvas fueron aceptadas como presas.
La especie Aquarana catesbeiana (Shaw, 1802), originaria de Norteamérica, es de la familia Ranidae, y presenta una longitud hocico-cloaca de 10 a 20 cm, y entre 60 y 900 gr de peso. Las larvas son muy grandes y permanecen hasta 2 años en la metamorfosis (Figura 1B y 1C).

Figura 1. Organismos utilizados para el ensayo. Depredadores, A: peces autóctonos de bagre negro (Rhamdia quelen) y presas: B: larva de rana criolla (Leptodactylus luctator) y C: larva de rana toro (Aquarana catesbeiana).
Preparación y duración del ensayo de laboratorio
Colecta y acondicionamiento de animales: en mayo de 2022 se obtuvieron decenas de larvas de L. luctator a partir de desove artificial en el Laboratorio de vertebrados de la Facultad de Ciencias de la Universidad de la República (Udelar) (Maneyro, 2019). Las larvas se acondicionaron y mantuvieron en acuarios de 30 L, con una mezcla de agua del tajamar filtrada, y otra parte de la canilla declorada (aireada) que se dejó reposar un día. Para la colecta de anfibios se contó con el permiso de la Dirección Nacional de Medio Ambiente (actual Dirección de Biodiversidad y Servicios Ecosistémicos del Ministerio de Ambiente) otorgado en el marco del Plan de erradicación de la rana toro, Canelones, Uruguay (Uruguay. Gobierno de Canelones, 2018). Se realizó de acuerdo con el Protocolo Nº 1470 de colecta, experimentación y eutanasia para peces y anfibios (expediente 240012-000021-22) aprobado por la Comisión de Ética en el Uso de Animales (Facultad de Ciencias, Udelar). Además, durante dicho mes se colectaron larvas de rana toro en tajamares invadidos en la localidad de Los Cerrillos (Iturburu et al., 2024), mediante redes de arrastre de 12 mm de tamaño de malla, 72 horas antes del inicio de los ensayos.
Las larvas se trasladaron y acondicionaron en acuarios de 30 L en el laboratorio de experimentación animal de la Facultad de Ciencias para su análisis. Se colocaron 15 juveniles de R. quelen en contenedores plásticos de 40 L (120 x 60 x 40 cm) con agua declorada y aireación durante el experimento (Figura 1). Los peces se obtuvieron de un criadero habilitado por la Dirección Nacional de Recursos Acuáticos, del Ministerio de Ganadería, Agricultura y Pesca. La temperatura del aire del laboratorio se determinó mediante un Termómetro portátil TagTemp (novus) con registros cada 10 minutos; diariamente se determinaron los parámetros de calidad del agua mediante un multiparámetro Horiba (temperatura, conductividad, oxígeno disuelto y pH) en todos los acuarios utilizados (15) (Breijo y Domínguez, 2019).
Medición, y peso de presas y depredadores: previo al ensayo y en ambas especies de larvas se determinó la longitud (distancia hocico-base del tubo proctodeal) mediante una regla con una precisión de 0,1 cm y el peso de las larvas en una balanza (precisión 0,0001 g), al inicio y al final del experimento. Para ambas especies se utilizó el estadio pro-metamorfosis G1 (estadios 24-26), de acuerdo con la tabla de desarrollo normal de Gosner (1960), seleccionando larvas de igual talla y peso.
Experimentos de depredación
Las pruebas de depredación y selección de la presa se realizaron en forma simultánea, considerando un depredador por acuario. Las larvas de las dos especies se expusieron en forma simultánea a depredación por parte del bagre negro y se determinó el número de larvas consumidas por cada depredador en relación con el total de larvas ofertadas (Jara y Perotti, 2006), considerando un total de 15 acuarios (réplicas). El experimento de selección de presa y depredación registró 13 días de duración, con un período previo de 3 días de aclimatación sin alimentación y 10 días de ensayo. Se mantuvo un pez por acuario en las 15 réplicas consideradas. Día por medio se le ofrecieron dos larvas (una nativa y otra exótica) en forma simultánea a cada pez, y se registró el número de larvas consumidas; igualmente se revisaron los acuarios para reemplazar los animales no consumidos, muertos o restos, que fueron retirados y reemplazados por otras dos larvas. Al final de cada prueba, se registró si alguna de las larvas había sido consumida o rechazada. Se eliminaron los peces que murieron durante el experimento (n = 3) y se obtuvieron los resultados de 12 ejemplares durante los diez días de ensayo.
Análisis de datos
Se presentan los valores promedio ± desvío estándar de los parámetros abióticos (aire y agua) determinados y las variables morfométricas (largo, peso) de las larvas y peces utilizados durante el experimento. En la descripción de los resultados del ensayo se utilizan frecuencias absolutas y en porcentaje. La hipótesis nula que se evaluó en este trabajo fue que el pez R. quelen no presenta una preferencia por alguna de las especies presa ofrecidas, por tanto, consumirá con igual frecuencia larvas exóticas y nativas. Dado que la respuesta de consumo es binaria (si o no come) y se ofrecen dos tipos de presas simultáneamente al mismo conjunto de preces, las proporciones de consumo no son independientes y para su comparación se aplicó el test de McNemar (X2M) con su corrección por continuidad (Everitt, 1992). El análisis estadístico se realizó utilizando el programa Stata 18.0 y se consideró significativo el valor p menor o igual a 0,05.
Resultados
Las condiciones ambientales y la alimentación fueron constantes durante todo el experimento. Durante el ensayo la temperatura del laboratorio mostró un promedio de 17,7 ℃ (±2, n = 1725), mientras que los parámetros fisicoquímicos del agua (total de parámetros n = 60) presentaron valores promedio de temperatura 17,1 (±0,9) ℃, pH 7,7 (±0,2), conductividad 444,6 (±13) μS cm-1 y oxígeno disuelto 9,5 (±0,9) mgL-1. Las larvas de L. lucatur presentaron un peso promedio de 0,34 ± 0,09 gr, mientras que para A. catesbeiana correspondieron a 0,74 ± 0,18 gr. El largo total (lt) de las larvas (n = 120), considerando la distancia hocico-base del tubo proctodeal, mostró un rango de 10 a 20 mm. Los peces (12) de R. quelen presentaron un largo promedio de 21,0 (±2,6) cm y un peso inicial promedio 91,6 (±43,3) gr.
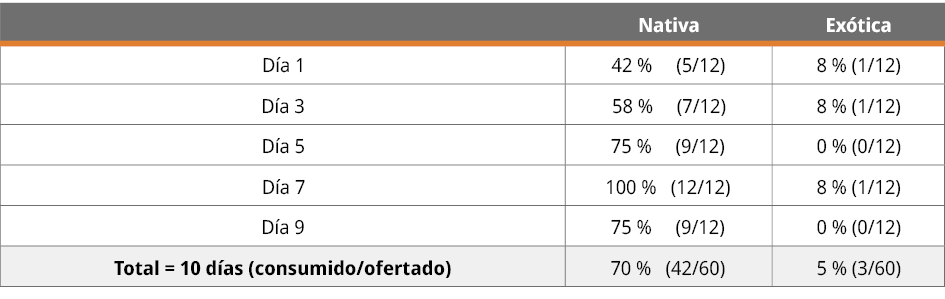
Se constató que las larvas de ambas especies (L. luctator y A. catesbeiana) fueron depredadas por R. quelen (bagre negro), aunque la intensidad fue menor en las larvas exóticas y a medida que transcurrió el tiempo del experimento. Se ofertaron 120 larvas (60 nativas y 60 exóticas) a 12 ejemplares de R. quelen. Consumieron el 37,5 % (n = 45) de las ofertadas, con una preferencia (n = 42) de larvas de rana criolla (L. luctator) frente a (n = 3) de larvas de rana toro (A. catesbeiana) (Tabla 1). De acuerdo con el test realizado, se observó una preferencia estadísticamente significativa por el consumo de la especie nativa, X2M = 35,22; valor-p < 0,0001 (Tabla 1).
Tabla 1. Distribución del consumo de larvas por día de alimentación, indicando frecuencia absoluta y porcentaje.
Discusión
El ensayo de laboratorio realizado reflejó que R. quelen depredó un mayor porcentaje de los primeros estadios de larvas de especies de anuros nativos (70 %) que exóticos (5 %). Diversos estudios indican que los depredadores alteran sus preferencias de presa cuando cambia la disponibilidad de alimentos o forrajeo óptimo (Stephens y Krebs, 1986); además, las presas pueden alterar su comportamiento ante el aumento de depredadores (Sih 1987; Lima y Dill, 1990). Igualmente, los cambios en las condiciones ambientales provocan cambios en el comportamiento de los predadores y presas (Ives y Dobson, 1987; Robinson y Wilson, 1998). En el presente estudio se mantuvieron estables las condiciones ambientales, se utilizaron los mismos peces durante los 13 días (10+3 aclimatación) del ensayo y el suministro de alimento fue constante.
Mecanismos de larvas de anfibios contra la depredación
Los anfibios han desarrollado diferentes estrategias para protegerse de los depredadores. Por lo general, la primera defensa es permanecer inmóviles y pasar desapercibidos; por eso muchos presentan una coloración de camuflaje que los confunde. Si este mecanismo falla, utilizan los saltos de escape (rápidos y ágiles). Por otro lado, en algunas ranas, la presencia de sustancias tóxicas en la piel les permite disuadir a los depredadores (Moreno et al., 2020). Un mecanismo de protección contra la depredación desarrollado por las larvas de los anfibios es el sabor desagradable (Peterson y Blaustein, 1991; Stebbins y Cohen, 1995). Los anfibios con dietas especializadas como, por ejemplo, el sapito oval (Elachistocleis bicolor) y el sapito de jardín (Rhinella dorbignyi) (Achaval y Olmos, 1997), se exponen más a sus depredadores que los de dietas generalistas (como es el caso de la rana toro) durante la búsqueda de alimento, teniendo como principal estrategia la defensa química (Achaval y Olmos, 1997; Maneyro y Carreira, 2006).
Las larvas de A. catesbeiana en sus diferentes estadios de desarrollo se catalogan como desagradables (Kats et al., 1988; Werner y McPeek, 1994), ya que los renacuajos no son apetecibles para su consumo por peces (Szuroczki y Richardson, 2011). Esto parecería ser la razón del bajo consumo de larvas exóticas por R. quelen y es lo que ha demostrado el desarrollo del presente ensayo de laboratorio. Un estudio basado únicamente en el sabor de la piel evidenció que los renacuajos de A. catesbeiana son desagradables para el pez luna (Lepomis spp.) (Kats et al., 1988). Además, mostró una clara variedad de preferencias de este pez entre larvas de anuros A. catesbeiana, Lithobates clamitans (rana verde) y L. sylvaticus (rana de madera).
Otros estudios muestran que es un ítem alimenticio para peces lucios (Esox lucius) o lubina negra (Micropterus salmoides), que depredan directamente sus renacuajos (Louette, 2012; Kruse y Francis, 1977). Los peces evitan a A. catesbeiana y Bufo spp. porque son desagradables (Werner y McPeek, 1994). Por otro lado, se sugiere que especies del género Rhinella desarrollan toxinas que las protegen de la depredación (Skelly y Werner, 1990; Anholt et al., 1996; Kiesecker et al., 1996; Jara y Perotti, 2006). Esto se puede deber a la presencia de bufoteninas, toxina descrita en otros representantes de la familia Bufonidae (Lawler y Hero, 1997; Crossland y Alford, 1998).
En el presente ensayo se encontró que R. quelen consumió las larvas de estadios tempranos de A. catesbeiana, aunque en una frecuencia muy baja. Por los resultados encontrados y ante una oferta conjunta parecería que el consumo de larvas exóticas fue de manera ocasional. La biomanipulación mediante la introducción de peces nativos puede tener impacto en individuos de rana toro y se han demostrado niveles significativamente reducidos de larvas en menos de dos años, en estanques donde se introdujo la especie Esox lucius (pez lucio) (Louette, 2012). En el presente ensayo, al ofrecer dos larvas (una nativa y una exótica) en forma simultánea a cada pez, se observó que el consumo de larvas nativas aumentó a medida que transcurría el tiempo del ensayo. Esto sugiere una preferencia del bagre negro por las larvas de la rana criolla (L. lucator) más que por la especie exótica ofrecida. También se comprobó que consumió larvas de rana toro de primeros estadios de desarrollo (pro-metamorfosis G1, 24-26, Gosner) los dos primeros días, y luego prefirió las larvas nativas. Se sugiere que para el uso de R. quelen como control biológico en tajamares debería complementarse este estudio con experimentos en condiciones de campo que pueden mostrar resultados diferentes.
Relación entre tamaños de presa y depredador
El riesgo de depredación de las larvas de anfibios está influenciado por el tamaño de los predadores (Travis et al., 1985). A medida que crecen, tanto el tamaño corporal como el de la boca de los peces carnívoros aumenta (Nilsson y Bronmark, 2000; Dorner y Wagner, 2003), y esto se relaciona positivamente con el tamaño de las presas (Duarte et al., 2007). En este sentido, se debe considerar el tamaño de los peces para depredar larvas de rana toro, con un máximo de 15 a 18 cm de longitud (López y Grassi, 2019), dado el estrecho vínculo entre la longitud del depredador y la longitud de la presa (Ibáñez et al., 2004, Ibáñez, 2005).
Por otro lado, para utilizar larvas de una presa alternativa de igual tamaño se seleccionaron larvas de la rana criolla, una de las ranas nativas de mayor tamaño de Uruguay, porque estadios mayores de las larvas de A. catesbeiana ya no eran comparables. En el presente estudio se eliminó el efecto de la diferencia en el tamaño de las presas ofrecidas, considerándose larvas de similar tamaño y peso. Al considerar a R. quelen como control biológico, debe tenerse en cuenta la talla adecuada de los peces a incluir que se asocia, al igual que la boca, con el tamaño de las presas. Dicha especie presentó un largo total entre 17,9 y 24 cm y pesos de entre 50,7 y 209,6 gr, consumió larvas de 1 a 2 cm de LT y pesos entre 0,24 a 0,42 gr para nativas y 0,51 a 0,91 gr para exóticas.
La biomanipulación de cuerpos de agua a realizarse con la presencia de rana toro debería ser particular para cada tajamar y de acuerdo con la etapa del proceso de invasión en la que se encuentre esta especie exótica invasora en dicho sistema. En una etapa inicial de invasión donde se reporta la presencia de otras especies de anfibios, el bagre negro no serviría para su control, ya que eliminaría las larvas nativas. Sin embargo, podría ser considerado como alternativa en etapas avanzadas de la bioinvasión, en cuerpos de agua muy invadidos donde la rana toro está bien establecida y no se reporta la presencia de anfibios nativos. Estas acciones permitirían integrar el control biológico al manejo de la rana toro en establecimientos productivos del país, donde no se puede prescindir del agua, como son los casos de predios frutícolas invadidos en Canelones (Iturburu et al., 2024).
La variación ontogénica afecta la depredación
Las glándulas responsables del sabor desagradable de los anfibios generalmente no están presentes en la etapa larval o se desarrollan al final de este período, justo antes de la metamorfosis (Formanowicz y Brodie, 1982; Zug et al., 2001). La variación ontogénica de los renacuajos afecta la depredación de anfibios como Bufo spinulosus (Jara y Perotti, 2006). Dichos autores encontraron que los renacuajos de los primeros estadios de desarrollo (estadios 24-26 y 32-34) no fueron palatables, mientras que los estadios 38-40 y 42-45 fueron progresivamente palatables. Para A. catesbeiana (Krusey y Francis, 1977) se encontró que los peces no consumieron los estadios de desarrollo larval 25-40 de Gosner (Gosner, 1960). Para evaluar el uso del bagre negro como controlador biológico, se recomienda evaluar otros estadios de desarrollo de Gosner más avanzados (ej. 32-34, 38-40, 42-45), que no fueron considerados en este trabajo.
Conclusiones
En el presente ensayo experimental se constató la depredación por R. quelen de larvas de anuros autóctonos (L. lucator), y ocasionalmente de larvas de anuros exóticos invasores de A. catesbeiana. Rhamdia quelen consumió larvas en estadios tempranos de desarrollo, 24-26 de Gosner (1960), y presentó una mayor preferencia por las larvas de la especie nativa frente a las exóticas en función del tiempo del ensayo de laboratorio.
Se sugiere realizar experimentos de campo para apoyar esta conclusión, así como evaluar otros factores del complejo presa-predador que pueden influir en el diseño de nuevos ensayos de experimentación o el uso potencial de R. quelen como controlador biológico de la rana toro. Entre dichos factores destacan el ambiente invadido, la relación del tamaño presa-predador, el estadio de desarrollo de las presas, la presencia de toxinas y otras defensas antidepredatorias en larvas de anfibios. También es necesario considerar la preferencia por larvas de otros anuros nativos que coexisten con la rana toro y evaluar otros posibles peces nativos predadores como potenciales biocontroladores de la rana toro (por ejemplo, “cabeza amarga” Crenicichla sp. o “tarariras” Hoplias sp.).
Agradecimientos
Este trabajo fue posible por la colaboración de distintos colegas y el apoyo de la partida de Dedicación Total del programa de la Comisión Sectorial de Investigación Científica de Udelar de Ernesto Brugnoli y José Carlos Guerrero. El ensayo cumple con el Protocolo CEUA Nº 1470, que contó con el seguimiento de Franco Teixeira de Mello. A los investigadores de Facultad de Ciencias Raúl Maneyro, Ernesto Elgue, Gisela Pereira, Diego Lecari y Bettina Tassino. A Jorge da Silveira, Alejandro Méndez, Juan C. Gambarotta, Piero Candoni y Claudia Turra. Brugnoli y Guerrero agradecen al PEDECIBA y SNI-ANII. El presente trabajo forma parte de la tesis de Doctorado en Ciencias Ambientales (Facultad de Ciencias, Udelar) del primer autor.
Referencias
Achaval, F. y Olmos, A., 1997. Anfibios y reptiles del Uruguay. Montevideo: Barreiro y Ramos. (Serie Fauna, 1).
Adriaens, T.; Brys, R.; Half Maerten, D. y Devisscher, S., 2019. Information on measures and costs related to the Union-listed species Lithobates catesbeianus. Technical note prepared by IUCN for the European Commission. Gland: IUCN.
Aguilar, K.V., 2012. Introducción de la rana toro Lithobates catesbeiana: implicaciones para la biodiversidad ecuatoriana [En línea]. En: CEDAMAZ, 2(1). [Consulta: 10 de Agosto de 2023]. Disponible en: https://revistas.unl.edu.ec
Alford, R. A. y S.J. Richards. 1999. Global amphibian declines: a problem in applied ecology [En línea]. En: Annual Review of Ecology and Systematics, (30), pp. 133-165. [Consulta: 20 de Agosto de 2023]. Disponible en: https://www.researchgate.net/profile/Stephen
Anholt, R. R.; Lyman, R. F. y Mackay, T. F., 1996. Effects of single P-element insertions on olfactory behavior in Drosophila melanogaster [En línea]. En: Genetics, 143(1), pp. 293-301. [Consulta: 10 de Agosto de 2023]. Disponible en: https://www.ncbi.nlm.nih.gov
Bissattini, A. M.; Buono, V. y Vignoli, L., 2019. Disentangling the trophic interactions between American bullfrogs and native anurans: Complications resulting from post‐metamorphic ontogenetic niche shifts. En: Aquatic Conservation:Marine and Freshwater Ecosystems, 29(2), pp. 270-281. DOI: https://doi.org/10.1002/aqc.3023
Breijo, M. y Domínguez, L., 2019. Principios rectores asociados a la experimentación con animales vertebrados. La realidad en Uruguay y sus regulaciones. En: Teixeira de Mello, Franco, ed. Experimentación con animales no tradicionales en Uruguay. Montevideo: CSIC, Comisión Honoraria de Experimentación Animal. pp. 19-26. [Consulta: 15 de Agosto de 2023]. Disponible en: https://www.chea.edu.uy/
Brühl, C.A.; Schmidt, T.; Pieper, S.; Alscher, A.; Stuart, S.N.; Pounds, J. A.; Burkhardt, J.G., 2013. Terrestrial pesticide exposure of amphibians: an underestimated cause of global decline? En: Scientific Reports, 3, pp. 1783-1786. [Consulta: 22 de Febrero de 2023]. Disponible en: https://www.nature.com/articles/srep01135
Capdevila-Argüelles, L.; Zilletti, B. y Suárez-Álvarez, V. Á., 2013. Causas de la pérdida de biodiversidad: especies exóticas invasoras. En: Memorias Real Sociedad Española de Historia Natural, 2a época, 10, pp. 55-75.
Carreira, S. y Maneyro, R., 2019. Libro rojo de anfibios y reptiles del Uruguay. Biología y conservación de anfibios y reptiles en peligro de extinción a nivel nacional. Montevideo: Dinama.
Carreira, S. y Maneyro, R., 2015. Lista roja de los anfibios y reptiles del Uruguay. Una evaluación del estado de conservación de la herpetofauna de Uruguay sobre la base de los criterios de la Unión Internacional para la Conservación de la Naturaleza (UICN). Montevideo: Dinama.
Cordovez, C. A. C.; Herrera-González, I. T.; Amén, B. A. E.; Ochoa, K. A. R. y García, W. A. B., 2021. Composición dietética de especímenes adultos de la especie invasora Lithobates catesbeianus (Shaw, 1804) en el Área Protegida Isla Santay, Ecuador. En: Investigación, (16), pp. 42-51. DOI: http://dx.doi.org/10.31095/investigatio.2021.16.4
Crossland M.R. y Alford R.A,1998. Evaluation of toxicity of eggs, hatchlings and tadpoles of the introduced toad Bufo marinus (Anura, Bufonidae) to native Australian aquatic predators. En: Australian Journals of Ecology 23 (2): pp. 129-137. DOI: https://doi.org/10.1111/j.1442-9993.1998.tb00711.x
de Sá, R. O. 2005. Crisis global de biodiversidad: importancia de la diversidad genética y la extinción de anfibios. En: Agrociencia, 9(1-2), 513. [Consulta: 10 de Abril de 2023]. Disponible en: https://scholarship.richmond.edu/biology-faculty-publications/65/
Dorner, H. y Wagner, A., 2003. Size-dependent predator-prey relationships between perch and their fish prey. En: Journal of Fish Biology, 62, pp. 1021-1032. DOI: https://doi.org/10.1046/j.1095-8649.2003.00092.x
Duarte, F.; Ibáñez, C. M. y Chong, J., 2007. Cambios en la morfometría bucal y su relación con la dieta de Thyrsites atun (Euphrasen, 1791) en el centro-sur de Chile. [En línea]. En: Revista Chilena de Historia Natural, 80(4), pp. 407-417. DOI: http://dx.doi.org/10.4067/S0716-078X2007000400002
Everitt, B. S., 1992. The analysis of contingency tables [En línea]. 2a ed. Chapman and Hall. [Consulta: 12 de Abril de 2023]. Disponible en: https://books.google.es/
Formanowicz Jr, D. R. y Brodie Jr, E. D., 1982. Relative palatability of members of a larval amphibian community [En línea]. En: Copeia, pp. 91-97. DOI: https://doi.org/10.2307/1444272
Frost, Darrel R., 2024. Amphibian species of the world: an online reference [En línea]. Version 6.2. New York: American Museum of Natural History. [Consulta: 12 de Junio 2024]. Disponible en: https://amphibiansoftheworld.amnh.org/index.php
Gobel, N., 2013. Efectos comunitarios de la invasión de rana toro Lithobates catesbeianus en Aceguá, Cerro Largo [En línea]. Montevideo: Facultad de Ciencias, UdelaR. (Tesis de Grado). [Consulta: 12 de marzo de 2024]. Disponible en: https://www.colibri.udelar.edu.uy/jspui/bitstream/20.500.12008/1543/1/uy24-16726.pdf
Gomes, L. D. C.; Golombieski, J. I.; Gomes, A. R. C. y Baldisserotto, B., 2000. Biologia do jundiá Rhamdia quelen (teleostei, pimelodidae). En: Ciência Rural, 30(1), pp. 179-185. DOI: https://doi.org/10.1590/S0103-84782000000100029
Gomiero L. M.; Souza, U. P. y Braga, F. M. D. S., 2007. Reprodução e alimentação de Rhamdia quelen (Quoy & Gaimard, 1824) em rios do Núcleo Santa Virgínia, Parque-Estadual da Serra do Mar, São Paulo, SP. En: Biota Neotropica, 7(3), pp. 127-133. DOI: https://doi.org/10.1590/S1676-06032007000300015
González, S., 2019. Libro rojo de los anfibios y reptiles del Uruguay. Biología y conservación de los anfibios y reptiles en peligro de extinción a nivel nacional de Santiago Carreira & Raúl Maneyro (Eds). DINAMA. Montevideo, Uruguay. 2019 [En línea]. En: Educación en Ciencias Biológicas, 4(1), pp. 42. [Consulta: 12 de marzo de 2024]. Disponible en: https://ojs.cfe.edu.uy/index.php/RevEdCsBiol/article/view/460
Gosner, K. L., 1960. Una tabla simplificada para clasificar embriones y larvas de anuros con notas sobre la identificación. En: Herpetológica, 16(3), pp. 183-190.
Hirai, T., 2004. Diet composition of introduced bullfrog, Rana catesbeiana, in the Mizorogaike Pond of Kyoto, Japan. En: Ecological Research 19 (4), pp. 375-380. DOI: https://doi.org/10.1111/j.1440-1703.2004.00647.x
Hirai, T., 2003. Reeves’ pond turtle, Chinemysreevesii, eaten by exotic bullfrog, Rana catesbeiana. [En línea]. En: Kansai Organization for Nature Conservation, 25, pp. 3-5. [Consulta: 21 de Abril de 2023]. Disponible en: https://cir.nii.ac.jp/crid/1571698600012299648
Hoffmann, M.; Hilton-Taylor, C.; Angulo, A.; Böhm, M.; Brooks, T. M.; Butchart, S. H. y Veloso, A., 2010. The impact of conservation on the status of the world’s vertebrates. En: Science, 330(6010), pp. 1503-1509. DOI: 10.1126/ciencia.1194442
Ibáñez, C.M., 2005. Relaciones morfométricas del draco rayado Champsocephalus gunnari (Perciformes, Notothenioidei) y su presa el krill antártico Euphausia superba (Crustacea, Euphausiacea). En: Boletín del Museo Nacional de Historia Natural (Chile), 54, pp. 33-36. DOI: https://doi.org/10.54830/bmnhn.v54.2005.279
Ibáñez, C.M.; González, C. y Cubillos. L., 2004. Dieta del pez espada Xiphias gladius Linnaeus, 1758, en aguas oceánicas de Chile central en invierno de 2003. En: Investigaciones Marinas (Chile), 32, pp. 113-120. DOI: http://dx.doi.org/10.4067/S0717-71782004000200009
Iturburu, M.; Maneyro, R.; Elgue, E.; Brugnoli, E. y Guerrero, J. C., 2024. Eficiência de técnicas de controle da bioinvasão da rã-touro (Aquarana catesbeiana) em área protegida e propriedades privadas (Canelones, Uruguai). En: DELOS Desarrollo Local Sostenible, 17(51), pp. 164-186. DOI: https://doi.org/10.55905/rdelosv17.n51-009
Iturburu, M. y Mello, A. L., 2022. Comité de Especies Exóticas Invasoras de Uruguay: del diagnóstico a la acción, prioridades y desafíos de gestión [En línea]. En: Brazeiro, A.; Bresciano, D.; Brugnoli, E. y Iturburu, M. (eds). Especies exóticas invasoras de Uruguay: distribución, impactos socioambientales y estrategias de gestión. pp. 41-58. Montevideo: Retema, Udelar, CEEI-MA. [Consulta: 8 de Junio de 2023]. Disponible en: https://www.gub.uy/ministerio-ambiente
Iturburu, M., 2018. Indicadores de presencia de especies exóticas invasoras prioritarias de Uruguay. Mapas con registros georeferenciados 2018. Montevideo: CEEI, MVOTMA. ISBN 978-9915- 9331-3-9
Ives, A. R. y Dobson, A. P., 1987. Antipredator behavior and the population dynamics of simple predator-prey systems. En: The American Naturalist, 130(3), pp. 431-447. DOI: https://doi.org/10.1086/284719
Jara, F. G. y Perotti, M. G., 2006. Variación ontogenética en la palatabilidad de los renacuajos de Bufo spinulosus papillosus Philippi, 1902 (Anura: Bufonidae) [En línea]. En: Cuadernos de Herpetología, 19. [Consulta: 10 de Junio de 2023]. Disponible en: https://sedici.unlp.edu.ar/handle/10915/6431
Kats, L. B., Petranka, J. W. y Shih, A., 1988. Antipredator defenses and the persistence of amphibian larvae with fishes. En: Ecology, 69(6), pp. 1865-1870. DOI: https://doi.org/10.2307/1941163
Kiesecker, J. M.; Chivers, D. P. y Blaustein, A. R., 1996. The use of chemical cues in predator recognition by western toad tadpoles. En: Animal Behaviour, 52(6), pp. 1237-1245. DOI: https://doi.org/10.1006/anbe.1996.0271
Kirkpatric, R. D., 1982. Rana catesbeiana (Bullfrog) Food [En línea]. En: Herpetological Review ,13, 17. [Consulta: 30 de Mayo de 2024]. Disponible en: https://cir.nii.ac.jp/crid/1573950399825985792
Kruse, K.C. y Francis, M.G., 1977. A predation deterrent in larvae of the bullfrog, Rana catesbeiana [En línea]. En: Transactions of the American Fisheries Society, 106(3), pp. 248-252. DOI: https://doi.org/10.1577/1548-8659(1977)106<248:APDILO>2.0.CO;2
Laufer, G.; Gobel, N.; Kacevas, N. y Lado, I., 2023. American bullfrog (Lithobates catesbeianus) distribution, impact on native amphibians and management priorities in San Carlos, Uruguay. En: Knowledge & Management of Aquatic Ecosystems, (424), 20. DOI: https://doi.org/10.1051/kmae/2023016
Laufer, G.; Gobel, N.; Berazategui, M.; Zarucki, M.; Cortizas, S.; Soutullo, A. y De Sa, R. O., 2021. American bullfrog (Lithobates catesbeianus) diet in Uruguay compared with other invasive populations in Southern South America [En línea]. En: North-Western Journal of Zoology, 17(1), e211502. [Consulta: 9 de Mayo de 2023]. Disponible en: https://scholarship.richmond.edu/biology-faculty-publications/231/
Laufer, G.; Gobel, N.; Kacevas, N. y Lado, I., 2018. Una nueva población feral de rana toro (Lithobates catesbeianus) en Uruguay, encontrada con participación ciudadana. En: Revista Latinoamericana de Herpetología, 1(2), pp. 47-50. DOI: https://doi.org/10.22201/fc.25942158e.2018.2.23
Laufer, G. y Gobel, N., 2017. Habitat degradation and biological invasions as a cause of amphibian richness loss: a case report in Aceguá, Cerro Largo, Uruguay. En: Phyllomedusa: Journal of Herpetology, 16(2), pp. 289-293. DOI: http://dx.doi.org/10.11606/issn.2316-9079.v16i2p289-293
Laufer, G.; Arim, M. y Loureiro, M., 2009. Informe de dos nuevas poblaciones invasoras de Rana Toro en Uruguay. Informe técnico enviado a la Dirección Nacional de Medio Ambiente, Montevideo. Montevideo: DINAMA.
Laufer, G.; Canavero, A.; Núñez, D. y Maneyro, R., 2008. Bullfrog (Lithobates catesbeianus) invasion in Uruguay [En línea]. En: Biol Invasions, 10, pp. 1183–1189. [Consulta: 30 de Mayo de 2024]. Disponible en: https://www.researchgate.net/profile/Gabriel-Laufer/publication/
Lawler, K. L. y Hero, J. M., 1997. Palatability of Bufo marinus tadpoles to a predatory fish decreases with development. En: Wildlife Research, 24(3), pp. 327-334. DOI: https://doi.org/10.1071/WR96089
Leivas, P.T.; Leivas F. W.T. y Moura, M.O., 2012. Diet and trophic niche of Lithobates catesbeianus (Amphibia: Anura). En: Zoología, 29, pp. 405-412. DOI: https://doi.org/10.1590/S1984-46702012000500003
Lermen, C. L.; Lappe, R.; Crestani, M; Vieira, V. P.; Gioda, C. R.; Schetinger, M.R.C; Baldisse- Rotto, B; Moraes, G.; Morsch, V. M., 2004. Effect of different temperature regimes on metabolic and blood parameters of silver catfish Rhamdia quelen. En: Aquacultura, 239(1-4), pp. 497- 507. DOI: https://doi.org/10.1016/j.aquaculture.2004.06.021
Lima, S. L. y Dill, L. M., 1990. Behavioral decisions made under the risk of predation: a review and prospectus. En: Canadian Journal of Zoology, 68(4), pp. 619-640. DOI: https://doi.org/10.1139/z90-092
López, C. A. y Grassi, E., 2019. Presencia de poblaciones ferales de rana toro (Rana catesbeiana en la zona de amortiguamiento oriental del Parque Nacional Iguazú, Argentina. En: Boletín de la Sociedad Zoológica del Uruguay, 28(2), pp. 87-9. DOI: https://doi.org/10.26462/28.2.5
López-Flores, M.; Cruz-Burgos, J. A. y Vilella, F. J., 2003. Predation of a white-cheeked pintail (Anas bahamensis) duckling by a bullfrog (Rana catesbeiana) [En línea]. En: Caribbean Journal of Science 2, pp. 240–242. [Consulta: 30 de Mayo de 2024]. Disponible en: https://www.researchgate.net/profile/FranciscoVilella/
Louette, G., 2012. Use of a native predator for the control of an invasive amphibian. En: Wildlife Research, 39(3), pp. 271-278. DOI: https://doi.org/10.1071/WR11125
Lowe, S.; Browne, M.; Boudjelas, S. y De Poorter, M., 2000. 100 of the world’s worst invasive alien species: a selection from the global invasive species database (Vol. 12). Auckland: Invasive Species Specialist Group.
Mack, R.N.; Simberloff, D.; Mark Lonsdale, W.; Evans, H.; Clout, M. y Bazzaz, F.A., 2000. Biotic invasions: causes, epidemiology, global consequences, and control. En: Ecological Applications, 10(3), 689-710.
Maneyro, R., 2019. Colecta y manejo de anfibios en el ambiente. Experimentación con animales no tradicionales en Uruguay. En: Teixeira de Mello, Franco, ed. Experimentación con animales no tradicionales en Uruguay. Montevideo: Comisión Honoraria de Experimentación Animal, CSIC. pp. 71-79
Maneyro, R. y Carreira, S., 2012. Guía de anfibios del Uruguay (Nº. 597.809895 MANg). Montevideo: Ediciones de la Fuga.
Maneyro, R. y Carreira, S., 2006. Herpetofauna de la costa uruguaya. En: Menafra, R.; Rodríguez-Gallego, L.; Scarabino, F. y Conde, D., eds. Bases para la conservación y el manejo de la costa uruguaya. Montevideo: Vida Silvestre, pp. 233-246.
Maneyro, R.; Laufer, G.; Núñez, D. y Canavero, A., 2005. Especies invasoras: primer registro de rana toro, Rana catesbeiana (Amphibia, Anura, Ranidae) en Uruguay. En: Resúmenes de las VIII Jornadas de Zoología del Uruguay, Montevideo, pp. 24-28.
Maneyro, R. y Langone, J. A., 2001. Categorización de los anfibios de Uruguay [En línea]. En: Cuadernos de Herpetología, 15(2): pp. 107-118. [Consulta: 18 de enero de 2023]. Disponible en: http://sedici.unlp.edu.ar/handle/10915/6355
Mazzoni, R. y Carnevia, D., 1996. Análisis de la situación y perspectivas de la ranicultura en Uruguay. En: Bol. I. I. P. (13), pp. 5-19.
McAlpine, D. F. y Dilworth, T. G., 1989. Microhabitat and prey size among three species of Rana (Anura: Ranidae) sympatric in eastern Canada. En: Canadian Journal of Zoology, 67(9), pp. 2244-2252. DOI: https://doi.org/10.1139/z89-317
Moreno, J. S.; Rodríguez, J. J. J y Garcia-Cardente, L., 2020. Anfibios y reptiles de la Gran Senda de Málaga. Málaga: Diputación de Málaga, Equipo Gran Senda de Málaga, Delegación de Medio Ambiente, Turismo Interior y Cambio Climático.
Morales González, M. B., 2021. Dieta de la rana toro Lithobates catesbeianus en Jalpan, Apapantilla, Puebla [En línea]. Puebla: Benemérita Ciudad de Puebla. (Tesis de Licenciatura). [Consulta: 13 de marzo de 2023]. Disponible en: https://repositorioinstitucional.buap.mx/items/ea43caf7-c6e4-4907-932c-66f118bdbc56
Mueller, G.A.; Carpenter, J. y Thornbrugh, D., 2006. Bullfrog tadpole (Rana catesbeiana) and red swamp crayfish (Procambarus clarkii) predation on early life stages of endangered razorback sucker (Xyrauchentexanus). En: The Southwestern Naturalist 51(2), pp. 258-261. DOI: https://doi.org/10.1894/0038-4909(2006)51[258:BTRCAR]2.0.CO;2
Nilsson P. A y Brónmark, C., 2000. Prey vulnerability to a gape-size limited predator: behavioural and morphological impacts on northern pike piscivore [En línea]. En: Oikos, 88, pp. 539-546. [Consulta: 15 de Mayo de 2024]. Disponible en: http://www.nativefishlab.net/library/internalpdf/21274.pdf
Pagad, S.; Genovesi, P.; Carnevali, L.; Scalera, R. y Clout, M., 2015. IUCN SSC Invasive Species Specialist Group: invasive alien species information management supporting practitioners, policy makers and decision takers [En línea]. [Consulta: 28 de Julio de 2023]. Disponible en: https://researchspace.auckland.ac.nz
Pearl, C.A.; Adams, M. J.; Buryand, R. B. y McCreary, B., 2004. Asymmetrical effects of introduced bullfrogs (Rana catesbeiana) on native ranid frogs in Oregon. En: Copeia, pp. 11-20. DOI: https://doi.org/10.1643/CE-03-010R2
Peterson, J.A. y Blaustein, A.R., 1991. Unpalatability in anuran larvae as a defense against natural salamander predators. En: Ethology Ecology & Evolution, 3(1), pp. 63-72. DOI: https://doi.org/10.1080/08927014.1991.9525389
Petranka, J. W., 1983. Fish predation: a factor affecting the spatial distribution of a stream-breeding salamander. En: Copeia, pp. 624-628. DOI: https://doi.org/10.2307/1444326
Pyšek, P.; Hulme, P. E.; Simberloff, D.; Bacher, S.; Blackburn, T. M.; Carlton, J. T. y Richardson, D. M., 2020. Scientists’ warning on invasive alien species. En: Biological Reviews, 95(6), pp. 1511-1534. DOI: https://doi.org/10.1111/brv.12627
Ríos, N., 2018. Caracterización genética del bagre negro Rhamdia quelen en cuencas de Uruguay [En línea]. Montevideo: UdelaR. (Tesis de Doctorado). [Consulta: 2 de Julio de 2023]. Disponible en: https://hdl.handle.net/20.500.12008/30744
Ríos, N.; Bouza Fernández, M.C.; Gómez Pardo, M.B.; Gutiérrez, V.; Guerra Varela, J.; Martínez Portela, P. y García, G., 2016. Patrones de diferenciación genética en Rhamdia quelen en las cuencas de Uruguay [En línea]. En: Journal of Basic & Applied Genetics, 27(1). [Consulta: 2 de Julio de 2023]. Disponible en: https://minerva.usc.es/
Robinson, B.W., y Wilson, D.S., 1998. Optimal foraging, specialization, and a solution to Liem’s paradox. [En línea]. En: The American Naturalist, 151(3), 223-235. [Consulta: 09 de agosto de 2023]. Disponible en: https://scholar.google.es/
Roy, H.; Pauchard, A.; Stoett, P.; Renard Truong, T.; Meyerson, L.; Bacher, S.; Galil, B.; Hulme, P.; Ikeda, T.; Sankaran, K.V.; McGeoch, M.; Nuñez, M.; Ordonez, A.; Rahlao, S.; Schwindt, E.; Seebens, H.; Sheppard, A.; Vandvik, V.; Aleksanyan, A.; Ansong, M.; August, T.; Blanchard, R.; Brugnoli, E., et al. (+65 autores), 2024. Curbing the major and growing threats from invasive alien species is urgent and achievable. En: Nature, Ecology and Evolution. DOI: https://doi.org/10.1038/s41559-024-02412-w
Ruibal, M. y Laufer, G., 2012. Bullfrog Lithobates catesbeianus (Amphibia: Ranidae) tadpole diet: description and analysis for three invasive populations in Uruguay. [En línea]. En: Amphib-Reptil, 33, pp. 355-363. [Consulta: 25 de Mayo de 2023]. Disponible en: https://brill.com/view/journals/amre/33/3-4/article-p355_5.xml?ebody=citedby-89771
Sih, A., 1987. Prey refuges and predator-prey stability. En: Theoretical Population Biology, 31(1), pp. 1-12. DOI: https://doi.org/10.1016/0040-5809(87)90019-0
Skelly, D. K. y Werner, E. E., 1990. Behavioral and life‐historical responses of larval American toads to an odonate predator. En: Ecology, 71(6), pp. 2313-2322. DOI: https://doi.org/10.2307/1938642
Sodhi, N. S.; Bickford, D.; Diesmos, A. C.; Lee, T. M.; Koh, L. P.; Brook, B. W. y Bradshaw, C. J., 2008. Measuring the meltdown: drivers of global amphibian extinction and decline. [En línea]. En: PLOS ONE, 3(2), e1636. [Consulta: 18 de Julio de 2023]. Disponible en: https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0001636
Stebbins, R. C. y Cohen, N. W., 1995. A Natural History of Amphibians. Princeton: Princeton University Press.
Stephens, D. W. y Krebs, J.R., 1986. Foraging theory (Vol. 1). Princeton: Princeton University Press.
Stuart, S. N.; Chanson, J. S.; Cox, N. A.; Young, B. E.; Rodrigues, A. S. L., 2004. Status and trends of amphibian declines and extinctions worldwide. En: Ciencia, 306, pp. 1783-1786. DOI: 10.1126/ciencia.110353
Szuroczki, D. y Richardson, Jean M. L., 2011. Palatability of the larvae of three species of lithobates. En: Herpetológica, 67(3), pp. 213-221. DOI: 10.2307/41238997
Teixeira de Mello, F.; González-Bergonzoni, I. y Loureiro, M., 2011. Peces de agua dulce del Uruguay. Montevideo: PPR-MGAP. 188 pp.
Travis, J.; Keen, W. H. y Julianna, J., 1985. The role of relative body size in a predator-prey relationship between dragonfly naiads and larval anurans. En: Oikos, pp. 59-65. DOI: https://doi.org/10.2307/3565222
Uruguay. Gobierno de Canelones, 2018. CECOED trabaja en acciones para evitar la propagación de la rana toro [En línea]. Canelones: Gobierno de Canelones. [Consulta: 15 de marzo de 2023]. Disponible en: https://imcanelones.gub.uy/es/
Uruguay. Instituto Nacional de Investigación Agropecuaria, 2000. Producciones alternativas: ranas, martineta y carpincho. Montevideo: INIA. pp. 5-26.
Uruguay. Ministerio de Ganadería, Agricultura y Pesca, 2008. Estrategia General para el Desarrollo de la Acuicultura Sostenible Proyecto TCP/URU/3101 [En línea]. Montevideo: Dinara. [Consulta: 15 de mayo de 2024]. Disponible en: https://www.gub.uy/ministerio-ganaderia-agricultura-pesca
Vaz Ferreira, Raúl, 1969. Peces del Uruguay. Montevideo: Nuestra Tierra. (Nº 23).
Werner, E. E. y McPeek, M. A., 1994. Direct and indirect effects of predators on the distribution on two anuran species along an environmental gradient. En: Ecology, 75, pp. 1368-1382. DOI: https://doi.org/10.2307/1937461
Winemiller, K. O., 1989. Ontogenetic diet shifts and resource partitioning amongpiscivo- rous fishes in the Venezuelan Llanos. [En línea]. En: Environmental Biology of Fishes, 26, pp. 177-199. DOI: https://doi.org/10.1007/BF00004815
Woodward, B. D., 1983. Predator-prey interactions and breeding-pond use of temporary-pond species in a desert anuran community. En: Ecology, pp. 1549-1555. DOI: https://doi.org/10.2307/1937509
Zarucki, M.; Loureiro, M.; Díaz, D.; Serra, W. S. y Fabiano, G., 2021. Situación de las especies de peces exóticas e invasoras en Uruguay. En: Brazeiro, A., Bresciano, D.; Brugnoli, E. y Iturburu, M., eds. Especies exóticas invasoras de Uruguay: distribución, impactos socioambientales y estrategias de gestión. Montevideo: Retema-Udelar/CEEI, Ministerio de Ambiente. pp. 215-226.
Zug, G. R.; Vitt, L. y Caldwell, J. P., 2001. Herpetology: an introductory biology of amphibians and reptiles. Cambridge: Academic Press.


