Las leguminosas son alimentos fundamentales para la nutrición de los seres humanos por su contenido energético, proteico y de fibra. También pueden ser fuente de diversas enzimas de interés agroindustrial. Es por ello que el objetivo de este trabajo fue diseñar una metodología para extraer proteasas a partir de semillas de frijol pico negro (Vigna unguiculata). Para ello, fueron sometidas a procesos de acondicionamiento previo que contemplaron fermentación, secado, disrupción, filtrado y precipitación. Como métodos de precipitación se emplearon el punto isoeléctrico y la precipitación con etanol. A los extractos obtenidos se les determinó su actividad enzimática. El extracto que exhibió los mejores niveles de actividad fue sometido a un proceso de purificación parcial a través de cromatografía. Se logró semipurificar una fracción con especies proteicas de pesos moleculares cercanos a los 30 kDa, con actividad catalítica en un intervalo de pH entre 5 y 8, siendo estable a temperaturas entre 35 y 45 ℃. Estos resultados sugieren la presencia de una proteasa alcalina de bajo tamaño por el intervalo de pH en el que mostró actividad. Se logró diseñar una metodología sencilla y factible que permite recuperar la actividad enzimática a partir de la semilla Vigna unguiculata.
Palabras clave: proteasas vegetales, frijol pico negro, enzimas alimentarias, extracción de proteínas.
As leguminosas são alimentos essenciais para a nutrição humana, devido ao seu conteúdo energético, proteico e de fibra. Também podem ser fonte de diversas enzimas de interesse agroindustrial. Por isso, o objetivo deste trabalho foi desenhar uma metodologia para extrair proteases de sementes de feijão-caupi (Vigna unguiculata). Para isso, elas foram submetidas a processos de pré-tratamento, que incluíram fermentação, secagem, ruptura, filtração e precipitação. Como métodos de precipitação, foram utilizados o ponto isoelétrico y a precipitação com etanol. A atividade protease dos extratos obtidos foi determinada. O extrato que apresentou os melhores níveis de atividade foi submetido a um processo de purificação parcial por cromatografia. Foi semi-purificada uma fração que continha espécies proteicas com pesos moleculares próximos a 30 kDa, que mostrou atividade catalítica em um intervalo de pH entre 5 e 8, sendo estável em temperaturas entre 35 e 45 ℃. Esses resultados sugerem a presença de uma pequena protease alcalina, devido à faixa de pH em que apresentou atividade. Foi possível desenhar uma metodologia simples e viável que permite recuperar a atividade enzimática da semente de Vigna unguiculata.
Palavras-chave: proteases vegetais, feijão-caupi, enzimas alimentares, extração de proteínas.
Introducción
Las leguminosas han sido ampliamente estudiadas por su relevancia en la alimentación de gran parte de la población, debido a su alto valor proteico que ayuda a balancear la dieta en los estratos más bajos de la sociedad. Se han desarrollado numerosos estudios que confirman todo el potencial que tienen para la industria alimentaria por su contenido de almidones, fibra y proteínas (Granito et al., 2010; Pérez y Granito, 2015). El mayor contenido proteico de las semillas de leguminosas está presente en los cotiledones, donde se incluyen las enzimas encargadas de los diferentes procesos de la germinación, tales como las proteasas (Cruz de Carvalho et al., 2001).
Las enzimas proteolíticas tienen numerosos usos en la industria alimentaria (Moral et al., 2015): para desarrollar el cuerpo y el sabor en la cerveza, aumentar la textura y el volumen del pan en la panificación, generar sabores durante la maduración en la producción de quesos, e incluso para mejorar las propiedades de secado del huevo (Prados et al., 2007; Peña y Quirasco, 2014). También son usadas en la producción de hidrolizados de proteínas (Vairo-Cavalli et al., 2008).
La mayor parte de las enzimas usadas a nivel industrial son de origen microbiano (Lorenz y Eck, 2005), ya que tienen como ventaja los altos niveles de producción en corto tiempo y poco espacio. Sin embargo, los procesos de extracción y purificación suelen ser complejos y costosos. Otra fuente usada para obtener enzimas es a partir de órganos de origen animal, tal como los extractos pancreáticos o la pepsina obtenida a partir de vísceras de cerdo (Alberto et al., 2014), la cual también presenta desventajas en cuanto a los rendimientos y los requerimientos de proceso. Este hecho ha motivado el interés en fuentes de origen vegetal, que presentan ventajas tales como bajos costos de inversión en procesos de extracción y purificación, estabilidad en una amplia gama de condiciones operativas (temperatura, pH, salinidad y solventes orgánicos), alta afinidad a una amplia variedad de sustratos y posibilidad de inmovilización (Troncoso et al., 2022). Existe evidencia científica que demuestra la alta concentración de proteasas en las semillas de leguminosas (Abdala et al., 1999; Cruz de Carvalho et al., 2001).
En lo que respecta al proceso de aislamiento de la fracción proteica, diversas investigaciones han propuesto distintas metodologías factibles (Eltayeb et al., 2011; Budič et al., 2016); sin embargo, no existe un método estándar de purificación. Es por ello que se continúan desarrollando estudios en esta área, así como a nivel de los pretratamientos de las semillas para mejorar los rendimientos y propiedades nutritivas, tales como la fermentación (Çabuk et al., 2018).
En consecuencia, dado que las leguminosas son una fuente de proteínas vegetales económicas y que se producen todo el año en los países de clima tropical, se planteó como objetivo diseñar una metodología para aislar y purificar parcialmente proteasas a partir del frijol pico negro (Vigna unguiculata).
Materiales y Métodos
Material vegetal
El frijol pico negro (Vigna unguiculata) que se utilizó en el estudio fue adquirido en un mercado local de la ciudad de Maracay (Venezuela). Se almacenó a temperatura ambiente hasta su procesamiento.
Proceso de fermentación
Se empleó el procedimiento propuesto por Granito et al. (2009) con modificaciones, la fermentación fue por 24 h a 37 ℃. Cumplido el tiempo, los granos fueron secados en estufa a 40 ℃ hasta alcanzar un peso constante. El material seco fue conservado a temperatura ambiente hasta su posterior procesamiento.
Homogenización del grano
Se pesaron 100 g de la leguminosa y se homogenizaron usando una licuadora comercial en una proporción 1:3 con agua destilada, haciendo cinco ciclos de molienda de 15 segundos/1 minuto de reposo en hielo. La mezcla obtenida fue filtrada usando un embudo de tallo largo y gasa estéril, y el sobrenadante fue recolectado en un tubo de plástico tipo falcón de 50 mL estéril. El sobrenadante fue sometido a un proceso de centrifugación de 5.000 RPM/5 min a 4 ℃ para eliminar restos de sedimento. El homogenato se almacenó a 4 ℃ hasta su posterior uso.
Métodos para aislamiento de proteasas
Con el objetivo de obtener los extractos proteicos se utilizaron dos métodos de precipitación: con etanol y por punto isoeléctrico. La precipitación se realizó con semillas sin fermentar y con semillas fermentadas a fin de comparar rendimientos (Figura 1).

Figura 1. Esquema de obtención de los diferentes extractos proteicos.
Precipitación de las proteínas con etanol: se empleó la metodología propuesta por Chávez et al. (2016) con modificaciones. Una muestra de 50 mL del homogenato se precipitó con tres partes de etanol al 70 % frío (0-5 ℃) y se dejó en reposo 1 h a 4 ℃. Luego, fue sometida a un proceso de centrifugación 1.500 RPM en una centrifuga refrigerada (4 ℃). El sedimento fue lavado con agua destilada fría y disuelto en tampón fosfato 100 mM (pH = 7).
Precipitación de las proteínas por punto isoeléctrico: se empleó la metodología propuesta por Eltayeb et al. (2011) con modificaciones. Se tomaron 50 mL del homogenato y se colocaron en un beacker. Se dispuso en una plancha con agitación a baja velocidad y se incorporó ácido acético glacial (95 %) lentamente de manera progresiva, hasta observar la formación de un precipitado; se detuvo la adición y se dejó en reposo por 10 min. Luego, se sometió a un proceso de centrifugación por 10 min a 5.000 RPM y se separaron las dos fases mediante una decantación. El sedimento fue lavado con agua destilada fría y resuspendido en tampón fosfato 100 mM (pH = 7).
Actividad proteolítica
La actividad proteolítica contra caseína en los extractos proteicos se realizó siguiendo el método modificado de Kunitz (1947). Se preparó una solución de caseína al 1 % previo al ensayo. Se colocó en tubos tipos eppendorf de 1,5 mL la siguiente mezcla: 350 μL de caseína al 1 %, el volumen de la muestra, y se completó a un volumen final de 500 μL con agua destilada. La mezcla se incubó por 30 min a 37 ℃ y luego se detuvo la reacción añadiendo 500 μL de ácido tricloro acético (TCA) al 10 %, frío. Se centrifugó a razón de 10.000 RPM/5 minutos, y se determinó la absorbancia a 280 nm del sobrenadante.
Recuperación de la actividad proteolítica
Una vez definida la mejor metodología para recuperar la mayor actividad proteolítica, se decidió realizar un proceso de semipurificación usando una cromatografía de exclusión molecular para poder aislar las proteasas presentes en el extracto de proteínas. Para ello se usó una columna de 40 cm de longitud por 2 cm de diámetro empacada con una resina Sephadex G-25, utilizando tampón de fosfato 0,1 mM a pH 7, como eluyente. La concentración de proteínas fue cuantificada por el método de Lowry et al.(1951) y la corrida electroforética se desarrolló usando la metodología propuesta por Ojeda et al. (2020).
Estabilidad enzimática
Para estudiar el efecto del pH sobre la actividad enzimática se emplearon soluciones tampón de fosfato 0,1 mM en un rango de pH comprendido entre 4 y 9. Para realizar la evaluación de la estabilidad térmica, se incubaron muestras de extracto crudo durante 15 minutos a 30, 40, 50, 60, 70 y 80 ℃. Luego de cada tratamiento, las muestras fueron conservadas en baño de hielo hasta el momento de la determinación de la actividad (Rocha et al., 2010).
Análisis estadístico
Las absorbancias obtenidas a 280 nm en los diferentes ensayos fueron analizadas usando estadística descriptiva para determinar la media y la desviación estándar mediante el programa Excel de Microsoft Office 2016. Las mediciones se hicieron por cuadruplicado.
Resultados y Discusión
Aislamiento de proteasas
De las cuatro condiciones de extracción planteadas en el estudio, los resultados de la actividad enzimática de los extractos se reportan en la Tabla 1. Se observó que el proceso de precipitación a partir de la semilla sin fermentar con etanol fue el que logró una mayor recuperación de la actividad enzimática (1,03 ± 0,13) con respecto a las otras tres condiciones.
Tabla 1. Actividad proteolítica de los extractos.
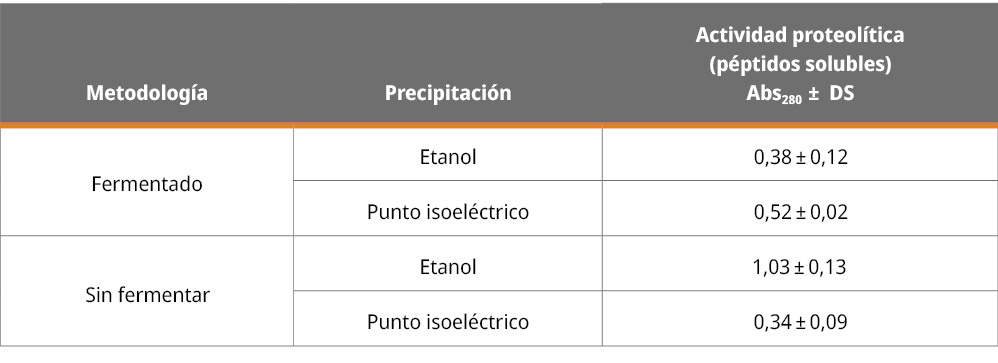
Nota: desviación estándar (DS)
Este rendimiento favorable con etanol ya ha sido reportado en la literatura, como lo demuestran los trabajos de Rocha et al. (2010), quienes aislaron una proteinasa aspártica del fruto (Salpichroa origanifolia) usando etanol y obtuvieron excelentes resultados. Así como el trabajo de Ojeda et al. (2012), quienes utilizaron etanol para precipitar y recuperar un extracto con actividad proteolítica de un cultivo de Lactobacillus casei.
En lo que respecta a los bajos valores encontrados en las semillas fermentadas, debe estar asociado directamente a la actividad biológica de los microorganismos. Tal como lo explica Granito et al. (2002), durante el proceso de fermentación se reduce sustancialmente el contenido de algunos factores antinutricionales presentes en la semilla (como los inhibidores de proteasas), estimulando la actividad de las enzimas proteolíticas presentes en la semilla, lo que podría producir una disminución en la recuperación de la actividad enzimática.
En el caso de la precipitación por punto isoeléctrico en semillas sin fermentar, la baja actividad puede estar asociada a una desnaturalización irreversible provocada por la acción del agente químico empleado (ácido acético), que provocó una pérdida considerable en la actividad.
Es importante destacar que una de las ventajas del método de extracción planteado en este estudio es la generación de subproductos con valor agregado. Tal es el caso del pellet obtenido después de la homogenización, rico en carbohidratos, con un remanente de proteínas y lípidos insolubles, el cual puede ser utilizado para la producción de harinas en la industria alimentaria. O como el caso del etanol presente en el sobrenadante después de la precipitación, que puede ser sometido a un proceso de destilación para su reutilización; lo que incrementa la factibilidad y sostenibilidad de esta metodología.
Fraccionamiento del extracto proteolítico
Se procesó un volumen de 2 mL del extracto obtenido después de la precipitación con etanol y se recolectaron fracciones de 1 mL. Los resultados del proceso de purificación parcial por cromatografía se presentan en la Figura 2. El patrón de separación observado en la cromatografía muestra la mayor proporción de proteínas entre las fracciones 10 y 12, alcanzando su máxima absorbancia en la 11.

Figura 2. Purificación parcial de las proteasas del frijol. A) Perfil proteico y actividad proteolítica de las fracciones luego de la separación cromatográfica. B) Patrón polipeptídico de la fracción con mayor actividad proteolítica. Carril 1 marcador de peso molecular, Carril 2 corresponde a la fracción (11) con máxima actividad proteolítica.
En vista de que la resina de Sephadex G-25 separa las moléculas por su tamaño y las leguminosas poseen proteínas de diferentes pesos moleculares como las albúminas, globulinas, glutelinas y prolaminas (Perazzini et al., 2008), se esperaba obtener diferentes picos en el perfil cromatográfico. Los resultados observados pueden estar asociados con la acción de las proteasas presentes en el extracto sobre el resto de las proteínas presentes en la fracción.
En lo que respecta a la electroforesis (Figura 2B), se observan varias bandas entre el intervalo de 25 y 30 kDa. Ese bajo peso molecular es el esperado para enzimas hidrolíticas con actividad proteolítica. El resultado coincide con lo encontrado por Abdala et al. (1999), quienes aislaron una aminopetidasa a partir del Phaseolus vugaris, con un peso molecular cercano a los 30 kDa y un pH óptimo de 7; y lo hallado por Budič et al. (2016), quienes aislaron una enzima proteolítica del tipo serin proteasa a partir del Phaseolus vugaris con un peso molecular de 37 kDa. Esto demuestra que el proceso de purificación diseñado fue efectivo.
Una vez que se purificó parcialmente el extracto, se procedió a determinar el efecto del pH y la temperatura sobre su actividad. Los resultados obtenidos se muestran en la Figura 3.
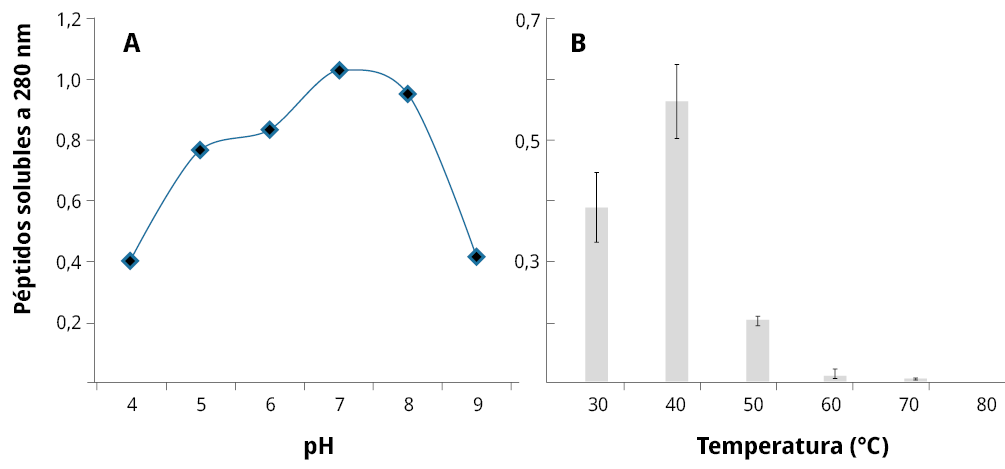
Figura 3. Determinación de la estabilidad de las proteasas semipurificadas en este estudio. A) Efecto del pH y B) Efecto de la temperatura.
Como se observa en la figura, el extracto mostró un amplio intervalo de actividad (entre 5 y 8), siendo el pH 7 donde presentó el máximo valor de actividad. Este resultado muestra similitud con lo reportado por Sinche (2009), quien encontró que las proteasas contenidas en el latex de Vasconcella stipulata tienen su máxima actividad entre 7 y 8. Sin embargo, no coincide con el mostrado por otras proteasas de origen vegetal. Graterol et al. (2007) aislaron una proteasa a partir de Thevetia ahouai, y presentó baja actividad hasta pH 7 y su máximo a pH 8. Por su parte, Rocha et al. (2010) aislaron una proteasa a partir de Salpichroa origanifolia, y tuvo su máxima actividad a pH inferiores de 5 (encontrándose el máximo a 3,5). Es conveniente mencionar que el intervalo donde las enzimas presentan su actividad va a depender de la función que cumplen en el fruto, la planta o, en este caso, la semilla.
En lo que respecta al efecto de la temperatura sobre la actividad (Figura 3B), como se utilizaron valores de temperaturas con una variación de 10 ℃, es posible sugerir que las proteasas tienen una máxima estabilidad entre un intervalo de 35 y 45 ℃. Este resultado difiere de los encontrados por Asif-Ullah et al. (2006), quienes aislaron una proteasa de Cucumis trigonus y su óptimo de temperatura fue de 70 ℃. Sin embargo, el resultado obtenido en el estudio concuerda con el sugerido por Antão y Malcata (2005) para este tipo de enzimas, pues estos autores sugieren que la temperatura óptima está entre 20 y 50 ℃.
Con una estabilidad térmica como la observada, es posible sugerir su incorporación en procesos industriales que no requieran temperaturas tan altas, como un suavizador de carne, que por lo general actúa a temperatura ambiente.
Conclusiones
Se diseñó una metodología que permitió recuperar gran parte de la actividad proteolítica presente en el grano. Se demostró que el proceso de fermentación afecta la tasa de recuperación enzimática en comparación a la extracción hecha en granos sin fermentar. Se logró obtener un extracto parcialmente purificado con una baja presencia de contaminantes. El extracto mostró actividad entre los pH 5 y 8, siendo 7 donde presentó el máximo valor de actividad y su óptimo de temperatura fue entre 35 y 45 ℃.
Referencias
Abdala, A.; Takeda, l.; Freitas J. y Alves, K., 1999. Purification and partial characterization of Phaseolus vulgaris seed aminopeptidase. En: Brazilian Journal Medicine Biology Research, 32(12), pp. 1489-92. DOI: https://doi.org/10.1590/s0100-879x1999001200006.
Alberto, M.; Savón, L.; del Rivero, M.A. y Farruggia, B., 2014. Digestibilidad in vitro de la proteína con crudos enzimáticos, obtenidos de residuos de matadero [En línea]. En: Revista Cubana de Ciencia Agrícola, 48(4), pp. 353-357. [Consulta: 13 de octubre de 2023]. Disponible en: https://www.redalyc.org/pdf/1930/193033033008.pdf
Antão, C. y Malcata, X., 2005. Plant serine proteases: biochemical, physiological and molecular features. En: Plant Physiology and Biochemistry, 43(1), pp. 637–650. DOI: https://doi.org/10.1016/j.plaphy.2005.05.001.
Asif-Ullah, M.; Kim, K-S y Yu, YG., 2006. Purification and characterization of a serine protease from Cucumis trigonus Roxburgui. En: Phytochemistry, 67(1) pp. 870–5.DOI. https://doi.org/10.1016/j.phytochem.2006.02.020.
Budič, M.; Cigić, B.; Šoštarič M.; Sabotič, J.; Meglič, V.; Kos J. y Kidrič, M., 2016. The response of aminopeptidases of Phaseolus vulgaris to drought depends on the developmental stage of the leaves. En: Plant Physiology and Biochemistry, 109(1), pp. 326-336. DOI: https://doi.org/10.1016/j.plaphy.2016.10.007.
Çabuk, B.; Nosworthy, M.G.; Stone, A.K.; Korber, D.R.; Tanaka, T.; House, J.D. y Nickerson, M.T., 2018. Effect of fermentation on the protein digestibility and levels of non-nutritive compounds of pea protein concentrate. En: Food Technology and Biotechnology, 56(2), pp. 257-264. DOI: https://doi.org/10.17113/ftb.56.02.18.5450
Cruz de Carvalho, M.; D’Arcy-Lameta, A.; Roy-Macauley, H.; Gareila, M.; El Maarouf, H.; Pham-Thia, A. y Zuily-Fodil, Y., 2001. Aspartic protease in leaves of common bean (Phaseolus vulgaris L.) and cowpea (Vigna unguiculata L. Walp): enzymatic activity, gene expression and relation to drought susceptibility. En: FEBS Letters, 492, pp. 242-246. DOI: https://doi.org/10.1016/S0014-5793(01)02259-1
Chávez, A.; Acevedo, S.; Valbuena, A. y Colina, M., 2016. Extracción y caracterización de proteínas recuperadas en el proceso de producción de quitosano [En línea]. En: Revista Iberoamericana de Polímeros, 17(2) pp. 102–109. [Consulta: 15 de mayo de 2023]. Disponible en: https://reviberpol.files.wordpress.com/2019/07/2016-chavez.pdf
Eltayeb, A.; Ali A.; Abou-Arab, A. y Abu-Salem, F., 2011. Chemical composition and functional properties of flour and protein isolate extracted from Bambara groundnut (Vigna subterranean) [En línea]. En: African Journal and Food Science, 5(2), pp. 82–90. [Consulta: 10 de mayo de 2023]. Disponible en: https://academicjournals.org/article/article1379513329_Eltayeb%20et%20al.pdf
Granito, M.; Frías, J.; Doblado, R.; Guerra, M.; Champ, M. y Vidal-Valverde, C., 2002. Nutritional improvement of beans (Phaseolus vulgaris) by natural fermentation. En: European Food Research and Technology, 214, pp. 226–231. DOI: https://doi.org/10.1007/s00217-001-0450-5
Granito, M.; Guinand, J.; Pérez, D. y Pérez, S., 2009. Valor nutricional y propiedades funcionales de Phaseolus vulgaris procesada: un ingrediente potencial para alimentos [En línea]. En: Interciencia, 34(2), pp. 64-70. [Consulta: 16 de marzo de 2023].
Disponible en: https://www.interciencia.net/wp-content/uploads/2018/01/064-c-GRANITO-7.pdf
Granito, M.; Valero, Y. y Zambrano, R., 2010. Desarrollo de productos horneados a base de leguminosas fermentadas y cereales destinados a la merienda escolar [En línea]. En: Archivos Latinoamericanos de Nutrición, 60(1), pp. 85-92. [Consulta: 10 de mayo de 2023]. Disponible en: https://www.alanrevista.org/ediciones/2010/1/art-13/
Graterol, H.; Amaíz, L.; Torquati, T. y Contreras, L., 2007. Determinación y caracterización parcial de proteasas obtenidas del fruto Thevetia ahouai (L.) A.DC [En línea]. En: FARAUTE Ciencia y Tecnología, 2(2), pp. 16-25. [Consulta: 10 de mayo de 2023]. Disponible en: http://servicio.bc.uc.edu.ve/facyt/v2n2/2-2-2.pdf
Kunitz, M., 1947. Crystalline soybean trypsin inhibitor, II. General properties. En: Journal Genetic and Physiology, 30(4), pp. 291-310. DOI: https://doi.org/10.1085/jgp.30.4.291
Lorenz, P. y Eck, J., 2005. Metagenomics and industrial applications. En: Nature Reviews Microbiology, 3(6), pp. 510-516. DOI: https://doi.org/10.1038/nrmicro1161
Lowry, O.; Rosebrough, N.; Farr, A. y Randall, R., 1951. Protein measurement whith the folin phenol reagent [En línea]. En: Journal Biolology and Chemestry, 193(1), pp. 265-275. [Consulta: Consulta: 10 de febrero de 2023]. Disponible en: https://pubmed.ncbi.nlm.nih.gov/14907713/
Moral, S.; Ramírez-Coutiño, L.P. y García-Gómez, M., 2015. Aspectos relevantes del uso de enzimas en la industria de los alimentos. Revista Iberoamericana de Ciencias, 2(3), 87-102. [Consulta: 16 de octubre de 2023]. Disponible en: http://www.reibci.org/publicados/2015/mayo/1000102.pdf.
Ojeda, L.; Noguera, N.; Hurtado, D.; Iamarino, M. y Hernández, S., 2012. Obtención de un extracto proteolítico con potencial uso en la industria farmacéutica [En línea]. En: Avances en Ciencias de la Salud, 2(1), pp. 44-49. [Consulta: 02 de enero de 2023]. Disponible en: http://servicio.bc.uc.edu.ve/fcs/avances/vol2n1/art07.pdf
Ojeda, L.; Zoghbi, N.; Noguera-Machado, N.; Lucero, L.; Meléndez, G. y Triana, J., 2020. Extracción y purificación parcial de peroxidasa de rabano (Raphanus sativus) [En línea]. En: Revista Iberoamericana de Ciencias, 7(1), pp. 50-56. [Consulta: 10 de febrero de 2023]. Disponible en: http://www.reibci.org/publicados/2020/jul/3900104.pdf
Peña, C. y Quirasco, M., 2014. ¿Enzimas en los alimentos? Bioquímica de lo comestible [En línea]. En: Revista Digital Universitaria, 15(12), pp.1-13. [Consulta: 10 de junio de 2023]. Disponible en: https://www.revista.unam.mx/vol.15/num12/art94/art94.pdf
Perazzini, R.; Leonardi, D.; Ruggeri, S.; Alesiani, D.; D´Arcangelo, G. y Canini, A., 2008. Characterization of Phaseolus vulgaris L. landraces cultivated in central Italy. En: Plant Food for Human Nutrition, 63(4), pp. 211-218. DOI: https://doi.org/10.1007/s11130-008-0095-7.
Pérez, S. y Granito, M., 2015. Formulación de emulsiones estabilizadas con concentrados proteicos de granos fermentados y sin fermentar de Phaseolus vulgaris [En línea]. En: Revista de la Facultad de Agronomía del Zulia, 32(2), pp. 261-281. [Consulta: 16 de marzo de 2023]. Disponible en: https://produccioncientificaluz.org/index.php/agronomia/article/view/27183
Prados, F.; Pino, A. y Fernández-Salguero, J., 2007. Effect of a powdered vegetable coagulant from cardoon Cynara cardunculus in the accelerated ripening of Manchego cheese. En: International Journal of Food Science and Technolology, 42(5), pp. 556-561. DOI: https://doi.org/10.1111/j.1365-2621.2006.01271.x
Rocha, G.; Fernández, G. y Parisi, M., 2010. Estudios de caracterización cinética y fisicoquímica de una proteinasa aspártica aislada de frutos maduros de Salpichroa origanifolia [En línea]. En: Información Tecnológica, 21(2), pp.21-28. [Consulta: 10 de febrero de 2023]. Disponible en: https://www.scielo.cl/pdf/infotec/v21n2/art04.pdf
Sinche, M., 2009. Aislamiento, purificación parcial y caracterización cinética de las proteasas presentes en el látex de los frutos de una planta del género Vasconcella [En línea]. Quito: Escuela Politécnica Nacional. (Tesis de Grado). [Consulta: 22 de abril de 2023]. Disponible en: https://bibdigital.epn.edu.ec/handle/15000/1661.
Troncoso, F.; Sánchez, D. y Ferreira M., 2022. Production of plant proteases and new biotechnological applications: an updated review. En: Chemistry Open, 11(3), pp. 1-38. DOI: https://doi.org/10.1002/open.202200017
Vairo-Cavalli, S.; Silva, S.; Cimino, C.; Malcata, X. y Priolo, N., 2008. Hydrolysis of caprine and ovine milk proteins, brought about by aspartic peptidases from Silybum marianum flowers. En: Food Chemistry, 106(3), pp. 997-1003. DOI: https://doi.org/10.1016/j.foodchem.2007.07.015


