Es conocida la capacidad de algunos microorganismos de estimular el crecimiento y desarrollo de las plantas. Sin embargo, el uso de levaduras de la industria cervecera como agentes promotores del crecimiento de plantas (PGPM, por sus siglas en inglés) ha sido brevemente estudiado. El objetivo de este trabajo fue caracterizar y analizar el uso de la levadura residual de la fabricación de cerveza artesanal en cultivos hidropónicos. Se evaluó el efecto de la adición de dicha levadura en el crecimiento y desarrollo de Arabidopsis thaliana, Eruca vesicaria y Lactuca sativa en almácigos y en sistemas hidropónicos. Se observó un aumento significativo en el largo de la raíz principal luego del tratamiento con las suspensiones de levadura en A. thaliana y E. vesicaria crecidas en almácigos (SN 4.28 ± 0.15, S05 7.30 ± 0.29; SN 39.68 ± 2.20, S05 57.37 ± 2.80, respectivamente). En sistemas hidropónicos de raíz flotante, la inoculación de levadura a la solución hidropónica incrementó un 30 % el área radicular de L. sativa en relación con el control. Se concluye que la inoculación de S. cerevisiae cepa J14 aislada del residuo de la elaboración de cerveza, sola o incorporada a la solución nutritiva de sistemas hidropónicos, podría ser una herramienta biotecnológica como bioestimulante y/o promotor del crecimiento vegetal.
Palabras clave: PGPM, sustentabilidad, Arabidopsis thaliana, Eruca vesicaria, Lactuca sativa.
A capacidade de alguns microrganismos de estimular o crescimento e desenvolvimento de plantas é conhecida. No entanto, o uso de levedura residual da indústria cervejeira artesanal como agente promotor de crescimento vegetal (PGPM, por sua sigla em inglês) tem sido brevemente estudado. O objetivo deste trabalho foi caracterizar e analisar o uso de levedura residual da indústria cervejeira em hortaliças hidropônicas. Nós avaliamos os efeitos da adição de levedura no crescimento de plantas de Eruca vesicaria, Arabidopsis thaliana e Lactuca sativa com esta técnica. Um aumento significativo no comprimento da raiz principal e no número de raízes laterais foi observado após o tratamento com as suspensões de levedura em A. thaliana e E. vesicaria cultivadas em mudas (SN 4.28 ± 0.15, S05 7.30 ± 0.29; SN 39.68 ± 2.20, S05 57.37 ± 2.80, respectivamente). Em sistemas hidropônicos de raízes flutuantes, a inoculação de leveduras à solução hidropônica aumentou a área radicular de L. sativa em 30 % em relação ao controle. Nossos resultados confirmam que a estirpe J14 de Saccharomyces cerevisiae da indústria cervejeira pode prover benefícios em cultivos hidropônicos com efeitos positivos no crescimento radicular. Esses resultados validam a potencial aplicação da cepa J14 de S. cerevisiae no cultivo de plantas em hidroponia como ferramenta biotecnológica.
Palavras-chave: PGPM, sustentabilidade, Arabidopsis thaliana, Eruca vesicaria, Lactuca sativa.
Introducción
La hidroponía es un método de cultivo de plantas que utiliza nutrientes en su forma inorgánica disueltos en una solución líquida, con o sin la utilización de sustratos. En esta técnica las raíces se sumergen en la solución nutritiva, la cual presenta los macronutrientes y micronutrientes necesarios para su crecimiento y desarrollo (Sambo, et al., 2019). Esta metodología se utiliza especialmente en áreas áridas, donde los requerimientos hídricos son limitantes (Martínez-Mate, et al., 2018). Actualmente la producción de alimentos es uno de los retos de sostenibilidad y sustentabilidad más importante del siglo XXI debido al rápido crecimiento de la población. Sin embargo, la tierra es un recurso limitado y más del 33 % de los suelos ya no son aptos para el cultivo debido a la contaminación, entre otras actividades antropogénicas (Abhilash, et al., 2016). En este escenario, el cultivo hidropónico podría significar una herramienta para abordar dicha problemática. Con esta técnica se pueden producir cultivos sin el uso de suelo, pesticidas o agroquímicos, promoviendo la generación de cultivos sustentables, la economía circular y las huertas urbanas (Baras, 2018; Bekuma, 2019). La hidroponía popular, por su parte, ha sido incentivada a través del Proyecto Regional para la Superación de la Pobreza en América Latina y el Caribe (RLA/86/004) y se trata de una técnica que continúa en auge (Marulanda e Izquierdo, 2003).
El componente microbiano del holobionte vegetal consiste en diferentes tipos de organismos, entre los que se incluyen hongos, arqueas y bacterias (Hardoim, et al., 2015). Se ha demostrado que el uso de rizobios, micorrizas y bacterias promotoras del crecimiento vegetal cumplen funciones importantes que respaldan el desarrollo y la salud de las plantas (Philippot, et al., 2013). Por tal motivo, se ha descripto a determinados microorganismos como promotores del crecimiento de las plantas (PGPM, por sus siglas en inglés). Las interacciones entre plantas y PGPM pueden ocurrir a través de una variedad de mecanismos biológicos, directos e indirectos, entre los que se destacan: fijación biológica de N2 atmosférico por bacterias en las plantas de leguminosas, producción de quelantes capaces de convertir minerales insolubles en formas biodisponibles, producción de fitohormonas como el ácido indol-3-acético (IAA), las citoquininas, las giberelinas y otros mecanismos relacionados con el control biológico (Naamala y Smith, 2020; Glick, 2012).
En las últimas tres décadas, los PGPM han mostrado potencial para ser aplicados como biofertilizantes o bioplaguicidas (Compant, et al., 2019; Villanueva, 2021). De esta forma, los PGPM podrían tener un papel importante en la agricultura sostenible ya que su aplicación podría ayudar a aumentar la fertilidad de los suelos, la calidad alimentaria y nutricional, así como también mejorar la sustentabilidad de los agroecosistemas (Abhilash, et al., 2019).
La cerveza es la bebida resultante del proceso de fermentación del mosto procedente de la malta de cebada (sola o mezclada y aromatizada con lúpulo) mediante levadura, principalmente Saccharomyces cerevisiae (código alimentario argentino, CAA Art. 1080). Durante el proceso de elaboración, en la industria cervecera se generan dos subproductos de mayor importancia: el bagazo y la levadura (Ramayo Cruz, 2018). La cantidad de levadura residual obtenida depende de los parámetros de fermentación (aireación, temperatura y pH), el tipo de microorganismo, la concentración de inóculo y la viabilidad y vitalidad de las células, entre otros. La masa de levadura resultante durante el proceso de elaboración varía entre 1,5 y 3 kg por cada 100 L de cerveza producidos (Olajire, 2012). Ese barro obtenido es retirado de los fermentadores, en algún caso reutilizado, y luego desechado.
Se ha identificado una gran variedad de géneros de levadura pertenecientes a la microbiota de la superficie de las plantas. Varios de ellos han sido identificados como PGPM y/o agentes de biocontrol contra enfermedades en diferentes tejidos vegetales (Mukherjee, et al., 2020). Se demostró en una variedad de géneros de levadura la producción de auxinas, solubilización de fosfatos, oxidación de nitrógeno, oxidación de azufre y producción de sideróforos (El-Tarabily y Sivasithamparam 2006; Nassar, et al., 2005, Falih, et al., 1995 y Cloete, et al., 2009). Particularmente, se evidenció que la adición de Saccharomyces cerevisiae como biofertilizante en el suelo induce cambios morfológicos, aumenta la biomasa de las raíces y el contenido de nitrógeno (N) y fósforo (P) en plantas de tomate (Solanum lycopersicum), y de caña de azúcar (Saccharum officinarum x spontaneum) (Lonhienne, et al., 2015). Sin embargo, la mayoría de los efectos mencionados anteriormente de Saccharomyces cerevisiae han sido estudiados en el sistema de suelo, mientras que su asociación en los cultivos hidropónicos ha sido brevemente analizado.
El objetivo general de este trabajo fue caracterizar y analizar el uso de la levadura residual de la fabricación de cerveza artesanal en cultivos hidropónicos. Para ello se evaluó el efecto de la inoculación de levadura en los procesos de germinación, crecimiento y desarrollo de plantas de Eruca vesicaria spp. (rúcula), Arabidopsis thaliana, ambas de la familia de las Brassicaceae, y de Lactuca sativa spp. (lechuga), de la familia de las Asteraceae, en el cultivo hidropónico. Se evaluaron parámetros de crecimiento y desarrollo en la fase de semilla-plántula y de plántula-planta.
Materiales y Métodos
Aislamiento y caracterización de la levadura
Aislamiento
El aislamiento de las levaduras se realizó en el medio Hongos y Levaduras (extracto de levadura 0.5 % p/v, glucosa 2 % p/v, cloranfenicol 0.01 % p/v y agar 1.5 % p/v, marca Britania, Argentina). Para ello, se utilizó el barro de levaduras desechadas luego de la etapa de fermentación del mosto en la fabricación de cerveza artesanal. Se realizó el conteo de células/ml con cámara de Neubauer (Smart, et al., 1999) y se calculó el porcentaje de viabilidad. Se corroboró el recuento mediante técnica espectrofotométrica a una DO (densidad óptica) a 620 nm de 0.1 en espectrofotómetro (BIOTRAZA® modelo 721). Posteriormente se realizaron las diluciones apropiadas a fin de obtener 1000 células/ml de levaduras para los ensayos.
Caracterización
Se caracterizaron las levaduras mediante la amplificación de la región D1-D2 del gen de la subunidad grande ribosomal (LSU) con los cebadores NL1 (5′GCATATCAATAAGCGGAGGAAAAG-3′) y NL4 (5′-GGTCCGTGTTTCAAGACGG-3′), de acuerdo con Kurtzman y Robnett (1997). Las reacciones de PCR se realizaron en un termociclador Rotor Gene Q (Qiagen, Hilden, Alemania) con una mezcla preformada con el intercalante Evagreen (Kapa HRM Fast, Biosystems). Luego de la amplificación, los productos de PCR fueron analizados en gel de agarosa y purificados utilizando el kit Accuprep Gel Purification Kit (Bioneer, South Korea). Los productos purificados se secuenciaron mediante el Kit BigDye Terminator v1.1 Cycle Sequencing Kit (Applied Biosystems), en el equipo ABI Prism 310 Genetic Analyzer (Applied Biosystems). Las secuencias generadas se analizaron mediante el software BLAST+2.12.0 (Boratyn, et al., 2013).
La determinación de proteínas totales se realizó en base a la metodología de Kjeldhal (AOAC International, 1984). El estudio del metabolismo nitrogenado de las levaduras se evaluó mediante la producción de aminoácidos durante el crecimiento de las cepas. La separación e identificación de los aminoácidos se realizó mediante la técnica de HPLC-MSMS, descripta por Gómez Alonso y otros (2007). Para la digestión de la muestra se utilizó un balón de 100 ml y se pesó cantidad suficiente de muestra con un contenido de aproximadamente 5 mg de proteína. Posteriormente se agregaron al balón 10 ml de solución HCl-Fenol, el cual se colocó en un manto calefactor (80 ℃) y se conectó a un refrigerante. La muestra se procesó con reflujo durante 3-4 días. Luego se trasvasó a vial de autosampler 100 ul de muestra (filtrada) y se agregó 900 ul de ACN (acetonitrilo), conservándose refrigerada a -20 ℃ de temperatura hasta efectuar la corrida cromatográfica. Las muestras fueron inyectadas en cromatógrafo LC MSMS marca Waters Xevo Infinity®, acoplado a un detector MSMS TQS Micro. Se usó la columna BEH amido 150 x 2.1 mm – Tp: 7.1 um (Waters), y los estándares de los aminoácidos cuantificados fueron provistos por SIGMA-Aldrich®.
Para la determinación de aniones y cationes, las muestras de levaduras se llevaron a cenizas en una mufla a 600 ℃ (AOAC International,1998), y luego se resuspendieron en agua. Las muestras fueron filtradas previamente con filtro de jeringa de 0.45 µm y se colocaron en tubos de plástico limpios y secos. Posteriormente se analizaron mediante cromatografía iónica. Se utilizó un cromatógrafo iónico, modelo 940 Professional IC Vario, Metrohm®. Se utilizó la columna Metrosep Supp 5 – 150/4.0 para la corrida cromatográfica de aniones, y la columna Metrosep C4 150/4.0 para la corrida cromatográfica de cationes. Las columnas se encontraban termostatizadas a 30 ℃. El flujo para aniones fue 0.7 ml/min y para cationes, 0.9 ml/min.
Materiales vegetales
Se utilizaron semillas de A. thaliana ecotipo Columbia (COL-0), obtenidas del Arabidopsis Biological Resource Center (ABRC, Columbus, OH), y semillas de E. vesicaria, obtenidas de un proveedor local para los ensayos de germinación. En los ensayos de crecimiento y desarrollo radicular se utilizaron plántulas de L. sativa, A. thaliana ecotipo Columbia (COL-0) y E. vesicaria, obtenidas de un proveedor local.
Soluciones nutritivas
Las soluciones nutritivas se basaron en la fórmula de Resh (Resh, 2015). En los ensayos de germinación y crecimiento en almácigos se utilizó una concentración de 3x10-3 % v/v SNCRc (solución nutritiva convencional de Resh concentrada) (SNCR1), mientras que en los ensayos con la técnica de raíz flotante se usó una concentración de 5x10-3 % v/v de SNCRc (SNCR2). La concentración de SNCRc fue para los macronutrientes nitrógeno: 140 ppm, fósforo: 50 ppm, potasio: 352 ppm, calcio: 180 ppm, magnesio: 50 ppm, azufre: 168 ppm, hierro: 5 ppm y de micronutrientes manganeso: 0.8 ppm, cobre: 0.07 ppm, zinc: 0.2 ppm, boro: 0.3 ppm, molibdeno: 0.03 ppm.
Condiciones de crecimiento
Ensayos de germinación
Las semillas se esterilizaron superficialmente con etanol al 70 % v/v durante 10 min, con 35 % v/v de solución de hipoclorito de sodio comercial durante 1 min, y se enjuagaron cinco veces con agua estéril. Las semillas se estratificaron a 4 ℃ ± 1 durante 3 días en la oscuridad. El ensayo de germinación se realizó en placas de Petri conteniendo papel de filtro embebido con 15 ml de la solución nutritiva de hidroponía SNCR1 (SN) o 15 ml de solución de levaduras 1000 células/ml (S05). Se dispusieron las placas en forma horizontal en una cámara a 20 ℃ ± 4 ℃ a 16 h de luz y 8 h de oscuridad. La tasa de germinación se evaluó mediante la cuantificación del porcentaje de germinación luego de 48, 72 y 96 h. El evento de germinación se definió como la total emergencia de la radícula (Bewley y Black, 1978; Weigel y Glazebrook, 2002).
Ensayos de crecimiento en sustrato de cultivo hidropónico
El crecimiento de plántulas de A. thaliana y E. vesicaria en sustrato de cultivo hidropónico se realizó en bandejas conteniendo fibra de coco (constituido principalmente por lignina, celulosa y hemicelulosa) (Rincón Reyna, et al., 2016). Se sembraron las semillas esterilizadas y estratificadas sobre el sustrato y las bandejas se regaron una vez al día con agua destilada (control), con la solución nutritiva SNCR1 (SN) o con la solución de levaduras 1000 células/ml (S05).
Ensayos de crecimiento en sistema hidropónico de raíz flotante
En sistemas hidropónicos de raíz flotante se utilizaron plantas de L. sativa de 4 hojas verdaderas. El sistema se irrigó durante 30 días con la solución nutritiva (control, SNCR2), con la solución de levaduras (S05, 1000 células/ml) o con la solución nutritiva inoculada con la solución de levaduras S05 (1000 células/ml). Luego se realizó un recambio de todas las soluciones traspasando todas las plantas a una nueva solución nutritiva (SNCR2) por un periodo de 30 días.
Análisis del desarrollo vegetal
Análisis de raíces
Las plantas de E. vesicaria y A. thaliana cultivadas en fibra de coco se cosecharon a los 21 y 14 días respectivamente, y se fotografiaron. Se cuantificó el crecimiento de la raíz principal y las raíces laterales mediante el programa de procesamiento de imágenes FIJI (Weigel y Glazebrook, 2002; Malamy y Benfey 1997, Schindelin, et al., 2012). Se analizó el área foliar de plantas de L. sativa de 15 y 60 días crecidas en sistema hidropónico de raíz flotante (Weigel y Glazebrook, 2002). El sistema radicular de cada una de las plantas se fotografió y se cuantificó el área radicular mediante el programa de procesamiento de imágenes FIJI (IJ1.46r) (Schindelin, et al., 2012)
Análisis del área foliar y verdor
Se analizó el área foliar y el verdor de las hojas de plantas de L. sativa de 15 y 60 días crecidas en sistema hidropónico de raíz flotante (Weigel y Glazebrook, 2002). Cuatro hojas de cada una de las plantas se escanearon (CannonScan lide 60). Se cuantificó el área foliar mediante el programa de procesamiento de imágenes FIJI (IJ1.46r) (Schindelin, et al., 2012) y se realizó un análisis sobre del color de las hojas de lechuga con el software CIELAB (Yam y Papadakis, 2004).
Análisis estadísticos
Los valores indicados corresponden a valores medios ± el error estándar de al menos 3 experimentos independientes. Se evaluaron 17 plantas de E. vesicaria, 21 plantas de Arabidopsis thaliana y 4 plantas de L. sativa para cada condición experimental. En los ensayos de germinación, la estimación de las diferencias estadísticamente significativas entre el control y el tratamiento con la levadura se realizó mediante el test de Mann-Whitney, con un intervalo de confianza del 95 %. Los datos obtenidos de los ensayos de largo del hipocótilo (mm) y de la raíz principal (mm), el número de raíces laterales, el área radicular (mm2), el área foliar (mm2) y el verdor de las hojas (UA) se analizaron mediante ANOVA, test de comparación múltiple Tukey, con 95 % de intervalo de confianza. Para ello se utilizó el programa GraphPad Prism (GraphPad Prism, 2007).
Resultados
Identificación y caracterización química de las levaduras
Los análisis realizados sobre la identificación de la levadura comercial S05 mediante análisis bioinformático BLAST (Boratyn, et al., 2013) evidenciaron un 98.8 % de homología con la levadura Saccharomyces cerevisiae cepa J14 (GenBank ID: KY606270.1).
El estudio del metabolismo nitrogenado de la levadura S. cerevisiae reveló un porcentaje mayor al 10 % para el ácido glutámico en g/100 g de proteína. Para los aminoácidos ácido aspártico, valina, glicina, fenilalanina, tirosina, lisina y leucina los porcentajes fueron entre 5 y 10 %; para isoleucina, prolina, treonina, alanina, arginina, hidroxiprolina los porcentajes fueron entre 1 y 5 %. El resto de los aminoácidos se encontraron en valores menores al 1 % (Figura 1).
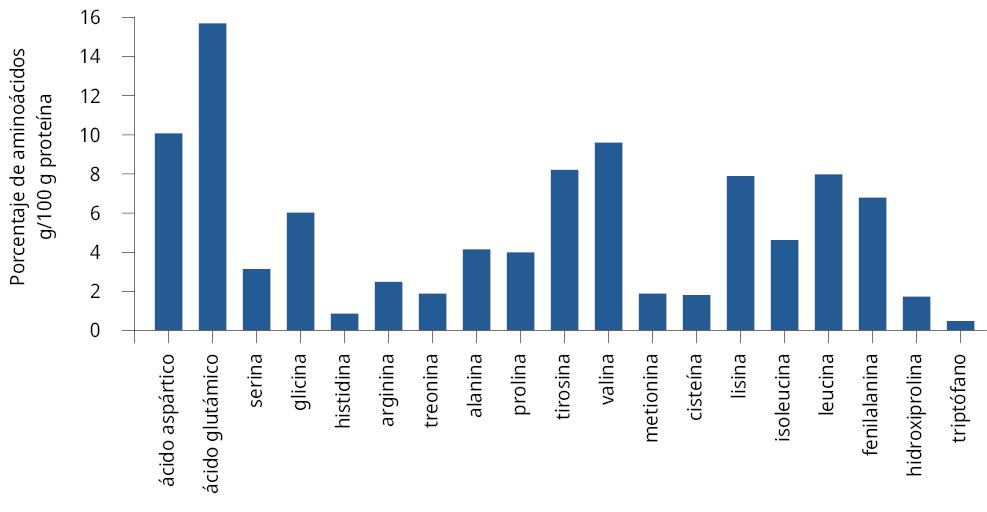
Figura 1. Determinación del contenido de aminoácidos de la levadura S05 (porcentaje de aminoácidos/100 g proteínas).
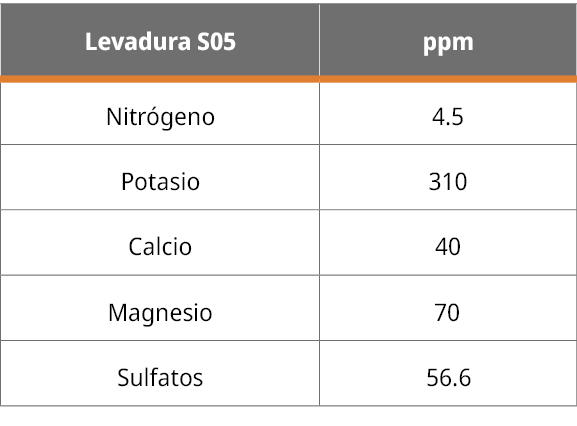
En la siguiente Tabla 1 se observa la determinación de aniones y cationes de la muestra de levadura S. cerevisiae.
Tabla 1. Concentración en ppm de macronutrientes principales encontrados en las cenizas de la levadura S05.
Análisis de tasa de germinación y crecimiento vegetal
Se evaluó la tasa de germinación y el crecimiento de plántulas de E. vesicaria y A. thaliana en sustrato de cultivo hidropónico frente al tratamiento con la levadura S. cerevisiae. La tasa de germinación de las semillas de E. vesicaria y A. thaliana tratadas con S. cerevisiae no presentó diferencias significativas respecto al tratamiento control (solución nutritiva, SN) (Figura 2).
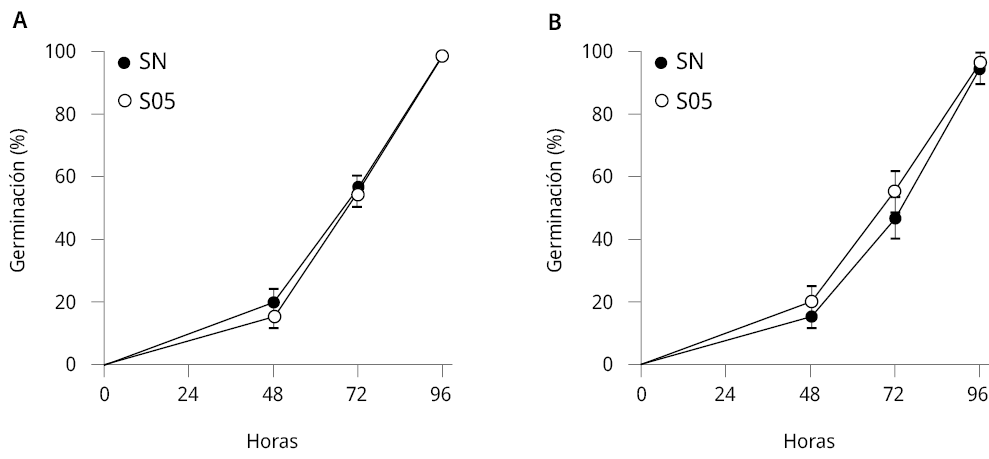
Figura 2. Tasa de germinación de semillas de A. thaliana y E. vesicaria durante 96 horas. Porcentaje (±SE) de semillas germinadas a las 48, 72 y 96 h luego de la siembra de A) E. vesicaria y B) A. thaliana. Se realizaron 2 experimentos independientes, n ≥ 11. Mann-Whitney test, intervalo de confianza 95 %.
En base a los resultados obtenidos en el análisis del proceso de germinación in vitro, se analizó la acción promotora del crecimiento vegetal de la levadura S. cerevisiae en plántulas de E. vesicaria y A. thaliana en almácigos. Los tratamientos con las soluciones de levaduras estimularon el crecimiento de la raíz principal con diferencias significativas respecto al control (SN) para ambas especies de las plántulas analizadas (Figura 3C-D). El tratamiento con S. cerevisiae aumentó un 42.5 % el crecimiento de la raíz de E. vesicaria y un 70.6 % el largo de la raíz primaria de A. thaliana. Sin embargo, no se observaron diferencias significativas en el tamaño de los hipocótilos en ninguna de las plántulas analizadas respecto al control.
Se analizó el número de raíces laterales de E. vesicaria crecidas en almácigos. Se observó un aumento significativo en el número de las raíces laterales luego del tratamiento con la solución de S. cerevisiae respecto a las plántulas control (SN) (Figura 3E).
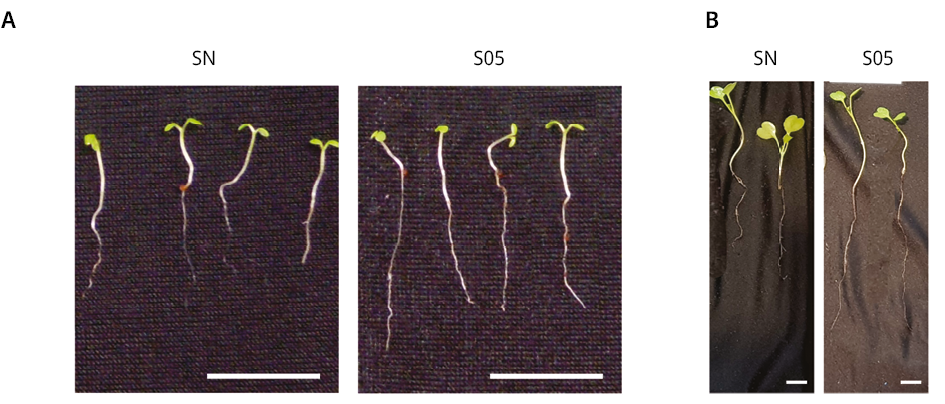
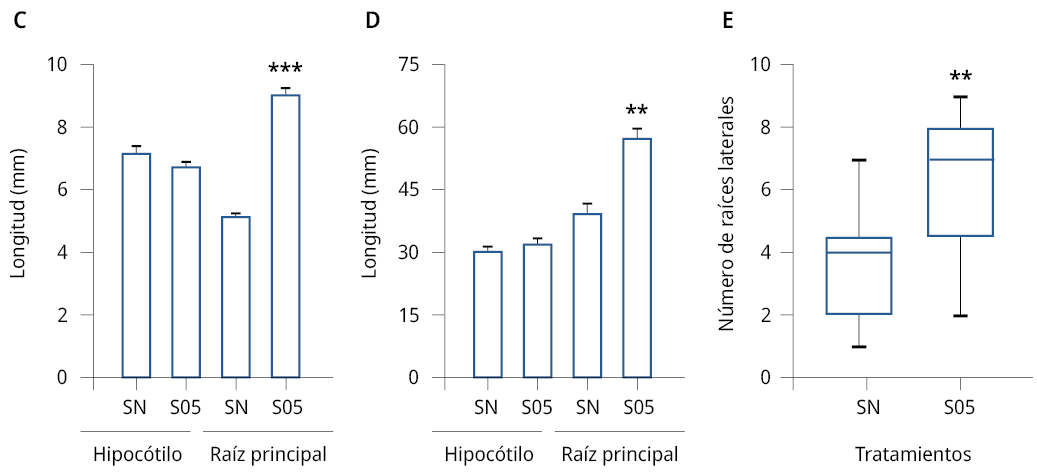
Figura 3. Caracterización morfológica de plántulas de A. thaliana y E. vesicaria crecidas en almácigos en sustrato de cultivo hidropónico. Imágenes de plántulas de A) A. thaliana de 14 días de edad y B) E. vesicaria de 21 días de edad, crecidas en fibra de coco y tratadas con solución nutritiva, SNCR1 (SN) o con solución de levaduras S05 1000 células/ml (S05). C) Longitud en mm (±SE) de hipocótilos y de la raíz principal de A. thaliana. D) Longitud en mm (±SE) de hipocótilos y de la raíz principal de E. vesicaria. Se realizaron tres experimentos independientes, n > 34. Los asteriscos indican diferencias significativas respecto al correspondiente control de cada tratamiento (*) = P ≤ 0.01, (**) = P ≤ 0.001 (test de t), (***) = P ≤ 0.0001. E) Número de raíces laterales (±SE) de E. vesicaria para cada uno de los tratamientos mencionados. Se realizaron tres experimentos independientes, n > 8. Los asteriscos indican diferencias significativas respecto al control (SN) (**) = P ≤ 0.001. ANOVA, test de comparación múltiple Tukey, 95 % intervalo de confianza. Barra 10 mm.
La evidencia presentada hasta el momento permite inferir que la levadura utilizada S. cerevisiae cepa J14 presenta características favorables como organismo promotor del crecimiento vegetal para su uso en almácigos en sustrato de cultivo hidropónico. Los resultados en E. vesicaria y A. thaliana demuestran que los efectos estimulantes del desarrollo son independientes de la especie.
Con el objetivo de explorar la aplicación de S. cerevisiae en el sistema de cultivo hidropónico de raíz flotante, se analizó el crecimiento y desarrollo de plantas de L. sativa bajo el tratamiento con la solución de levaduras durante 60 días.
Tal como se esperaba, al inocular la solución nutritiva con la levadura S05 (S05+SN) se incrementó significativamente el área radicular de L. sativa en relación con el control a los 15 y 60 días (SNCR2, SN) (Figura 4A). A los 60 días de crecimiento en el sistema hidropónico suplementado con S. cerevisiae, el área radicular de L. sativa aumentó un 30 % respecto al tratamiento sin inocular. Respecto a la parte aérea, el tratamiento de inoculación de la solución nutritiva con la levadura S05 (S05+SN) aumentó significativamente el área foliar a los 15 días de cultivo respecto al control (Figura 4B). Sin embargo, luego de 60 días no se encontraron diferencias significativas en la parte aérea entre el tratamiento control y el tratamiento de inoculación de la solución nutritiva con la levadura. Como un indicador de calidad de los vegetales se realizó un análisis sobre el color de las hojas de lechuga. Las plantas crecidas bajo la inoculación de la solución nutritiva con la levadura S05 (S05+SN) presentaron diferencias significativas en el verdor de las hojas a los 60 días de cultivo (Figura 4C). Las plantas bajo el tratamiento de inoculación de la solución nutritiva con la levadura S05 (S05+SN) mostraron un aumento del área radicular, acompañado de un aumento del verdor de las hojas.
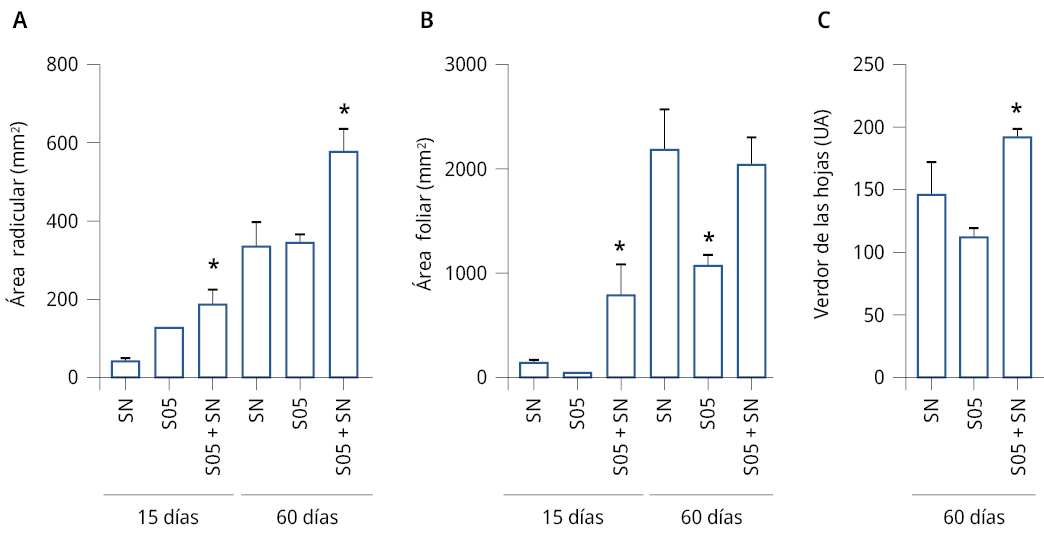

Figura 4. Área radicular, foliar y verdor de hojas de L. sativa en cultivo hidropónico con o sin inoculación con S05. A) Área (±SE) del sistema radicular (mm2) a los 15 y 60 días. B) Área (±SE) del sistema foliar (mm2) a los 15 y 60 días. C) Verdor (±SE) de las hojas (unidades arbitrarias) a los 60 días. D) Imágenes de plantas representativas para cada uno de los tratamientos: tratamiento control, solución nutritiva SNCR2 (SN), solución de levaduras (S05) y solución nutritiva inoculada con la solución levaduras S05 (SN+S05). Se realizaron 2 experimentos independientes, n = 4. Los asteriscos indican diferencias significativas respecto al correspondiente control de cada tratamiento (*) = P ≤ 0.05. ANOVA, test de comparación múltiple Tukey, 95 % intervalo de confianza. Barra = 5 cm.
Estos resultados indican un potencial uso de la levadura S. cerevisiae como estimulador del desarrollo en plantas de L. sativa crecidas bajo el sistema de cultivo hidropónico.
Discusión
Este trabajo indica un potencial efecto promotor del desarrollo radicular por parte de la levadura S. cerevisiae cepa J14 en plantas de A. thaliana, E. vesicaria y L. sativa. La aplicación de S. cerevisiae cepa J14 en cultivo hidropónico representa una estrategia de sostenibilidad basada en los principios de circularidad y una alternativa a los productos sintéticos. En línea con estos resultados, se ha descripto el efecto promotor del crecimiento vegetal por parte de S. cerevisiae en plantas de Solanum lycopersicum (tomate) y Saccharum officinarum x spontaneum (caña de azúcar) crecidas en suelo suplementado con S. cerevisiae (Lonhienne, et al., 2015). En dicho trabajo, las plantas de tomate cultivadas en presencia de levadura aumentaron la biomasa de las raíces en un 56 % en comparación con los controles cultivados sin suplemento de levadura. Del mismo modo, las plantas de caña de azúcar tratadas con levadura viva mostraron un 47 % más de biomasa en las raíces en relación con los controles. Similares reportes de la acción promotora del crecimiento radicular por levaduras se presentan en los trabajos de Cloete y otros (2009) y Amprayn y otros (2012) en plantas de Agathosma betulina y Oryza sativa, respectivamente. Paradiso y otros (2017) han demostrado que la aplicación de PGPM produce un aumento significativo en el desarrollo vegetal, la actividad fotosintética y el rendimiento de las semillas en cultivo hidropónico respecto a plantas sin inocular. Dichos autores han utilizado un consorcio comercial conteniendo bacterias, levaduras, micorrizas y Trichoderma en el cultivo hidropónico de Glycine max. En este sentido sería interesante estudiar el tratamiento de asociaciones entre la levadura S. cerevisiae y bacterias u hongos benéficos en el crecimiento de las plantas cultivadas en el sistema hidropónico.
En el presente trabajo se analizó la composición de aminoácidos y minerales de las soluciones de levaduras. En relación con los primeros, la concentración resultó mayor para los aminoácidos aspártico, glutámico, serina, histidina, arginina y prolina, y menor para el resto de los aminoácidos estudiados en comparación con otra levadura tipo S. cerevisiae usada comúnmente en la fabricación de cerveza artesanal conocida como S04 (datos no publicados). Para el caso de los minerales analizados, las concentraciones obtenidas en las levaduras resultaron menores a las de las soluciones nutritivas convencionales en casi todos los macronutrientes, excepto para el magnesio. A pesar de ello, a la luz de los resultados, las levaduras residuales de la producción de cerveza artesanal poseen potencial nutritivo para su uso en cultivo hidropónico en comparación con la composición convencional de la fórmula de Resh (Resh, 2015). En el presente trabajo se observó una mayor calidad radicular y foliar en las plantas inoculadas con S. cerevisiae. Asimismo, se observó un aumento significativo en el color del tejido fotosintético de las hojas de las plantas de L. sativa tratadas con solución nutritiva inoculada con S. cerevisiae respecto al tratamiento sin inocular. Hay reportes que demuestran que el tratamiento con levaduras incrementa el contenido nutricional vegetal. Joshi y otros (2018) reportaron el uso de S. cerevisiae en el cultivo de forraje hidropónico para alimentación de animales de granja. Ensayos realizados por Bedolla-Torres y otros (2015) demostraron que la irrigación de los géneros de levaduras Debaryomyces, Candida y Yarowia incrementó el contenido nutricional del forraje verde hidropónico de Zea mays.
Por otro lado, el trabajo realizado por Abdul y Hussein (2020) informa que el mecanismo biológico de risofagia podría explicar el efecto observado en la promoción del crecimiento vegetal por parte de la levadura S. cerevisiae en plantas de L. sativa en cultivo hidropónico. Bajo el sistema de cultivo hidropónico demostraron que las células de levadura se adhieren alrededor de las células de la raíz de L. sativa, donde posteriormente son fagocitadas por estas mismas y digeridas para obtener sustancias nutritivas. Sin embargo, se han reportado otros mecanismos por los cuales las levaduras tienen la capacidad de promover el desarrollo vegetal, entre ellos se destacan la producción de fitohormonas, aminoácidos, NH3, solubilización de fosfato inorgánico y zinc, y la captura de hierro a través de sideróforos (Amprayn, et al., 2012; Freimoser, et al., 2019; Nutaratat, et al., 2014). Las levaduras han sido descriptas como potentes antagonistas de varios patógenos vegetales. En las revisiones realizadas por los autores Freimoser y otros (2019) y Mukherjee y otros (2020) se examina la aplicación agrícola de la levadura S. cerevisiae y se destaca la escasez de estudios sobre los mecanismos de control biológico tanto para usos en el suelo como en sistemas hidropónicos. Queda mucho por revelar y se requieren investigaciones referidas a los posibles mecanismos biológicos mediante los cuales S. cerevisiae cepa J14 estimula el desarrollo de la radícula; como así también estudios que indiquen los posibles mecanismos de control biológico de S. cerevisiae, generando oportunidades para el desarrollo de aplicaciones comerciales. Los resultados observados bajo las condiciones experimentales de nuestro estudio abren una puerta para futuros desarrollos agronómicos relacionados a la producción de bioestimulantes a partir de subproductos y su uso en cultivo hidropónico.
Referencias
Abdul Ameer, M. A. y Hussein, H. F., 2020. Induction of Rhizophagy by yeast Saccharomyces cerevisiae in roots of lettuce Lactuca sativa roots of lettuce Lactuca sativa. En: J. Phys.: Conf. Ser., 1664(1), 012116. DOI: http://dx.doi.org/10.1088/1742-6596/1664/1/012116
Abhilash, P.C., Dubey R.K., Tripathi, V., Gupta, V.K. y Singh, H.B., 2016. Plant growth-promoting microorganisms for environmental sustainability. En: Trends Biotechnol, 34(11), pp.847–850. DOI: https://doi.org/10.1016/j.tibtech.2016.05.005
Abhilash, P.C., Tripathi, V., Edrisi, S.A. Gupta, V.K. y Singh, H.B., 2019. Sustainability of crop production from polluted lands. En: Energ. Ecol. Environ., 1, pp.54-65. DOI: https://doi.org/10.1007/s40974-016-0007-x
Amprayn, K., Rose, M. T., Kecskés, M., Pereg, L., Thanh, H. y Kennedy, I.R., 2012. Plant growth promoting characteristics of soil yeast (Candida tropicalis HY) and its effectiveness for promoting rice growth. En: Appl. Soil Ecol., 61, pp.295-299. DOI: https://doi.org/10.1016/j.apsoil.2011.11.009
AOAC International, 1984. Official Methods of Analysis of AOAC International. 14a ed. Washington: AOAC. Official Method 2.062.
AOAC International, 1998. Official Methods of Analysis of AOAC International. 15a ed. Washington: AOAC. Official Method 942.05.
Baras, T., 2018. DIY hydroponic gardens: how to design and build an inexpensive system for growing plants in water. Beverly: Cool Springs Press. ISBN-10: 0760357595.
Bedolla-Torres, M. H., Palacios, A., Palacios, O. A., Choix, F. J., Jesús F. De, Valle A., López, D.R., Luis, J., Villavicencio, E., Luna, R. De, Trujillob, A. G., Avila Serranod, N. Y. y Ortega Pérez, R., 2015. La irrigación con levaduras incrementa el contenido nutricional del forraje verde hidropónico de maíz. En: Rev Argent Microbiol., 47(3), pp. 236-244. DOI: https://doi.org/10.1016/j.ram.2015.04.002
Bekuma, A., 2019. Nutritional benefit and economic value of hydroponics fodder production technology in sustainable livestock production against climate change – a mini-review. En: Adv. Appl. Sci., 4(1), pp.23-25.
Bewley, J. D. y Black M. eds., 1982. Physiology and biochemistry of seeds in relation to germination. Vol. 1. Development, germination and growth. Berlin: Springer Verlag. ISBN: 978-3-642-68643-6.
Boratyn, M. G., Camacho, C., Cooper, P. S., Coulouris, G., Fong, A., Ma, N., Madden, T. L., Matten, W.T., McGinnis, S. D., Merezhuk, Y., Raytselis, Y., Sayers, R.W., Tao, Ye J. y Zaretskaya, I., 2013. BLAST: a more efficient report with usability improvements. En: Nucleic Acids Research, 41(1), pp. 29–33, DOI: https://doi.org/10.1093/nar/gkt282
Cloete, K. J., Valentine, A. J., Stander, M. A., Blomerus, L. M. y Botha, A., 2009. Evidence of symbiosis between the soil yeast Cryptococcus laurentii and a sclerophyllous medicinal shrub, Agathosma betulina (Berg.) Pillans. En: Microb Ecol., 57(4), pp. 624-32. DOI: https://doi.org/10.1007/s00248-008-9457-9
Compant, S., Samad, A., Faist, H. y Sessitsch, A. A review on the plant microbiome: Ecology, functions and emerging trends in microbial applications. En: J. Adv., 19, pp. 29–37. DOI: https://doi.org/10.1016/j.jare.2019.03.004
El-Tarabily, K. A. y Sivasithamparam, K., 2006. Potential of yeasts as biocontrol agents of soil-borne fungal plant pathogens and as plant growth promoters. En: Mycoscience, 47, pp. 25–35. DOI: https://doi.10.1007/s10267-005-0268-2
Falih, A. M. y Wainwright, M., 1995. Nitrification, S-oxidation and P-solubilization by the soil yeast Williopsis californica and by Saccharomyces cerevisiae. En: Mycol Res, 99(2), pp. 200-204. DOI: https://doi.org/10.1016/S0953-7562(09)80886-1
Freimoser, F. M., Paula, M., Mejia, R., Tilocca, B. y Migheli, Q., 2019. Biocontrol yeasts: mechanisms and applications. En: World J Microbiol Biotechnol, 35(10), pp.154. DOI: https://doi.org/10.1007/s11274-019-2728-4
Glick, B. R., 2012. Plant growth-promoting bacteria: mechanisms and applications. En: Scientifica, ID 963401. DOI: https://doi.org/10.6064/2012/963401
Gómez Alonso, S., Gutiérrez, I. H. y García-Romero, E., 2007. Simultaneus HPLC Analysis of Biogenic Amines, amino acids and ammonium ion as aminoenone derivates in wine and beer samples. En: J. Agric. Food Chem., 55(3), pp. 608-613. DOI: https://doi.org/10.1021/jf062820m
GraphPad, 2007. Prism. Vers. 1992-2007 5.01. San Diego: GraphPad Sofware, Inc.
Hardoim, P. R., van Overbeek, L. S., Berg, G., Pirttilä, A. M., Compant, S. y Campisano, A. 2015. The hidden world within plants: ecological and evolutionary considerations for defining functioning of microbial endophytes. En: Microbiol Mol Biol Rev, 79(3), pp. 293-320. DOI: https://doi.org/10.1128%2FMMBR.00050-14
Joshi, M., Vaishnava, C. S. y Sharma, S. K., 2018. Economical analysis of feeding hydroponics maize fodder with and without supplementation of probiotic (Saccharomyces cerevisiae) in gir calves. En: Int. J. Sci. Environ. Technol, 7(3), pp. 809-814. ISSN 2278-3687
Kurtzman, C. P. y Robnett, C. J., 1997. Identification of clinically important ascomycetous yeasts based on nucleotide divergence in the 59 end of the large-subunit (26S) ribosomal DNA gene. En: J. Clin. Microbiol, 35(5), pp. 1216–1223. DOI: https://doi.org/10.1128/jcm.35.5.1216-1223.1997
Lonhienne, T., Mason, M. G., Raganm M. A., Hugenholtz, P., Schmidt y S., Paungfoo-lonhienne, C., 2015. Yeast as a biofertilizer alters plant growth and morphology. En: Crop Sci., 54(2), pp.785–790. DOI: https:// doi.org/10.2135/cropsci2013.07.0488
Malamy, J. E. y Benfey, P.N., 1997. Organization and cell differentiation in lateral roots of Arabidopsis thaliana. En: Development, 124(1), pp. 33–44. DOI: https://doi.org/10.1242/dev.124.1.33
Martínez-Mate, M. A., Martin-Gorriz, B., Martínez-Álvarez, V., Soto-García, M., Maestre-Valero, J. F. y 2018. Hydroponic system and desalinated seawater as an alternative farm-productive proposal in water scarcity areas: energy and greenhouse gas emissions analysis of lettuce production in southeast Spain. En: J Clean Prod, 172, pp.1298–310. DOI: https:// doi.org/10.1016/j.jclepro.2017.10.275
Marulanda, C. e Izquierdo, J., 2003. La huerta hidropónica popular [En línea]. Santiago: FAO. [Consulta: 1 de noviembre 2022]. Disponible en: https://www.fao.org/3/ah501s/ah501s.pdf
Mukherjee, A., Verma, J. P. y Hesham, A. E., 2020. Yeast a potential bio-agent: future for plant growth and postharvest disease management for sustainable agriculture. En: Appl Microbiol Biotechnol Yeast, 104(4), pp. 1497-1510. DOI: https://doi.org/10.1007/s00253-019-10321-3
Naamala, J. y Smith, D. L., 2020. Relevance of plant growth promoting microorganisms and their derived compounds, in the face of climate change. En: Agronomy, 10(8), pp. 1179. DOI: https://doi.org/10.3390/ agronomy10081179
Nassar, A., El-Tarabily, K. A. y Sivasithamparam, K., 2005. Promotion of plant growth by an auxin-producing isolate of the yeast Williopsis saturnus endophytic in maize (Zea mays L.) roots. En: Biol Fertil Soils, 42, pp. 97–108. DOI: https://doi.org/10.1007/s00374-005-0008-y
Nutaratat, P., Srisuk, N., Arunrattiyakorn, P. y Limtong, S., 2014. Plant growth-promoting traits of epiphytic and endophytic yeasts isolated from rice and sugar cane leaves in Thailand. En: Fungal Biol, 118(8), pp. 683–94. DOI: https://doi.org/10.1016/j.funbio.2014.04.010
Olajire, A. A., 2012. The brewing industry and environmental challenges. En: J Clean Prod, 256, 102817. DOI: https://doi.org/10.1016/j .jclepro.2012.03.003
Paradiso, R., Arena, C., Miccom V. De, Giordano, M., Aronne, G. y Pascale, S. De., 2017. Changes in leaf anatomical traits enhanced photosynthetic activity of soybean grown in hydroponics with plant growth-promoting. En: Front. Plant Sci, 8, 674. DOI: http://doi: 10.3389/fpls.2017.00674
Philippot, L., Raaijmakers, J. M., Lemanceau, P., Putten, W. H. V. D., 2013. Going back to the roots: the microbial ecology of the rhizosphere. En: Rev. Microbiol., 11, pp. 789–799. DOI: https://doi .org/10.1038/nrmicro3109
Ramayo Cruz, P., 2018. Aprovechamiento de subproductos derivados de la elaboración de cerveza artesanal. Trabajo presentado para optar al título del máster universitario en gestión de calidad y trazabilidad en alimentos de origen vegetal [En línea]. Badajoz: Universidad de Extremadura. [Consulta: 1 de marzo de 2022]. Disponible en: https://dehesa.unex.es/handle/10662/8081
Resh, M. H., 2015. Hydroponics for the home grower. Boca Ratón: CRC Press. DOI: https://doi.org/10.1201/b18069
Rincón Reyna, J. F., Rincón Reyna, P. G., Torres Maravilla, E., Mondragón Rojas, A. G., Sánchez Pardo, M. E., Arana Cuenca, A., Ortiz Moreno, A., Jiménez García, E., 2016. Caracterización fisicoquímica y funcional de la fibra de mesocarpio de coco (Cocos nucifera L.) [En línea]. En: Investigación y Desarrollo en Ciencia y Tecnología de Alimentos, 1(2), pp. 279-284. [Consulta: 1 de noviembre de 2022]. Disponible en: http://www.fcb.uanl.mx/IDCyTA/files/volume1/2/3/49.pdf
Sambo, P., Nicoletto, C., Giro, A., Pii, Y., Valentinuzzi, F., Mimmo, T., Lugli, P., Orzes, G., Mazzetto, F., Astolfi, S., Terzano, R. y Cesco, S., 2019. Hydroponic solutions for soilless production systems: issues and opportunities in a smart agriculture perspective. En: Front. Plant Sci., 10, pp.923. DOI: https://doi.org/10.3389/fpls.2019.00923
Schindelin, J., Arganda-Carreras, I., Frise, E., Kaynig, V., Longair, M., Pietzsch, T., Preibisch S., Rueden C., Saalfeld S., Schmid B, Tinevez J-Y, White DJ., Hartenstein V, Eliceiri K., Tomancak P. y Cardona, A., 2012. Fiji: an open-source platform for biological-image analysis. En: Nat Methods, 9, pp. 676–682. DOI: https://doi.org/10.1038/nmeth.2019
Smart, K., Chambers, M., Lambert, I., Jenkins, C. y Smart, C.A., 1999. Use of methylene violet staining procedures to determine yeast viability and vitality. En: J Am Soc Brew Chem, 57(1), pp. 18-23. DOI: https://doi.org/10.1094/ASBCJ-57-0018
Villanueva, N. S., 2021. Mecanismos de inducción de rizobios para reducir el estrés por sequía en las leguminosas. En: Revista de Investigaciones Altoandinas, 23(4), pp. 258-265. DOI: https://dx.doi.org/10.18271/ria. 2021.263
Weigel, D. y Glazebrook, J., eds., 2002. Arabidopsis: a laboratory manual. New York: Cold Spring Harbor Laboratory Press. ISBN-10: 0879695730.
Yam, K. L. y Papadakis, S. E., 2004. A simple digital imaging method for measuring and analyzing color of food surfaces. En: J. Food Process Eng., 61, pp.137–142. DOI: https://doi.org/10.1016/S0260-8774(03)00195-X


