Los pigmentos de origen natural siguen siendo de interés para su aplicación como sensibilizadores en celdas de tipo DSSC. En particular, los pigmentos provenientes de frutos o plantas autóctonas son interesantes si se considera su asequibilidad. En este trabajo, extractos purificados de antocianinas fueron obtenidos de frutos de la pitanga (Eugenia Uniflora L.) y caracterizados por espectroscopia visible y FTIR. Su estabilidad con la temperatura fue evaluada hasta los 85 ℃. Estas antocianinas fueron mezcladas con distintas cantidades de Mg2+, Al3+, Cr3+ a distintos pH de trabajo, encontrándose la relación óptima de complejación para cada sistema. Los sistemas fueron caracterizados también por medidas redox, obteniéndose un potencial de oxidación cercano a 1 V para todos los casos, lo cual confirma las características promisorias de los compuestos evaluados para su uso en celdas DSSC. La unión de las antocianinas y los complejos metálicos a TiO2 fue confirmada por FTIR. Las celdas DSSC evaluadas mostraron valores máximos de eficiencia de conversión de un 0.24% para el caso de los complejos con cromo.
Palabras clave: plantas autóctonas, fotovoltaica, metales, electroquímica.
Os pigmentos de origem natural continuam sendo de interesse para sua aplicação como sensibilizador em células do tipo DSSC. Em particular, os pigmentos de frutas ou plantas nativas são interessantes considerando sua acessibilidade. Neste trabalho, extratos de antocianinas purificadas foram obtidos de frutos de pitanga (Eugenia Uniflora L.) e caracterizados por espectroscopia de visível e FTIR. Sua estabilidade com a temperatura foi avaliada até 85 ℃. Essas antocianinas foram misturadas com diferentes quantidades de Mg2+, Al3+, Cr3+ em diferentes pHs de trabalho, encontrando a razão de complexação ideal para cada sistema. Os sistemas também foram caracterizados por medidas redox, obtendo um potencial de oxidação próximo a 1 V para todos os casos, o que confirma as caraterísticas promissoras dos compostos avaliados para seu uso em células DSSC. A ligação de antocianinas e complexos metálicos ao TiO2 foi confirmada por FTIR. As células DSSC avaliadas apresentaram valores máximos de eficiência de conversão de 0,24% no caso dos complexos com cromo.
Palavras-chave: plantas nativas, fotovoltaico, metais, eletroquímica.
Introducción
Desde sus primeros reportes en los años noventa, las celdas sensibilizadas con pigmentos (DSSC, por su sigla en inglés) han recibido un enorme interés. Miles de reportes en la literatura, sumados a su aplicación en edificios, han provocado su permanencia en el ámbito tanto académico como empresarial (O'Regan, et al., 1991; Bisquert, et al., 2004; Gao, et al., 2008; Chen, et al., 2009; Yella, et al., 2011; Yum, et al., 2012; Grätzel y Zakeeruddin, 2013; Devadiga, et al., 2021; Muñoz-García, et al., 2021). Sus eficiencias de conversión de energía han ido en aumento, alcanzando en la actualidad valores del 34% bajo condiciones de radiación ambiente de 1000 lux (Zhang, et al., 2021).
En ese contexto, el uso de pigmentos de origen natural no ha perdido interés. Ligado a su bajo costo y facilidad de obtención, la exploración de recursos naturales para su uso como sensibilizantes sigue siendo reportada (Golshan, et al., 2021; Orona-Navar, et al., 2021; Sowmya, et al., 2021; Yahya, et al., 2021).
Una celda DSSC basa su funcionamiento en una correcta sincronización energética entre sus componentes (O'Regan, et al., 1991). El pigmento depositado en el fotoánodo cumple un rol fundamental ya que es el responsable de la captación de la luz solar para convertirla en flujo de electrones. Al incidir la luz sobre la celda, el pigmento genera electrones que son transferidos al semiconductor de TiO2 sobre el que está depositado, alcanzando luego el vidrio conductor (de FTO, fluorine doped tin oxide) que soporta el fotoánodo. Estos electrones se dirigen luego al cátodo de platino también depositado sobre una placa de vidrio FTO. Entre ambos electrodos se coloca un electrolito con una cupla redox, en general la de I-/I3-, que cumple la función de regenerar el pigmento que ha perdido electrones. De esta manera, el pigmento vuelve a estar en condiciones de comenzar el ciclo nuevamente al incidir luz. Por esta razón, el potencial redox del pigmento debe ser tal que permita entregar sus electrones al TiO2, y luego recibirlos de la cupla redox para ser regenerado.
Muchos compuestos disponibles en la naturaleza han sido evaluados para su uso en DSSC, siendo las antocianinas las que permiten mejores rendimientos de conversión (Zhou, 2011; Narayan, 2012). Las antocianinas tienen las características necesarias para ser usadas como sensibilizantes ya que: i) pueden establecer enlaces con el TiO2 a través de sus grupos –OH, ii) su potencial redox es adecuado, iii) tienen altos valores de absortividad en el rango visible del espectro, iv) presentan muy bajos valores de fluorescencia y v) tienen buena estabilidad con la temperatura (Yañuk, et al., 2020; Marizcurrena, et al., 2021).
En trabajos previos hemos explorado la aplicación de las antocianinas de la flor del ceibo, alcanzando eficiencias del 0.7% en las mejores condiciones para su aplicación, o sea, bajo condiciones estándar de iluminación (1 sun o 100 mW cm−2, 1.5 AM). En esta flor, el compuesto mayoritario es la cianidina−3−glucósido, que presenta dos grupos –OH disponibles en el anillo B (en las posiciones R1 y R2), los cuales posibilitan la unión al semiconductor (Cerdá, et al., 2014; Enciso, et al., 2017).
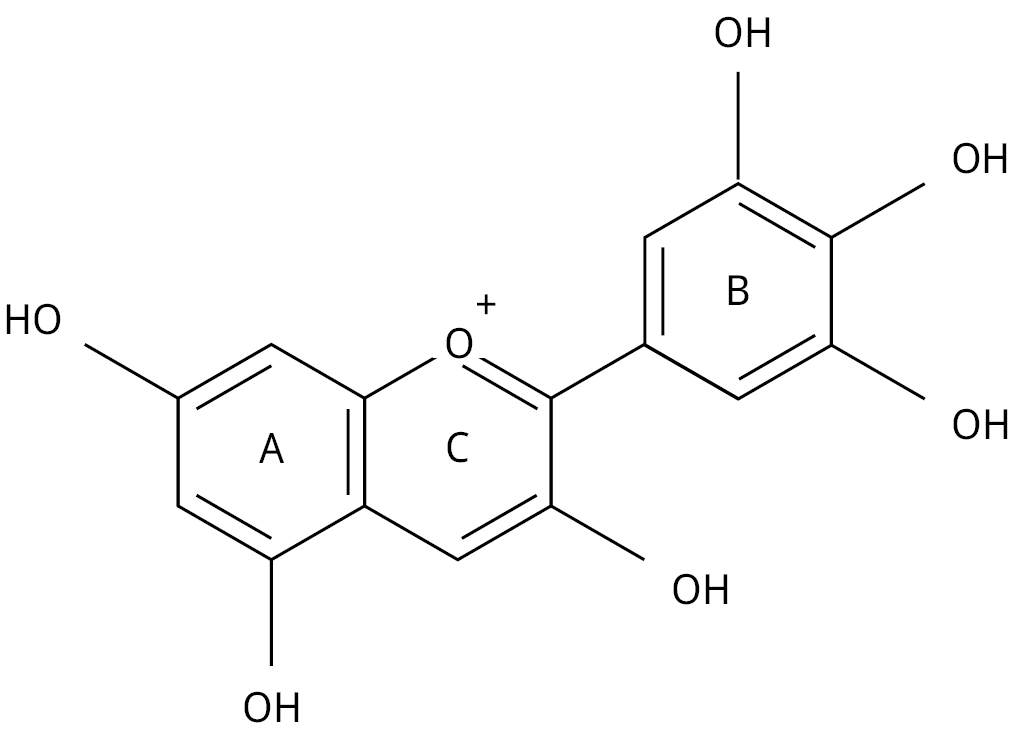
Figura 1. Estructura química de la delfinidina.
En el presente trabajo se reporta una completa evaluación de las antocianinas provenientes del fruto de la pitanga para su posible uso en celdas DSSC. En estos frutos, el compuesto mayoritario contiene delfinidina−3−glucósido, con tres sustituyentes –OH en el anillo B, como se muestra en la Figura 1 (Einbond, et al., 2004; Schmidt, et al., 2019). Las antocianinas de la pitanga tienen entonces suficientes grupos capaces de coordinarse al semiconductor y al mismo tiempo a otros metales. Se explora además la posibilidad de unión a metales como Mg2+, Cu2+ y Cr3+ para evaluar su comportamiento como posibles sensibilizantes en celdas DSSC, y como forma de contribuir a una mayor estabilidad de las antocianinas frente a su degradación.
Materiales y Métodos
Extracción y purificación de los pigmentos
La extracción de las antocianinas se hizo a partir de frutos congelados del pitanguero. Para esto se ensayaron dos opciones: agregado de nitrógeno líquido para obtención de un sólido pulverizado en mortero, y trabajo a partir del fruto descongelado. En ambos casos se probó la extracción con etanol o con agua. Los residuos sólidos fueron eliminados por centrifugación.
En el caso de la extracción con etanol, el sobrenadante fue purificado con cromatografía en columna C18 (Sep−Pak®, tamaño partícula 55−105 µm), usando una mezcla de metanol y acetonitrilo como fase móvil (proporción 70/30).
Caracterización por espectroscopia visible y medidas de estabilidad con la temperatura
Los espectros fueron realizados usando un equipo Jena Specord 200 Plus, en el rango 350 a 700 nm.
La concentración de antocianinas, tomando la delfinidina−3−glucósido como mayoritaria, pudo calcularse usando el coeficiente de absorción molar reportado de 23700 L mol−1 cm−1 para medio etanol acidificado, o de 26900 L mol−1 cm−1 en medio metanol acidificado (De Araújo, et al., 2014; Mozetic, et al., 2002; Giusti, et al., 1999).
Las muestras purificadas fueron evaluadas en el rango de temperatura entre 30 y 85 ℃ siguiendo el valor de absorbancia de su máximo.
Complejación con metales
La solución de antocianinas obtenida por purificación con columna C18, de concentración conocida, fue mezclada con distintas relaciones molares de metales (Mg2+, Cu2+, Cr3+). El rango de fracciones molares evaluado varió entre la relación 0.6 a 1 y la relación 12 a 1 (metal a antocianinas). Se usaron sales con calidad ppa (CrCl3 × 6 H2O, CuSO4 × 5 H2O, MgCl2).
Se estudiaron además los sistemas a tres pH diferentes: 2, 4 y 7. Para cada sistema metal-antocianina y pH, se encontró la relación óptima de complejación por espectrofotometría visible.
Caracterización por FTIR
Los estudios de espectroscopia infrarroja por transformada de Fourier (FTIR) se hicieron utilizando un equipo Shimadzu IRPrestige 21, con pastillas de KBr al 1%.
Se analizaron las señales de las antocianinas puras y de los complejos metálicos preparados con los datos óptimos de la sección anterior, tanto libres como luego de unirse al TiO2. Para permitir el establecimiento de enlaces con el semiconductor, la solución de pigmentos fue colocada sobre el semiconductor, dejando el sistema en reposo durante un día. De esta forma, siguiendo el mismo procedimiento que el usado para sensibilizar el electrodo de la celda DSSC, se buscó verificar la unión entre el pigmento y el TiO2 a través de cambios en sus señales características. El espectro del TiO2 desnudo fue evaluado también.
Caracterización redox
El comportamiento redox de las antocianinas purificadas y los metales formados fue evaluado por medidas de voltamperometría cíclica, usando un equipo DropSens μStat400. El electrodo de trabajo fue de Au-pc, al igual que el auxiliar, con un electrodo de seudo referencia de Ag (E = 0.008 V vs ENH). El ENH (electrodo normal de hidrógeno) representa el 0 de la escala de potenciales, y está compuesto por un alambre de Pt inmerso en una solución 1 M en H+ y que contiene H2(g) a presión de 1 atm.
La velocidad de barrido de potenciales estuvo en el rango 0.01 a 0.5 Vs−1. Las medidas se realizaron usando una mezcla 50:50 en etanol y NaClO4 0.1 M en agua MilliQ.
Armado y evaluación de celdas DSSC
Por último, se armaron celdas usando las antocianinas extraídas como sensibilizadores, usando electrodos de FTO/TiO2 (DYESOL, 0,7 cm2) y FTO/Pt (SOLARONIX) con electrolito 50 mM ioduro/tri ioduro en acetonitrilo (SOLARONIX). Las curvas I-V fueron medidas con un equipo CHI 604E, en condiciones de oscuridad y bajo irradiación, usando un simulador solar ABET (1 sun o 100 mW cm−2, 1.5 AM).
También se armaron celdas en idénticas condiciones, usando complejos de Cr (III) formados en medio etanol, usando una relación molar 8 a 1 con respecto a la concentración de antocianinas.
Resultados y Discusión
Espectroscopia visible
Los extractos realizados con etanol mostraron un mejor rendimiento de extracción en comparación a los hechos usando agua. Ambos extractos mostraban la presencia de clorofila, por lo que se procedió a su eliminación usando columnas descartables de fase reversa C18.
En este caso, y como se muestra en la Figura 2, la ausencia de clorofila luego del pasaje por la columna se verificó por la desaparición del pico de absorbancia en aproximadamente 450 nm. Luego de esto, el espectro visible del compuesto puro mostró un único pico en los 537 nm.
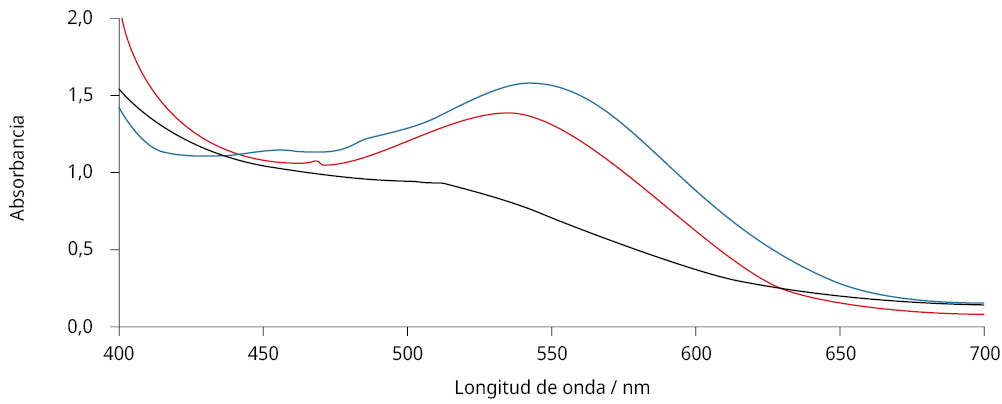
Figura 2. Espectros de absorbancia para extractos del fruto de la pitanga en agua (línea negra) y para extracto en etanol luego de purificación usando columna C18 (línea roja).
Una vez obtenido el extracto puro, se procedió a la evaluación de su estabilidad térmica estudiando el comportamiento de su máximo de absorbancia en el rango entre 30 y 85 ℃. Dentro de una oscilación atribuible a variaciones en las medidas experimentales, se obtuvieron valores de absorbancia similares a las temperaturas extremas del rango de medida. Los resultados experimentales no mostraron una disminución en el valor de la absorbancia a 537 nm, mostrando una excelente estabilidad respecto a su degradación por efecto de la temperatura, requisito fundamental para su aplicación en celdas solares.
Mezclas antocianinas-metales
Para encontrar la relación óptima, se siguió la evolución de los valores de los máximos de absorbancia de los espectros registrados a un valor de pH determinado. A la solución de antocianinas de concentración conocida se le agregaron distintas relaciones molares de metal. Luego de mezclarse, se observaron los cambios en el espectro visible. Por efecto de la complejación, se vio por un lado una disminución del valor de absorbancia en el máximo para la antocianina libre, acompañado de la aparición de un nuevo pico a absorbancias diferentes (en algunos sistemas mayores a 600 nm) correspondiente al complejo metálico formado. Por último, cuando la cantidad de metal estaba en exceso respecto a la necesaria estequiométricamente para formar el complejo, y en el caso de provenir de sales coloreadas como para Cu2+ y el Cr3+, pudo verse la aparición de un tercer pico de absorbancia. Por esta razón, el análisis de las componentes espectrales se llevó adelante por deconvolución gráfica, utilizando Origin Pro, como se muestra en el ejemplo de la Figura 3. El ajuste seguido fue el de multi-picos Gaussianos.
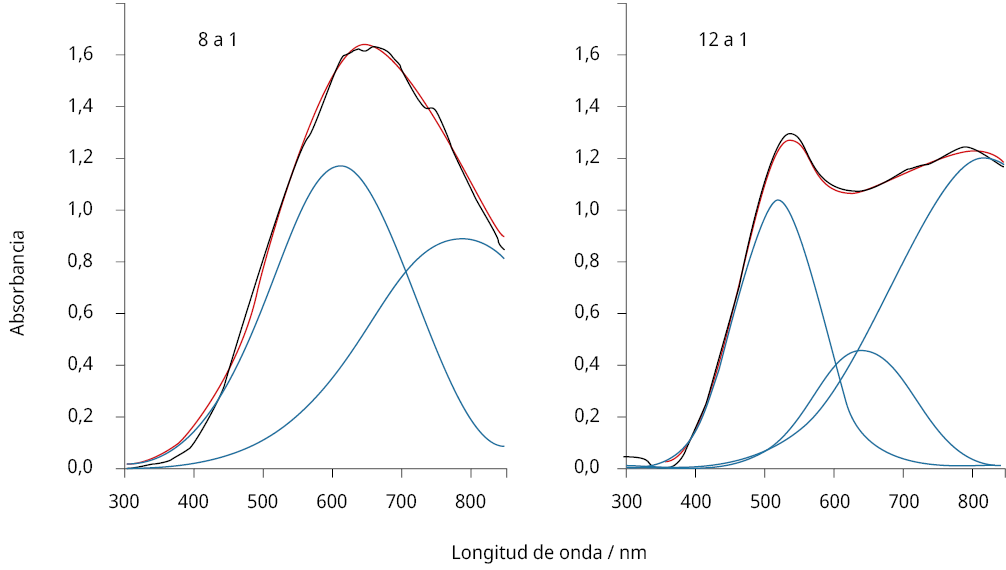
Figura 3. Análisis por deconvolución gráfica (línea roja, suma de las componentes) de los espectros de absorbancia obtenidos (línea negra) para el sistema Cu2+ /antocianinas, pH = 7, para una relación molar metal a antocianinas 8 a 1 (izquierda) y 12 a 1 (derecha). Se observan tres componentes (color azul): a 550 (antocianinas libres), 650 (complejo Cu-antocianinas) y 800 nm (ion Cu++ libre).
Las distintas especies presentaron los siguientes valores máximos de absorbancia en el visible a pH = 7:
Para el sistema Cu/AT: 550 nm (AT libres), 650 nm (complejo), 800 nm (Cu2+ libre).
Para el sistema Mg/AT: 550 nm (AT libres), 540 nm (complejo).
Para el sistema Cr/AT: 550 nm (AT libres), 670 nm (complejo), 820 nm (Cr3+ libre).
Como puede observarse, la forma del espectro y la posición e intensidad de los máximos de absorbancia registrados cambiaron de acuerdo con la cantidad relativa de las especies presentes en la solución para esa relación molar metal a antocianinas (AT).
Con respecto a las tres especies detectadas por deconvolución, solo los valores de absorbancia del pico correspondiente al complejo Metal-AT siguieron una tendencia. En la mayoría de los casos analizados se alcanzó un valor máximo en el punto óptimo de relaciones molares (siguiendo el comportamiento del pico de absorbancia para los complejos metálicos), para luego disminuir la absorbancia en presencia de un exceso de metal agregado. En algunos sistemas ese valor de absorbancia aumentó hasta alcanzar un valor constante, coincidiendo con el punto en que la cantidad relativa de metal a antocianas fue el óptimo para la formación del complejo metálico.
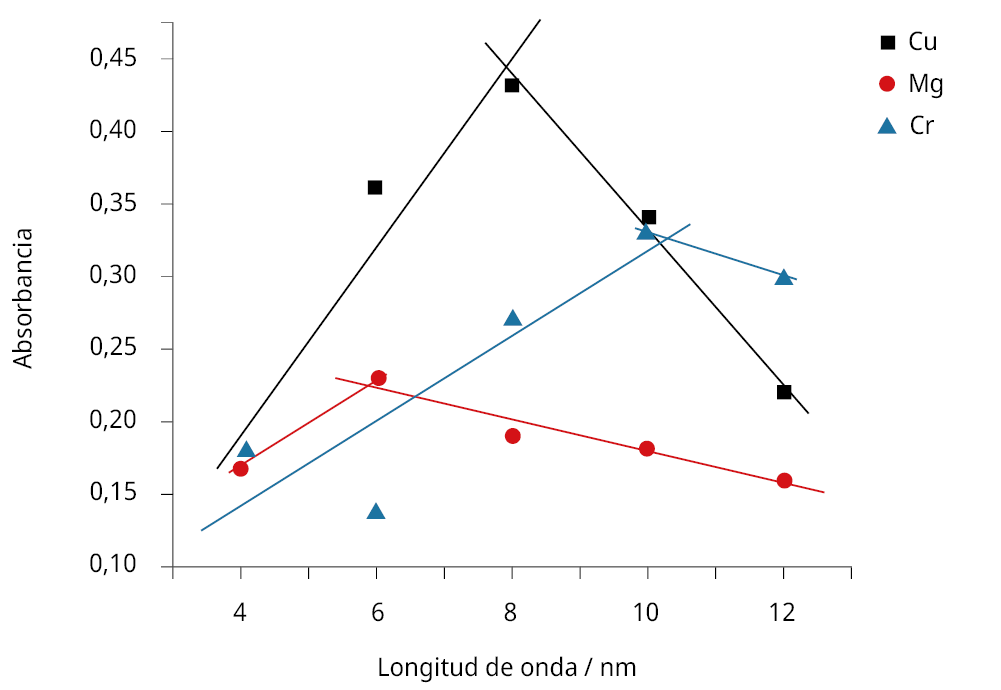
Figura 4. Gráfico de los valores máximos de absorbancia correspondientes a las especies complejas formadas a partir del agregado de distintas proporciones molares metal a ligando obtenidos por deconvolución gráfica, a pH = 7, para los sistemas de los tres metales evaluados.
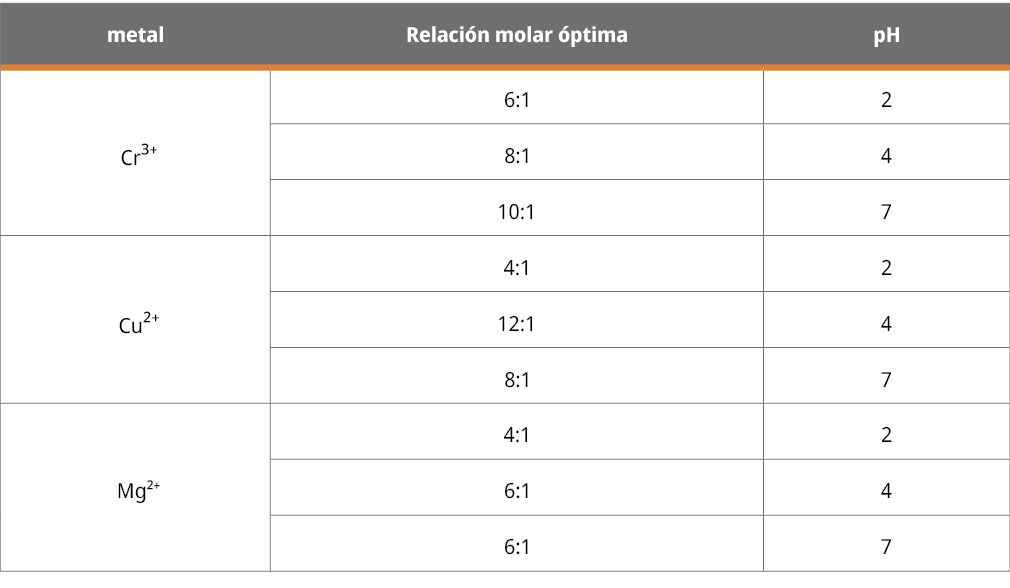
La Figura 4 muestra un ejemplo de los análisis realizados, en este caso para los sistemas metal-antocianinas a pH = 7. Los datos graficados son los correspondientes a los máximos de los complejos formados (540, 650 y 670 nm, según el caso), provenientes de los valores obtenidos a partir de la deconvolución gráfica de los diferentes espectros registrados. Como puede verse, las tendencias claramente indican una relación molar óptima de complejación, dato que fue utilizado para las medidas de caracterización realizados por las demás técnicas presentadas en este trabajo. Si bien las condiciones de trabajo no son estrictamente las necesarias para aplicar el método de Job, nuestro análisis se basó en esta metodología (Renny, et al., 2013). Las relaciones molares óptimas de complejación encontradas se muestran en la Tabla 1.
Tabla 1. Relaciones molares óptimas de complejación encontradas a partir de la aplicación del método de Job a los diversos sistemas. Datos obtenidos por método gráfico a partir de la deconvolución (ver además figuras 2 y 3).
Análisis por FTIR
Con esta técnica se analizaron distintas muestras: por una parte, se evaluaron tanto las antocianinas libres como el semiconductor de TiO2 puro con la finalidad de conocer sus señales aisladas. Luego, las señales para los compuestos unidos al TiO2, como forma de verificar el fijado (por establecimiento de enlaces estables) a este sustrato fundamental del electrodo en una DSSC. También se evaluaron las señales de los complejos metálicos con antocianinas unidos al TiO2. En este caso, se prepararon solo las especies mediante el agregado de metal a antocianinas en su relación óptima a pH = 4 (Figuras 5 y 6).
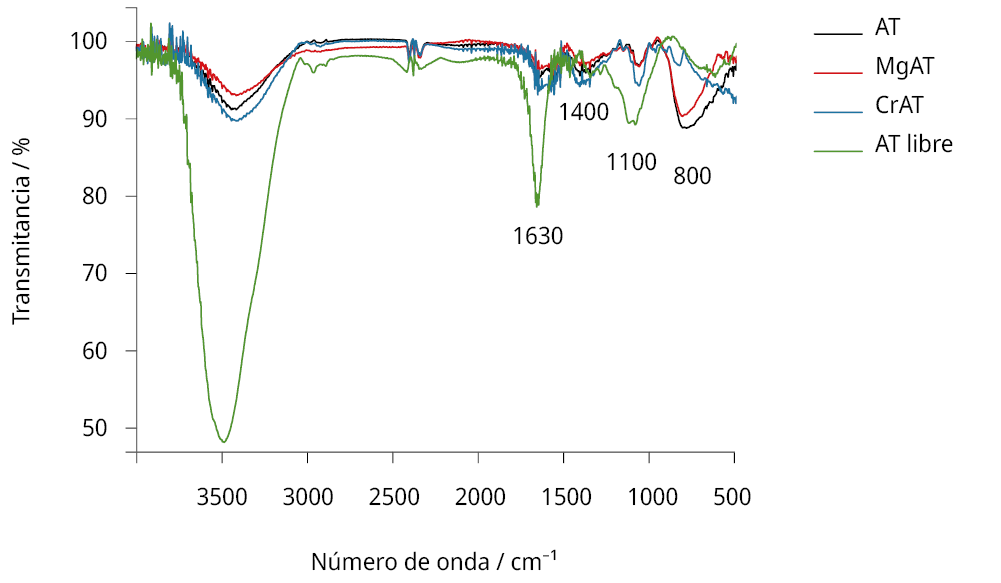
Figura 5. Espectros FTIRs obtenidos para pastillas de KBr al 1% preparadas con: antocianinas (AT) libres (línea verde), antocianinas luego de su unión al TiO2 (línea negra), y con los complejos antocianina-metal depositados sobre TiO2 (línea roja para el caso del complejo formado a la proporción óptima de Mg2+; línea azul para el complejo formado a la proporción óptima de Cr3+).
Para las antocianinas libres en solución, se verificó la presencia de señales provenientes de sus principales grupos funcionales: alcoholes y fenoles, con bandas en la región de los 3350−3500 cm−1 y grupos aromáticos en la región de los 1500−1650 cm−1 (Pavia, et al., 2001).
Por otra parte, en el caso de las antocianinas unidas al TiO2, se registró la presencia de nuevas señales alrededor de los 800 cm−1 con respecto a las presentes en las antocianinas libres en solución, y se modificaron las señales en la región de los 1500−1650 cm−1. En particular, la señal única en 1630 cm−1, presente para las AT libres provenientes de una solución llevada a sequedad, se separó en dos señales en 1640 y 1550 cm−1, mostrando que la formación de enlaces tanto con los metales como con el TiO2 afectó la resonancia de los enlaces en los grupos aromáticos. Se observó también un notorio cambio en la relación entre las intensidades de las bandas a 1065 cm−1 y 1400 cm−1 al unirse las AT al semiconductor o a los metales utilizados.
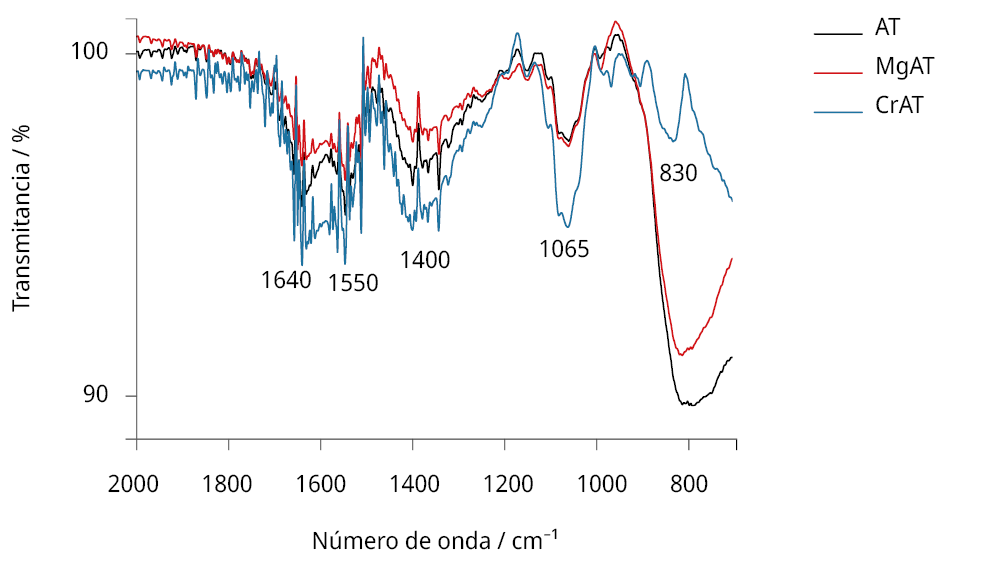
Figura 6. Ampliación de la zona donde ocurrieron los cambios más importantes en los espectros FTIRs obtenidos para pastillas de KBr al 1% preparadas con: antocianinas luego de su unión al TiO2 (línea negra), y con los complejos antocianina-metal depositados sobre TiO2 (línea roja para el caso del complejo formado a la proporción óptima de Mg2+; línea azul para el complejo formado a la proporción óptima de Cr3+).
En cuanto a los sistemas Cr-antocianina y Mg-antocianina, en ambos casos se confirmó la formación del complejo y la unión del mismo al TiO2. El análisis de las muestras, luego de ser depositadas sobre el semiconductor, mostró la presencia de las bandas características de las antocianinas y de los complejos, confirmando el establecimiento de enlaces de los complejos metálicos con el mismo (Figura 6). Por otra parte, y como se discutiera para el caso de la figura 5, las señales en la zona de los 800 cm−1 aparecieron solo para el caso de las especies unidas al TiO2, estando ausentes en las registradas a partir de las AT provenientes de la solución. Pero, además, algunas bandas mostraron diferencias entre las presentes en el caso de las antocianinas y en el de los complejos unidos al TiO2. En el caso de los complejos, los cambios fueron mayores para los compuestos que contienen cromo. Si se comparan los sistemas conteniendo metales con las medidas de las antocianinas enlazadas al TiO2, se observó un notorio cambio en la relación de la banda en el rango 800−830 cm−1 con la de 1065 cm−1. Este cambio fue especialmente evidente para el caso del complejo con cromo, donde la relación de intensidades se invirtió comparada con la del sistema AT-TiO2 y del complejo con magnesio depositado sobre TiO2. Además, la señal de 800 se corrió a 830 cm−1 para el complejo de cromo y a 810 cm−1 en el caso del complejo de magnesio.
Análisis del comportamiento redox
Por último, se procedió a la caracterización electroquímica por voltamperometría cíclica, usando electrodos serigrafiados de oro. Se estudiaron las señales tanto para antocianinas libres como para las unidas a los metales en sus condiciones óptimas.
Las medidas se realizaron a diferentes velocidades de barrido de potencial v, de forma de evaluar si los procesos de intercambio de electrones implican adsorción o difusión sobre el electrodo.
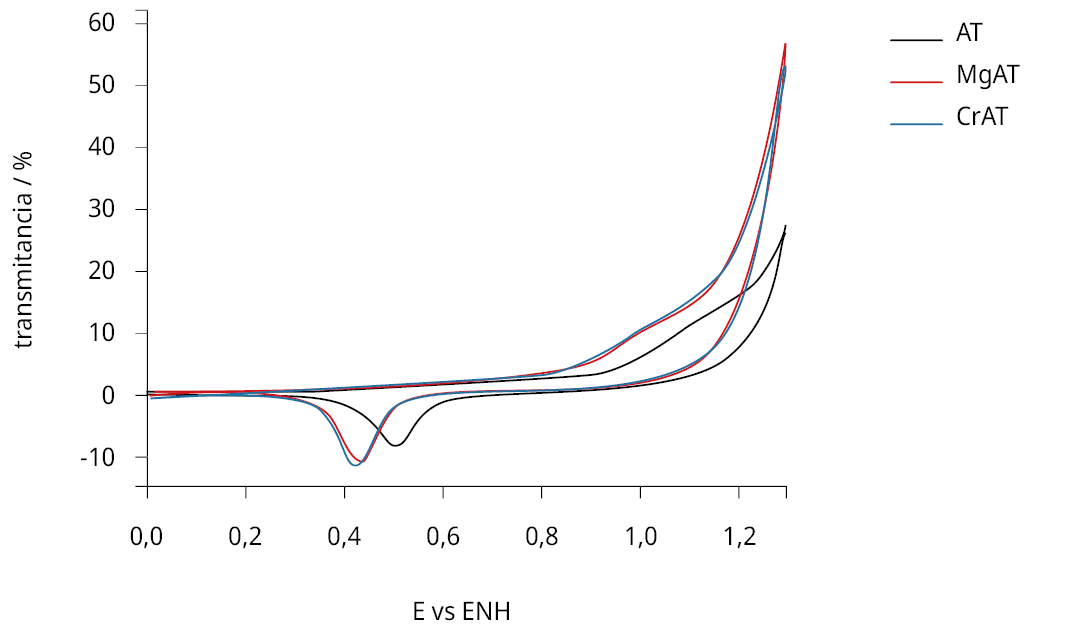
Figura 7. Perfiles voltamperométricos para electrodo serigrafiado de Au-pc en soluciones de soporte 50:50 de etanol en NaClO4 0.1 M en agua, conteniendo antocianinas libres (línea negra), complejos cromo-antocianinas (línea azul) y complejos magnesio-antocianinas (línea rosa), a v = 10 mV/s.
Como se observa en la Figura 7, el perfil obtenido para el caso de antocianinas libres muestra la presencia de un pico catódico bien definido en E = 0.50 V, mientras que el anódico (a 1.15 V) es más difícil de determinar, especialmente a velocidades altas. Ambas contribuciones se desplazan hacia valores más negativos de potencial y alcanzan valores mayores de intensidad a velocidades mayores de barrido. Tanto para el pico catódico como para el anódico, el comportamiento es lineal entre la intensidad y la v½, indicando la existencia de procesos que involucran difusión de las especies electroactivas desde o hacia la superficie del electrodo de oro (Cerdá, et al., 2002).
En el caso de los complejos de Cr3+ y Mg2+, el comportamiento observado es muy similar. Ambos compuestos muestran valores de potenciales de oxidación levemente inferiores al caso de las antocianinas libres, con un Eanódico de 1.08 V. El pico catódico también se desplaza a E menores, presentándose en ambos casos a 0.43 V. Estos cambios en el comportamiento redox son muy pequeños, por lo que no se prevé que puedan afectar el funcionamiento de la celda DSSC.
Siguiendo un análisis más profundo, para el caso de los complejos de Mg2+ se observa un comportamiento similar al de las antocianinas, donde las especies formadas difunden desde o hacia la superficie electródica para intercambiar electrones. Para los complejos de Cr3+ se observa un comportamiento de adsorción en ambos procesos redox, sugerido por un ajuste de las intensidades de picos anódicos y catódicos con la velocidad de barrido de potenciales.
Evaluación de las celdas armadas
Las celdas sensibilizadas con antocianinas puras, así como del complejo formado con cromo en medio etanol, fueron evaluadas usando simulador solar. Para ello se utilizó una concentración conocida de la solución de antocianinas de 1.8E−4 M determinada a partir de su espectro de absorbancia, y una de Cr3+ ocho veces mayor (Figura 8). Para el armado de las celdas, se eligió realizar la complejación en medio alcohólico —y no en uno de los buffers acuosos— para permitir una mejor comparación con las celdas armadas en idénticas condiciones.
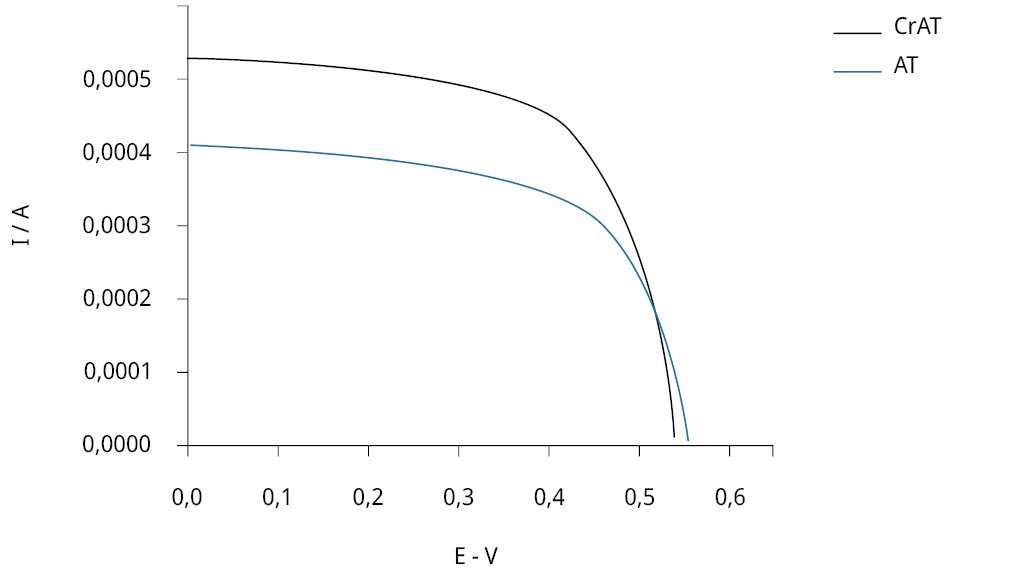
Figura 8. Perfiles de intensidad de corriente vs potencial para celdas sensibilizadas con antocianinas purificadas en concentración 1.8E−4 M (línea roja) y para el complejo formado a partir de la mezcla de Cr (III) y antocianinas en relación molar 8 a 1 en medio etanol (línea negra). Medidas bajo radiación de 100 mW cm−2, tamaño de la celda 0.7 cm2.
Se eligió trabajar exclusivamente con el sistema Cr-antocianinas por ser el que mostró los cambios más notorios al ser evaluado espectroscópicamente, y donde las interacciones entre el complejo y el TiO2 pudieron ser más claramente determinadas. Por otra parte, y desde el punto de vista redox, es equivalente al sistema con Mg.
Los parámetros más importantes medidos se muestran en la Tabla 2.
Tabla 2. Principales parámetros determinados para celda DSSC a partir de su evaluación mediante las curvas de I vs E.
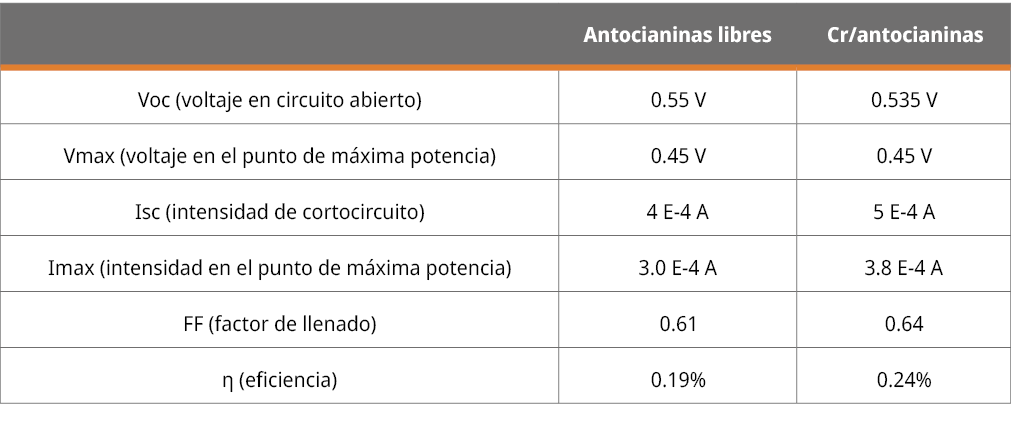
Las celdas muestran un adecuado voltaje en circuito abierto, con valores del orden de los reportados para antocianinas en esas condiciones. Los valores de FF y de eficiencia también están en línea con los reportados para antocianinas (Zhou, et al., 2011; Enciso, et al., 2017).
El aumento de la eficiencia medida para el caso de los complejos con cromo muestra la posibilidad del uso de sistemas basados en estos compuestos, donde las antocianinas podrían además ver afectada su estabilidad por la unión al metal. El aumento de la eficiencia podría explicarse por una combinación de varios factores, como ser un aumento en el coeficiente de absortividad molar para el caso del complejo metálico, una mejor capacidad de interacción con la superficie del electrodo de dióxido de titanio debido a cambios conformacionales en los anillos del ion flavilio luego de la unión al metal, y cambios en los potenciales redox que permiten una mejor transferencia de electrones con las otras especies presentes en una celda DSSC: el propio TiO2 y la cupla ioduro/tri ioduro.
Las antocianinas participan de equilibrios que involucran al catión O+ oxonio, sobre el que puede ubicarse una carga positiva a consecuencia de equilibrios de ruptura y formación de enlaces. La complejación con metales tiene consecuencias directas sobre esto, impidiendo la aparición de estas estructuras resonantes en equilibrio (Takeda, 2006; Sinela, et al., 2017; Tarone, et al., 2020).
En resumen, la interacción entre las antocianinas evaluadas y los metales implica la formación de especies que provocan un aumento de la eficiencia de conversión energética al ser usada como sensibilizantes, muy probablemente ligado a una mejor capacidad de absorción de la luz incidente, entre otros factores. Pero, además, estas especies complejas implican un aumento de la estabilidad respecto a las antocianinas aisladas, con implicancias interesantes a evaluar en su uso en celdas DSSC.
Conclusiones
Las antocianinas provenientes del fruto de la pitanga (en su mayoría delfinidina−3−glucósido) pueden ser extraídas fácilmente con etanol y purificadas por columna C18. Muestran además una adecuada estabilidad térmica hasta los 85 ℃. Pueden complejarse con metales como cobre, magnesio y cromo, en proporciones molares que dependen del pH de trabajo. Desde el punto de vista redox, tanto las antocianinas libres como las unidas al metal muestran un potencial de oxidación cercano a 1 V. La unión al TiO2 es demostrada por la aparición de enlaces entre las antocianinas y el semiconductor, detectables por FTIR. Por esta técnica se confirma además la complejación con los metales, y la unión de dichos complejos al semiconductor, con señales más claras en el caso de los compuestos con cromo, en línea con la mayor cantidad relativa de este metal necesaria para la formación de especies estables con el ligando antocianina.
Todas estas características las confirman en su potencial uso como sensibilizantes para celdas fotovoltaicas del tipo DSSC. Este comportamiento fue confirmado por el armado de celdas que mostraron una eficiencia de conversión cercana al 0.2%.
Agradecimientos
Las autoras desean agradecer al Programa PAIE-CSIC por el apoyo financiero recibido. MFC es investigadora del PEDECIBA y de la ANII.
Referencias
Bisquert, J., Cahen, D., Hodes, G., Rühle, S. y Zaban, A., 2004. Physical chemical principles of photovoltaic conversion with nanoparticulate mesoporous dye-sensitized solar cells. En: J. Phys. Chem. B., 108(24), pp. 8106-8118. DOI: https://doi.org/10.26461/23.02
Cerdá, M.F. y Enciso, P., 2014. Caracterización de las antocianinas de la flor de ceibo como sensibilizadores naturales para su uso en celdas fotovoltaicas. En: INNOTEC, 9, pp. 91-96. DOI: https://doi.org/10.26461/09.12
Cerdá, M.F., Méndez, E., Malacrida, L., Zinola, C.F., Melián, C., Martins, M.E., Castro Luna, A.M. y Kremer, C., 2002. Redox behavior of Re(V)–amino acid containing complexes. En: J. Colloid Interf. Sci., 249(2), pp. 366–371. DOI: https://doi.org/10.1006/jcis.2002.8228
Chen, C.Y., Wang, M.K., Li, J.Y., Pootrakulchote, N., Alibabaei, L., Ngoc-le, C.H., Decoppet, J.D., Tsai, J.H., Grätzel, C., Wu, C.G., Zakeeruddin, S.M. y Grätzel, M., 2009. Highly efficient light-harvesting Ruthenium sensitizer for thin-film dye-sensitized solar cells. En: ACS Nano, 3(10), pp. 3103-3109. DOI: https://doi.org/10.1021/nn900756s
De Araújo Santiago, MC.P., Senna Gouvêa, AC.M., de Oliveira Godoy, R.L., Galhardo Borguini, R., Pacheco, S., Nogueira R.I., de Mattos do Nascimento, L. y Pereira Freitas, S., 2014. Analytical standards production for the analysis of pomegranate anthocyanins by HPLC. En: Braz. J. Food Technol., 17(1), pp. 51-57. DOI: https://doi.org/10.1590/bjft.2014.008
Devadiga, D., Selvakumar, M., Shetty, P. y Santosh, M.S., 2021. Dye-sensitized solar cell for indoor applications: a mini-review. En: J. Elec. Materi., 50, pp. 3187–3206. DOI: https://doi.org/10.1007/s11664-021-08854-3
Einbond, L.S., Reynertson, K.A., DongLuo, X., Basile, M.J. y Kennelly, E.J., 2004. Anthocyanin antioxidants from edible fruits. En: Food Chemistry, 84(1), pp. 23–28. DOI: https://doi.org/10.1016/S0308-8146(03)00162-6
Enciso, P., Decoppet, J.D., Grätzel, M., Wörner, M., Cabrerizo, F.M., Cerdá, M.F., 2017. A cockspur for the DSS cells: Erythrina crista-galli sensitizers. En: Spectrochim. Acta A: Mol. Biomol. Spectros., 176, pp. 91-98. DOI: https://doi.org/10.1016/j.saa.2017.01.002
Gao, F., Wang, Y., Shi, D., Zhang, J., Wang, M.K., Jing, X.Y., Humphry-Baker, R., Wang, P., Zakeeruddin, S.M. y Grätzel, M., 2008. Enhance the optical absorptivity of nanocrystalline TiO2 film with high molar extinction coefficient Ruthenium sensitizers for high performance dye-sensitized solar cells. En: J. Am. Chem. Soc., 130(32), pp. 10720-10728. DOI: https://doi.org/10.1021/ja801942j
Giusti, M.M., Rodríguez-Saona, L.E. y Wrolstad, R.E., 1999. Molar absorptivity and color characteristics of acylated and non-acylated pelargonidin-based anthocyanins. En: J Agric Food Chem., 47(11), pp. 4631-7. DOI: https://doi.org/10.1021/jf981271k
Grätzel, C. y Zakeeruddin, S.M., 2013. Recent trends in mesoscopic solar cells based on molecular and nanopigment light harvesters. En: Mater. Today., 16(1-2), pp. 11-18. DOI: https://doi.org/10.1016/j.mattod.2013.01.020
Golshan, M., Osfouri, S., Azin, R., Jalali, T. y Moheimani, N.R., 2021. Co-sensitization of natural and low-cost dyes for efficient panchromatic light-harvesting using dye-sensitized solar cells. En: J. Photochem. Photobiol. A Chem., 417, 113345. DOI: https://doi.org/10.1016/j.jphotochem.2021.113345
Marizcurrena, J.J., Castro-Sowinski, S. y Cerdá M.F., 2021. Improving the performance of dye-sensitized solar cells using nanoparticles and a dye produced by an Antarctic bacterium. En: Environmental Sustainability, 4, pp. 711–721 DOI: https://doi.org/10.1007/s42398-021-00168-8
Mozetic, B., Trebse, P. y Hribar, J., 2002. Determination and Quantitation of Anthocyanins and Hydroxycinnamic Acids in Different Cultivars of Sweet Cherries (Prunus avium L.) from Nova Gorica Region (Slovenia). En: Food Technol. Biotechnol., 40(3), pp. 207–212.
Muñoz-García, A.B., Benesperi, I., Boschloo, G., Concepcion, J.J., Delcamp, J.H., Gibson, E.A., Meyer, G.J., Pavone, M., Pettersson, H., Hagfeldt, A. y Freitag, M., 2021. Dye-sensitized solar cells strike back. En: Chem. Soc. Rev., 50, pp. 12450-12550. DOI: https://doi.org/10.1039/D0CS01336F
Narayan, M.R., 2012. Review: dye sensitized solar cells based on natural photosensitizers. En: Renew. Sustain.Energy Rev., 16(1), pp. 208-215. DOI: https://doi.org/10.1016/j.rser.2011.07.148
O'Regan, B. y Grätzel, M., 1991. A low-cost, high-efficiency solar cell based on dye-sensitized colloidal TiO2 films. En: Nature, 353, pp. 737-740. DOI: https://doi.org/10.1038/353737a0
Orona-Navar, A., Aguilar-Hernández, I., Nigam, K.D.P., Cerdán-Pasarán, A. y Ornelas-Soto, N., 2021. Alternative sources of natural pigments for dye-sensitized solar cells: algae, cyanobacteria, bacteria, archaea and fungi. En: J. Biotechnol., 332, pp. 29-53. DOI: https://doi.org/10.1016/j.jbiotec.2021.03.013
Pavia, D.L., Lampman, G.M., y Kriz, G.S., eds., 2001. Introduction to spectroscopy. Boston: Thomson Learning Inc. ISBN: 0-03-031961-7.
Renny, J.S., Tomasevich, L.L., Tallmadge, E.H. y Collum, D.B., 2013. Method of continuous variations: applications of job plots to the study of molecular associations in organometallic chemistry. En: Angew. Chem. Int. Ed. Engl., 52(46), pp. 11998-12013. DOI: https://doi.org/10.1002/anie.201304157
Schmidt, H.O., Rockett, F.C., Pagno, C.H., Possa, J., Assis, R.Q., de Oliveira, V.R., da Silva, V.L., Flôres, S.H. y Rios, A.O., 2019. Vitamin and bioactive compound diversity of seven fruit species from south Brazil. En: J. Sci. Food Agric., 99(7), pp. 3307-3317. DOI: 10.1002/jsfa.9544
Sinela, A., Rawat, N., Mertz, C., Achir, N., Fulcrand, H. y Dornier, M., 2017. Anthocyanins degradation during storage of Hibiscus sabdariffa extract and evolution of its degradation products. En: Food Chem., 214, pp. 234-241. DOI: https://doi.org/10.1016/j.foodchem.2016.07.071
Sowmya, S., Prakash, P., Ruba, N., Prabu, A.N., Janarthanan, B., Reddy, V.R.M. y Hegazy, H.H., 2021. Fabrication of natural dye-sensitized solar cells with bulk TiO2 instead of nano-sized. En: Optik., 242, 166205. DOI: https://doi.org/10.1016/j.ijleo.2020.166205
Takeda, K., 2006. Blue metal complex pigments involved in blue flower color. En: Proc. Jpn. Acad. Ser. B Phys. Biol., 82(4), pp. 142-54. DOI: 10.2183/pjab.82.142
Tarone, A.G., Cazarin, C.B.B. y Marostica Junior, M.R., 2020. Anthocyanins: new techniques and challenges in microencapsulation. En: Food Research Int., 133, 109092. DOI: https://doi.org/10.1016/j.foodres.2020.109092
Yahya, M., Bouziani, A., Ocak, C., Seferoğlu, Z. y Sillanpää, M., 2021. Organic/metal-organic photosensitizers for dye-sensitized solar cells (DSSC): Recent developments, new trends, and future perceptions. En: Dyes and Pigments, 192, 109227. DOI: https://doi.org/10.1016/j.dyepig.2021.109227
Yañuk, J.G., Cabrerizo, F.M., Dellatorre, F.G. y Cerdá, M F, 2020. Photosensitizing role of R-phycoerythrin red protein and b-carboline alkaloids in Dye Sensitized Solar Cell. Electrochemical and spectroscopic characterization. En: Energy Reports, 6(4), pp. 25-36. DOI: https://doi.org/10.1016/j.egyr.2019.10.045
Yella, A., Lee, H.W., Tsao, H.N., Yi,Ch., Chandiran, A.K., Nazeeruddin, M.K., Diau,E.W., Yeh, Ch.Y., Zakeeruddin, S.M. y Grätzel, M., 2011. Porphyrin-sensitized solar cells with Cobalt (II/III)–based redox electrolyte exceed 12 percent efficiency. En: Science, 334, pp. 629-634. DOI: 10.1126/science.1209688
Yum, J.H., Moon, S.J., Karthikeyan, C.S., Wietasch, H., Thelakkat, M., Zakeeruddin, S.M., Nazeeruddin, Md.K. y Grätzel, M., 2012. Heteroleptic ruthenium complex containing substituted triphenylamine hole-transport unit as sensitizer for stable dye-sensitized solar cell. En: Nano Energy, 1(1), pp. 6-12. DOI: https://doi.org/10.1016/j.nanoen.2011.08.004
Zhang, D., Stojanovic, M., Ren, Y., Cao, Y., Eickemeyer, F.T., Socie, E., Vlachopoulos, N., Moser, J.E., Zakeeruddin, S.M., Hagfeldt, A. y Grätzel, M., 2021. A molecular photosensitizer achieves a Voc of 1.24 V enabling highly efficient and stable dye-sensitized solar cells with copper(II/I)-based electrolyte. En: Nat Commun., 12, p. 1777. DOI: https://doi.org/10.1038/s41467-021-21945-3
Zhou, H., Wu, L., Gao, Y. y Ma, T., 2011. Dye-sensitized solar cells using 20 natural dyes as sensitizers. En: J. Photochem. Photobiol. A Chem., 219(2-3), pp. 188–19. DOI: https://doi.org/10.1016/j.jphotochem.2011.02.008


