Este trabajo representa el primer reporte que se realiza en Uruguay sobre la implementación de
la técnica para cuantificar gases de efecto invernadero (GEI) y sus flujos difusivos a través de la
interfase sedimento-agua. El estudio fue realizado en el embalse Rincón del Bonete, ubicado sobre el Río
Negro. La técnica aplicada permitió determinar las concentraciones de GEI (CH4, CO2 y
N2O) en los sedimentos. El CO2 y el CH4 fueron los gases con mayor
concentración por m2 de sedimento. En lo referente a sus flujos difusivos, el CO2
(máx. = 1,198 mg/m2/d) fue superior al CH4 (máx. = 0,194 mg/m2/d) y
al N2O (máx. = 0,02 mg/m2/d). Si bien los valores determinados fueron bajos comparados
con otros sistemas, se necesitaría profundizar en los estudios temporales y espaciales para valorar mejor la
magnitud de los flujos de GEI. Debido al aumento de la intensidad de las actividades humanas y a los efectos
del cambio climático, los cuales promoverían el aumento de floraciones algales, sería de esperar que -tras
su descomposición- se incrementara la liberación de GEI en el embalse en un futuro.
Palabras clave: efecto invernadero, embalse, metanogénesis, desnitrificación, materia orgánica.
Este trabalho representa o primeiro relatório realizado no Uruguai sobre a implementação da
técnica de quantificação de gases de efeito estufa (GEE) e seus fluxos difusivos através da interface
sedimento-água. O estudo foi realizado no reservatório Rincón del Bonete, localizado no Rio Negro. A técnica
aplicada permitiu determinar as concentrações de GEE (CH4, CO2 e N2O) nos
sedimentos. CO2 e CH4 foram os gases com maior concentração por m2 de
sedimento. Em relação aos seus fluxos difusivos, CO2 (máx. = 1,198 mg/m2/d) foi maior
que CH4 (máx. = 0,194 mg/m2/d) e N2O (máx. = 0,02 mg/m2/d).
Embora os valores apurados sejam baixos em comparação com outros sistemas, seria necessário aprofundar os
estudos temporais e espaciais para melhor avaliar a magnitude dos fluxos de GEE. Devido ao aumento da
intensidade das atividades humanas e dos efeitos das mudanças climáticas que promovem o aumento e a
intensidade das florações de algas, seria de se esperar que, após sua decomposição, a liberação de GEE no
reservatório aumentasse no futuro.
Palavras-chave: efeito estufa, reservatório, metanogênese,
desnitrificação, matéria orgânica.
Introducción
Los estudios sobre emisiones de gases de efecto invernadero (GEI) desde represas hidroeléctricas han mostrado que esta fuente de energía no es tan limpia y “verde” como se pensaba primariamente (Fearnside, 2005). Los sistemas acuáticos continentales emiten naturalmente carbono hacia la atmósfera: los lagos y ríos juegan un rol importante en el ciclo global del carbono (Cole, et al., 2007; Ciais y Sabine, 2013). Los embalses hidroeléctricos producen y emiten carbono en mayor cantidad que los sistemas naturales, principalmente en los primeros veinte años posteriores a la inundación (Galy-Lacaux, et al., 1999; Barros, et al., 2011). Estudios realizados sobre emisiones de GEI desde embalses hidroeléctricos han mostrado que estos pueden emitir hasta 3,6 veces más que los generados por los combustibles fósiles (Fearnside, 2005). Esto es debido al mayor tiempo de residencia de los embalses comparado con los ríos, que -junto con la entrada de nutrientes inorgánicos- favorece la descomposición de la materia orgánica y una mayor producción de estos gases.
La acumulación de sedimentos en el fondo de los cuerpos de agua en los sistemas lénticos constituye un importante compartimiento de producción de GEI. El material orgánico o inorgánico que compone los sedimentos puede provenir de forma alóctona, como por ejemplo de la erosión de los suelos y arrastre de restos vegetales depositados en los suelos de la cuenca; o bien autóctona, como por ejemplo de la producción orgánica generada in situ mediante procesos locales. En este sentido, la creciente eutrofización de los cuerpos de agua ha promovido el desarrollo de floraciones a nivel mundial, principalmente de cianobacterias (Chorus y Bartram, 1999; Paerl y Otten, 2013), incrementando así la producción primaria. Esta alta producción de biomasa que se genera durante los eventos de floraciones constituye un importante aporte de materia orgánica al sistema, el cual puede alcanzar los sedimentos tras la muerte celular (Chalar, et al., 2014). Gran parte de esa materia orgánica queda retenida, pudiendo ser utilizada por microorganismos en diferentes procesos metabólicos aerobios, anaerobios y fermentativos (Liikanen, et al., 2002). Esto resulta en la producción y acumulación de un amplio espectro de sustancias tales como óxido nitroso (N2O), metano (CH4), dióxido de carbono (CO2), las cuales constituyen importantes GEI tras ser liberadas a la atmósfera. Estos gases pueden ser emitidos a través de diferentes vías, tales como: i) difusión molecular a través de la interfase sedimento-agua, ii) difusión en la columna de agua suprayacente, iii) a través de la interfase agua-aire, iv) advección turbulenta durante condiciones de viento, v) inversión de las masas de agua (Melack, 1996) y vi) formación de burbujas de CH4 y N2O en los sedimentos porosos con su ebullición directa en la atmósfera (Adams, 1999).
La mayoría de las rutas de producción y consumo de CO2, CH4 y N2O es controlada por el metabolismo microbiano. Mientras que la degradación orgánica de la materia (respiración aeróbica) produce CO2, las vías metabólicas anaeróbicas que lo consumen promueven la metanogénesis. Esto genera altas concentraciones de CH4 en el fondo de los cuerpos de agua, que posteriormente son liberadas a la atmósfera (Maeck, et al., 2013). Si bien la anaeróbica es la principal vía de producción de CH4, existen también vías aeróbicas alternativas, las cuales últimamente tienen suscitado interés científico (Donis, et al., 2017; Peeters, et al., 2019; Günthel, et al., 2019). Por otro lado, a menudo, parte del CH4 producido es oxidado por la acción de bacterias metanotróficas, pudiendo ser emitido hacia la atmósfera como CO2 (Guérin y Abril, 2007). En el caso de N2O, es un producto intermedio producido durante los procesos de nitrificación y desnitrificación, que son llevados a cabo por bacterias y archaeas (Casciotti y Buchwald, 2012). En la nitrificación, la oxidación completa del NH4 es un proceso aeróbico, pero cuando la provisión de oxígeno O2 es limitada se acumula como subproducto N2O (Smith, et al., 2003). Por otra parte, en la desnitrificación, el N2O es un producto intermedio de la reducción del óxido nítrico (NO) a niveles bajos de O2, por lo que puede darse acumulación de N2O si su reducción a N2 se inhibe por la presencia de O2 (desnitrificación parcial) (Castro-González y Torres-Valdez, 2015) o por la presencia de desnitrificantes incompletos que carecen de óxido nitroso reductasa.
Debido a que la mayoría de los gases de carbono se encuentran retenidos en los depósitos del fondo, la cuantificación de los flujos difusivos de los gases de los sedimentos hacia las aguas debería ser un prerrequisito para realizar una estimativa de balance de carbono (Sidagis-Galli, et al., 2009). En nuestro país, las altas biomasas de cianobacterias que se registran en los embalses, principalmente en el Río Negro (González-Piana, et al., 2011, 2017, 2018; Chalar, et al., 2014), representarían una importante fuente de materia orgánica que, al descomponerse, generarían emisiones de GEI. De esta forma, se torna fundamental el estudio de estas emisiones ya que el territorio uruguayo es vasto en cuerpos de agua y actualmente sufre problemas de eutrofización en la mayoría de ellos (Bonilla, et al., 2015). En Uruguay no hay registro de la estimación de emisiones de GEI en embalses. En este trabajo se implementa por primera vez la técnica para la cuantificación de la acumulación de los gases CH4, CO2 y N2O en los sedimentos de un embalse y el cálculo de los flujos difusivos a través de la interfase sedimento-agua.
Materiales y Métodos
El embalse Rincón del Bonete se ubica sobre el Río Negro, el cual es el mayor afluente del Río Uruguay. El embalse tiene un volumen total de 8.800 hm³ y una superficie de 1.070 km2, está a 80 m sobre el nivel del mar y su cuenca es de 39.700 km².
La colecta de los sedimentos se realizó en un único muestreo en marzo de 2019, en una zona próxima a la represa (32°46′S, 56°22′O), a 17,5 m de profundidad. Los sedimentos fueron colectados por triplicado mediante un colector tipo Kajak-Brinkhurst (UWITEC, Austria), para tubos de PVC cristal de 60 mm de diámetro interno y 60 cm de largo. En los testigos colectados se midió, in situ, la temperatura del agua y la concentración de oxígeno disuelto a 0,5 y 5 cm sobre la interfase sedimento-agua, utilizando un sensor Horiba D-25. Con una jeringa acoplada a un tubo de silicona fueron colectadas muestras de agua a 0,5 cm encima de la interfase sedimento-agua. Esas muestras fueron rápidamente transferidas para frascos de vidrio, con septos de silicona y tapas de rosca. Fueron fijadas con 0,5 mL de formaldehido y conservadas a 4ºC hasta su análisis en laboratorio por cromatografía gaseosa, donde se cuantificaron los gases CH4, CO2 y N2O.
Los testigos de sedimento fueron cortados en secciones de 2 cm de espesura hasta los 16 cm de profundidad. Cada sección fue colocada en un recipiente individual, homogenizada, conservada a 4°C y posteriormente analizada en laboratorio, donde fue cuantificado el nitrógeno total del sedimento por el método de Valderrama (1981), y el fósforo total, según Andersen (1976). La materia orgánica y el contenido de agua fueron cuantificados por método termo gravimétrico. Conjuntamente, testigos de sedimento fueron colectados con un colector tipo Kajak-Brinkhurst -adaptado para tubos de PVC cristal de 30 mm de diámetro interno y 60 cm de largo-, que fueron destinados al análisis de gases en el agua intersticial. Dichos testigos fueron cortados in situ en 8 secciones de sedimento de 1 cm de espesor, con un dispositivo hermético diseñado específicamente para acoplarse en la parte superior del tubo y permitir la transferencia del sedimento a frascos herméticos con el mínimo contacto con el aire. Este procedimiento se realizó a bordo de la embarcación inmediatamente después de la colecta del testigo de sedimento. Como control se colectó una muestra del aire atmosférico en el barco para descontar posibles contaminaciones. Las muestras de sedimento colectadas fueron mantenidas refrigeradas en una caja térmica con hielo hasta ser procesadas para el análisis cromatográfico.
En el laboratorio de campo, las muestras de sedimento colectadas en frascos herméticos fueron homogeneizadas y ecualizadas. Fue retirado un volumen de 10 mL de headspace con una jeringa y transferido a frascos de vidrio con septos de silicona y tapas a rosca llenos de agua destilada, con volumen conocido, para formar un nuevo headspace con la muestra a ser analizada por cromatografía gaseosa. Estas muestras fueron conservadas con 0,5 mL de formaldehído y a 4°C hasta su análisis. La cuantificación de los gases CH4, CO2 y N2O en los headspace de los frascos con las muestras colectadas del agua sobre la interfase e intersticial del sedimento fue realizada en un cromatógrafo gaseoso. El mismo pertenece a la Facultad de Agronomía, es marca Agilent, modelo 7890B modificado para detección de GEI. Cuenta con un detector FID (CH4 y CO2) y un detector microcaptura electrónica para N2O, columnas en serie HaesEPq 80-100 mesh, de 3,6 m y 1,8 m; se utilizó N2 como gas carrier. Las muestras control del aire atmosférico pasaron por los mismos procedimientos y los resultados obtenidos fueron substraídos de las concentraciones de gas cuantificadas en las muestras. Los cálculos de las concentraciones de gases en el agua sobre la interfase y el agua intersticial fueron realizados utilizando los coeficientes de difusión de cada gas, temperatura y presión del local en estudio, y el cálculo de los flujos difusivos de los gases CH4, CO2 y N2O a través de la interfase sedimento-agua fue realizado segun el método de capa límite utilizando la primera ley de Fick, según descripto en Adams (1999).
Paralelamente, se tomaron muestras para análisis de calidad de agua. Las muestras de agua fueron colectadas a 0, 4 y 16 m de profundidad con una botella muestreadora Ruttner de 1L. Se determinaron: nitrógeno total (NT) y fósforo total (PT) (American Public Health Association, American Water Works Association y Water Environment Federation, 2005a), fósforo reactivo soluble (PRS) (American Public Health Association, American Water Works Association y Water Environment Federation, 2005b), nitrato (NO3) (American Public Health Association, American Water Works Association y Water Environment Federation, 2005c), amonio (NH4) (American Public Health Association, American Water Works Association y Water Environment Federation, 2005d), sólidos suspendidos totales (SST) (American Public Health Association, American Water Works Association y Water Environment Federation, 2005e), materia orgánica (MO) (American Public Health Association, American Water Works Association y Water Environment Federation, 2005f) y clorofila a (International Organization for Standardization, 1992). In situ se midieron: temperatura, pH, conductividad y oxígeno disuelto con una sonda multiparamétrica Horiba (serie U51) y profundidad de disco de Secchi (m). Las diferencias de CH4, N2O y CO2 entre los 0,5 y 5 cm de profundidad de los sedimentos se testearon mediante test Anova de 1 vía, en el caso del CO2 los datos no presentaron normalidad, por lo que fueron normalizados mediante una transformación (log10).
Resultados
El día del muestreo, el embalse se presentó mezclado, con una diferencia de temperatura superficie-fondo de 0,08 °C. La profundidad del disco de Secchi fue de 1,4 m, el pH se situó en 8,4, el O2 disuelto alcanzó un máximo de 8,7 mg/L en la superficie y un mínimo de 7,9 mg/L en el fondo, mientras que la conductividad estuvo entre 67 - 68 µS/cm. La mayor concentración de SST se registró a los 4 m con 3,3 mg/L, mientras que en la superficie y el fondo fue de 2,9 y 3,1 mg/L, respectivamente. El porcentaje de materia orgánica varió entre 51,7% y 63,6%. La distribución de los nutrientes en la columna de agua fue variable, la mayor concentración de NH4, y NT se registró en el epilimnion, con un descenso hacia las capas más profundas, alcanzando los mínimos a los 4 m de profundidad. En el caso del PT, se registraron similares concentraciones tanto en el epilimnion como en el hipolimnion, con una leve disminución en su concentración a los 4 m. El NO3 y el PRS presentaron una distribución en gradiente con un incremento de concentración hacia el hipolimnion. La clorofila a tuvo su máxima concentración en el epilimnion (Tabla 1). En lo referente a los sedimentos, fueron homogéneos en contenido de agua, materia orgánica y PT a lo largo del perfil vertical, mientras que el NT presentó mayor variabilidad vertical y su concentración fue mayor que la del PT (Figura 1).
Tabla 1. Características físicoquímicas del agua del embalse Rincón del Bonete.
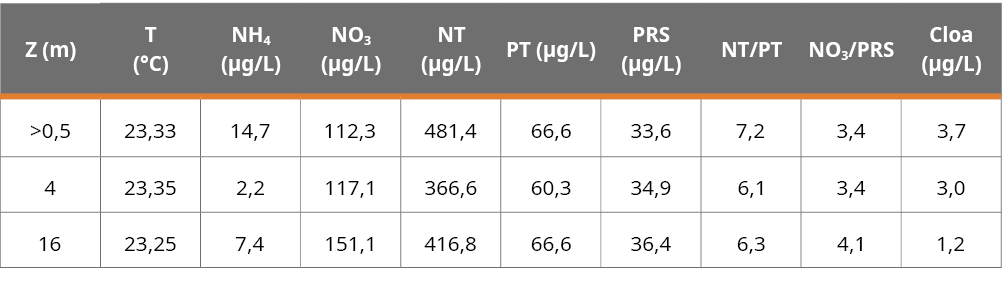

Figura 1. Concentración de la muestra integrada de los 3 sedimentos de NT, PT, % contenido de agua en los sedimentos de 0 a 16 cm de profundidad y % de materia orgánica.
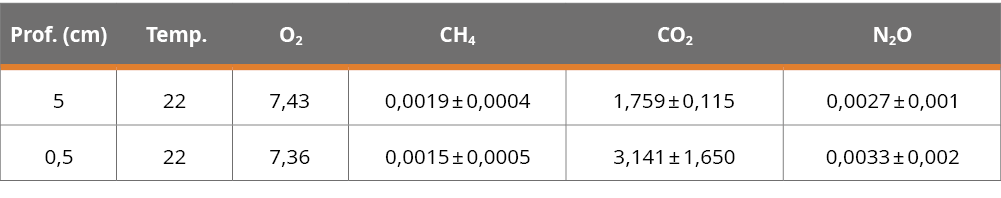
Dentro de la interfase sedimento-agua (5 - 0,5 cm), el gas que presentó las mayores concentraciones fue el CO2, seguido por el N2O y el CH4. No se registraron diferencias significativas en las concentraciones de ningún GEI entre 5 y 0,5 cm por encima del sedimento, N2O anova (F= 0,110, p= 0,756), CH4 anova (F= 1,127, p= 0,348), CO2 anova (F= 1,947, p= 0,235). En ningún momento se registró anoxia en el agua del fondo del embalse (Tabla 2).
Tabla 2. Datos de temperatura (°C) y concentraciones (mg/L) de O2, CH4, CO2 y N2O en el agua sobre la interfase sedimento-agua en los puntos próximos a la represa. Promedio de 3 testigos.
En la Figura 2 están representados los datos de concentración de CH4, CO2 y N2O en el agua intersticial de los sedimentos. Se observaron variaciones en las concentraciones de los gases del agua intersticial de los testigos (sedimentos) colectados. Las mayores concentraciones de CO2 (máx = 5,9 mg/L) y N2O (máx = 0,007 mg/L) se registraron en los primeros centímetros del sedimento y disminuyeron con la profundidad. Por su parte, el CH4 presentó un amplio rango de concentración entre los testigos, sin una clara distribución en el sedimento. Su concentración en la superficie de los sedimentos estuvo comprendida entre (0,006 − 0,185 mg/L).
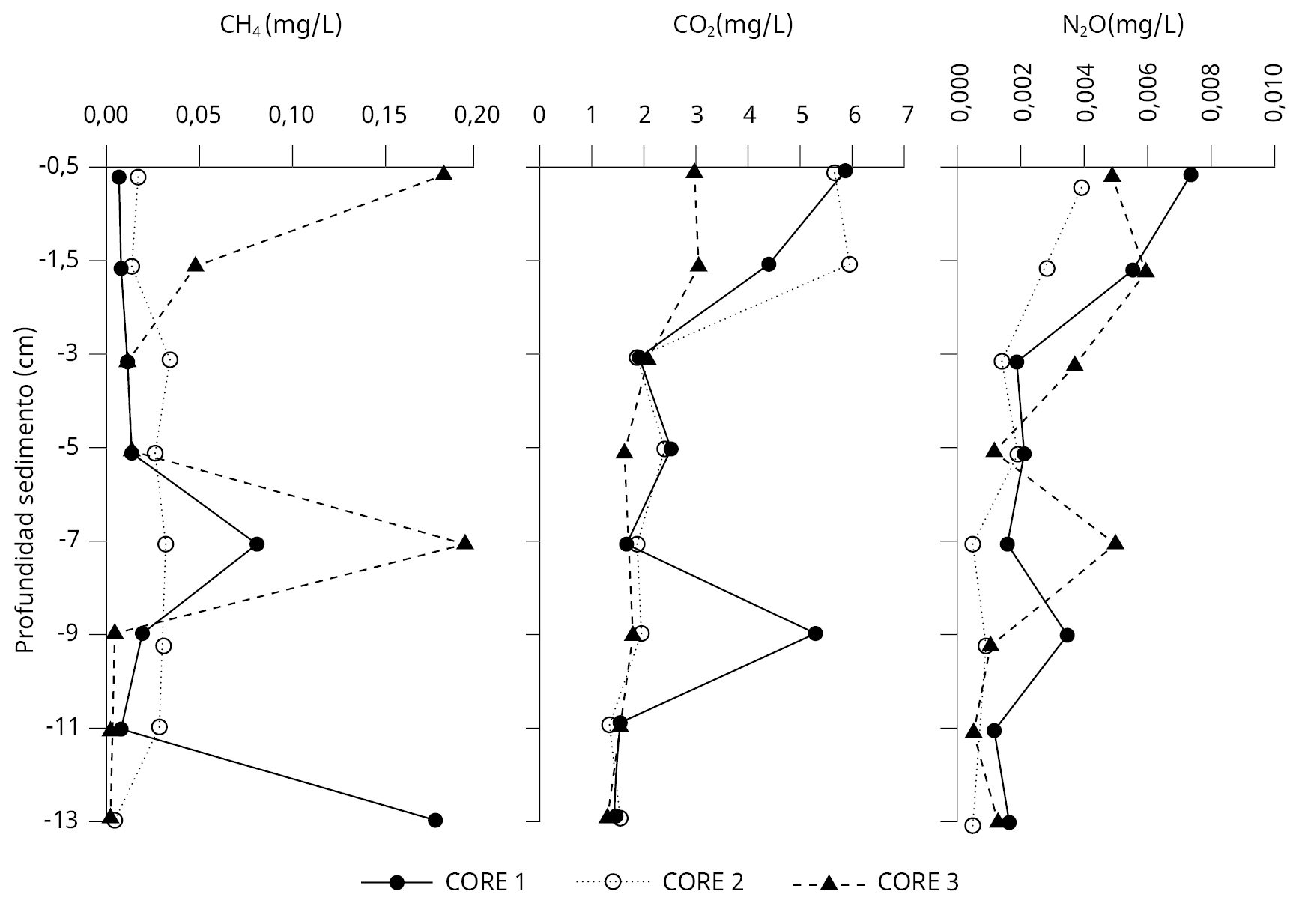
Figura 2. Concentraciones de CH4, CO2 y N2O (mg/L) en el agua intersticial de los sedimentos en las muestras de sedimento colectadas en el embalse Rincón del Bonete.
Las concentraciones de los GEI (mmol/m2) de los sedimentos integrados de (0 - 4 cm) y sus flujos difusivos a través de la interfase sedimento-agua son mostradas en la Tabla 3. El CO2 y el CH4 fueron los gases con mayor concentración por m2 de sedimento. En lo referente a sus flujos difusivos, el CO2 (máx. = 1,198 mg/m2/d) fue superior al CH4 (máx. = 0,194 mg/m2/d) y al N2O (máx. = 0,02 mg/m2/d), donde este último presentó flujo negativo en uno de los testigos colectados.
Tabla 3. (A) Concentraciones mmol/m2 de CH4, CO2 y N2O en el sedimento (valores integrados de 0-4cm). (B) Flujo difusivo (mg/m2/d) de CH4, CO2 y N2O a través de la interfase sedimento-agua de las muestras de sedimento.

Discusión
Este trabajo constituyó una puesta a punto de la técnica de cuantificación de gases de efecto invernadero y sus flujos difusivos a través de la interfase sedimento–agua, y su aplicación en un embalse para su estudio. De acuerdo con Abril y otros (2005), en embalses antiguos (como Rincón del Bonete, 1945), la producción primaria in situ junto con los aportes de afluentes son las principales fuentes de materia orgánica que alcanzan los sedimentos. El embalse de Bonete, al ser mesotrófico -de acuerdo con los valores de PT- (Salas y Martino, 1990), promueve el desarrollo de floraciones de cianobacterias en verano (Chalar, et al., 2010, 2015; González-Piana, et al., 2011, 2017, 2018). De esta forma, la acumulación sucesiva de elevadas biomasas de cianobacterias sobre los sedimentos constituiría la principal fuente de materia orgánica disponible a ser biodegradada en el embalse, contribuyendo con la producción de gases de efecto invernadero, principalmente en zonas anóxicas.
En este estudio, el embalse se presentó mezclado en la totalidad de la columna de agua, determinando que elevadas concentraciones de O2 alcanzaran el hipolimnion. Esto causó que en dicha zona predominara un metabolismo aeróbico, el cual explicaría que el CO2 haya sido el GEI más abundante. Esta característica es típica de lagos oligotróficos a mesotróficos, donde el hipolimnion se mantiene en condiciones óxicas en toda la columna de agua, todo el año (Brasil. Ministério de Minas e Energia, 2012). Bajo estas condiciones, la metanogénesis estaría inhibida y la producción de CH4 se restringiría a las capas más profundas de los sedimentos (Lovley y Klug, 1983; Kuivila, et al., 1988). En función de esto, las bajas concentraciones obtenidas en este trabajo serían producto de la difusión del gas desde los sedimentos a través de un gradiente de concentración y de su eventual consumo por bacterias metanotróficas (Panhniban, et al., 1979; Sweerts, et al., 1996; Utsumi, et al., 1998). De acuerdo con algunos autores, hasta un 90% del CH4 es consumido por metanótrofos en la interfase sedimento-agua (Kuivila, et al., 1988, Kiene, 1991; Liikanen, et al., 2002).
Por otro lado, también sería importante considerar la producción aeróbica de CH4 mediante la metabolización bacteriana de compuestos como el metilfosfonato (Yao, et al., 2016, Wang, et al., 2017), o bien a partir del metabolismo algal (Lenhart, et al., 2016; Klintzsch, et al., 2019, Bižić, et al., 2020; León-Palmero, et al., 2020). La vía del metilfosfonato puede ser muy relevante en ambientes oligotróficos, en los que la baja disponibilidad de fósforo soluble fuerza la utilización del fósforo integrante de moléculas orgánicas como el metilfosfonato, promoviendo la formación de CH4 bajo condiciones aeróbicas. En el caso de N2O, la mayor fuente biogénica en la interfase sedimento-agua es la desnitrificación. Esta ocurre en condiciones deficientes de O2 disuelto, con concentraciones inferiores a 1 mg/L, las cuales son muy inferiores a las registradas en este trabajo. Es probable que las condiciones óxicas observadas sobre la interfase sedimento-agua hayan inhibido parte de este proceso, el cual se vio favorecido por la mayor presencia de formas nitrogenadas en el agua y el sedimento (Liikanen, et al., 2002).
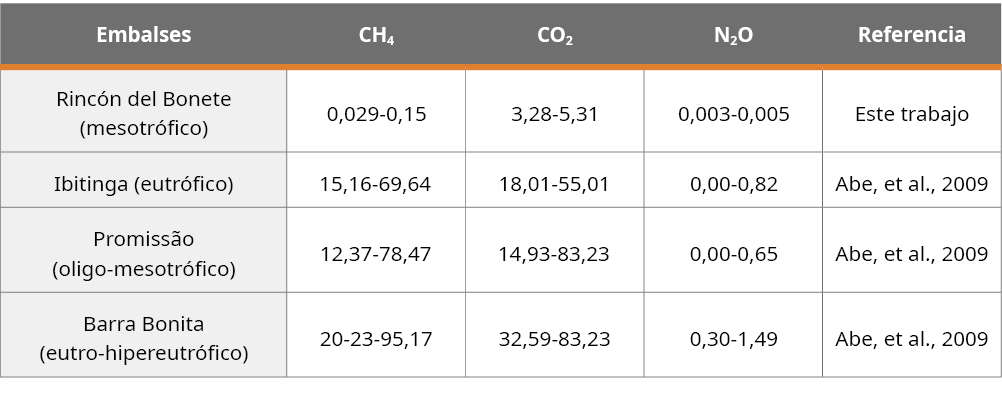
A nivel de sedimentos, nuestros resultados muestran que Rincón del Bonete presentó concentraciones de GEI superiores a las detectadas en la interfase sedimento-agua. Tal como reportara Huttunen y otros (2006), en otros sistemas, el CH4 presentó variaciones de concentraciones en los sedimentos. De acuerdo con Kiene (1991), esto sería reflejo de la interacción entre los diferentes factores implicados en su producción, tanto biológicos (metabolismo microbiano) como físicoquímicos (tipo y cantidad de materia orgánica disponible, disponibilidad de aceptores de electrones, pH, temperatura, y procesos de mezcla en la interfase sedimento-agua). Las concentraciones de GEI en los sedimentos de Rincón del Bonete fueron inferiores a las registradas, por ejemplo, en embalses de Brasil (Tabla 4). Esta baja concentración de GEI se debería a la falta de condiciones anóxicas en el sedimento que generaría escaso poder reductor, el cual no fue medido en este trabajo.
Tabla 4. Concentraciones de GEI (mmol/m2) en el sedimento de los embalses de Rincón de Bonete (UY), Ibitinga, Promissão y Barra Bonita (BR).
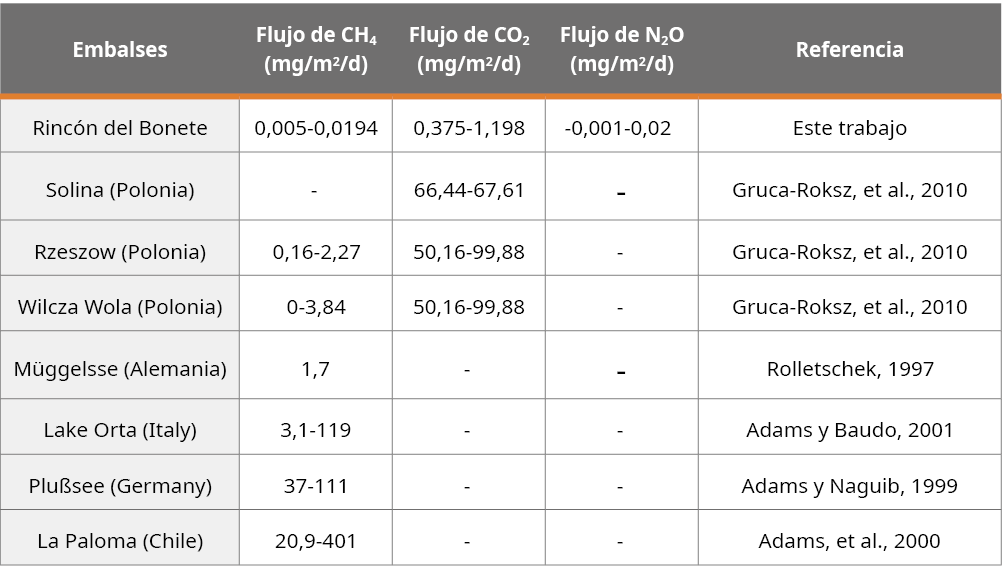
La baja concentración de GEI en los sedimentos determinó que los flujos difusivos de CH4, CO2 y N2O a través de la interfase sedimento-agua fueran muy inferiores a los valores observados en otros sistemas, por ejemplo, represas eutróficas tropicales, sistemas con abundante reserva de materia orgánica en sus sedimentos y embalses templados o boreales (Adams, et al., 2000; Abe, et al., 2005; Huttunen, et al., 2006; Brasil. Ministério de Minas e Energia, 2012) (Tabla 5). Somos conscientes de las limitantes que tuvo este trabajo, ya que por tratarse de una primera implementación de la técnica para medir GEI en sistemas lénticos, contó con un bajo número de muestras, así como de poca variabilidad espacial y temporal. Los resultados son alentadores para poder seguir profundizando en el estudio de GEI en embalses hidroeléctricos del país y comprender cuáles son los factores que determinan su producción.
Tabla 5. Flujos difusivos en la interfase sedimento-agua de diferentes embalses y lagos extraídos de la literatura.
Agradecimientos
La AIIEGA agradece a la Sección Limnología de la Facultad de Ciencias de la Universidad de la República en la persona del Profesor Dr. Guillermo Chalar por la invitación para realizar este estudio piloto en el embalse Rincón del Bonete. Los investigadores Donato Seiji Abe y Corina Sidagis Galli agradecen por la ayuda financiera de PEDECIBA Geociencias. La Sección Limnología de la Facultad de Ciencias agradece a Corina Sidagis Galli y Donato Seiji Abe, investigadores de AIIEGA, por su colaboración para la realización de este estudio.
Referencias
Abe, D., Adams, D., Sidagis-Galli, C., Cimbleris, A. y Brum, P., 2005. Trophic classifications between temperate and tropical aquatic ecosystem: is such terminology unrealistic for sedimentary carbon cycling? En: University of Nairobi. 11th World Lakes Conference-Nairobi, Kenya. Management of Lake Basins for their Sustainable Use: Global Experience and African Issues. Abstracts volume. Nairobi: PASS, University of Nairobi. pp. 105.
Abe, D. S.; Sidagis Galli, C.; Tundisi, T. M.; Tundisi, J. E. M.; Grimberg, D. E.; Medeiros, G. R.; Teixeira-Silva, V.; Tundisi, J. G., 2009. The effect of eutrophication on greenhouse gas emissionsin three reservoirs of the Middle Tietê River, southeastern Brazil. En: Proceedings of the International Association of Theoretical and Applied Limnology, 30, pp. 822-825.
Abril, G., Guerin, F., Richard, S., Delmas, R., Galy-Lacaux, C., Gosse,P., Tremblay, A., Varfalvy, L., Dos Santos, M. y Matvienko, B., 2005. Carbon dioxide and methane emissions and the carbon budget of a 10-year old tropical reservoir (Petit Saut, French Guiana). En: Global Biogeochemical Cycles, 19, GB4007. DOI: https://doi.org/10.1029/2005GB002457
Adams, D., 1999. Methane, carbon dioxide and nitrogen gases in the superficial sediments of two Chilean reservoirs: diffusive fluxes at the sediment water interface. En: Rosa, L.P. y Dos Santos, M.A., eds., 1999. Dams and climate change. Rio de Janeiro: COPPE. pp. 50-77.
Adams, D. y Baudo R., 2001. Gases (NH4, CO2 and N2) and pore water chemistry in the surface sediments of Lake Orta, Italy, acidification effects on C and N gas cycling. En: Journal of Limnology, 60(1), pp.79-90. DOI: http://dx.doi.org/10.4081/jlimnol.2001.79
Adams, D. y Naguib, N., 1999. Carbon gas cycling in the sediments of Plußsee, a northern German eutrophic lake and 16 nearby water bodies of Schleswig-Holstein. En: Archiv fur Hydrobiologie. Spec. Issues, 54, pp. 91-104. DOI: https://doi.org/10.1080/05384680.1996.11904069
Adams, D., Vila, I., Pizzarro, J. y Salazar C., 2000. Gases in the sediments of two eutrophic Chilean reservoirs: Potential sediment oxygen demand and sediment-water flux of CH4 and CO2 before and after an El Niño event. En: Verhandlungen des Internationalen Verein Limnologie 27(3), pp.1376-1381. DOI: https://doi.org/10.1080/03680770.1998.11901461
Andersen, J., 1976. An ignition method for determination of total phosphorus in lake sediments. En: Water Research, 10(4), pp. 329-331. DOI: https://doi.org/10.1016/0043-1354(76)90175-5
American Public Health Association, American Water Works Association y Water Environment Federation, 2005a. Standard methods for the examination of water and wastewater. 21a ed. Washington: APHA. Standard Method 4500-PT-E, Approved 1997-Rev. 2011.
American Public Health Association, American Water Works Association y Water Environment Federation, 2005b. Standard methods for the examination of water and wastewater. 21a ed. Washington: APHA. Standard Method 4500-P-E, Approved 1997-Rev. 2011.
American Public Health Association, American Water Works Association y Water Environment Federation, 2005c. Standard methods for the examination of water and wastewater. 21a ed. Washington: APHA. Standard Method 4500-NO3-E, Approved 1997-Rev. 2011.
American Public Health Association, American Water Works Association y Water Environment Federation, 2005d. Standard methods for the examination of water and wastewater. 21a ed. Washington: APHA. Standard Method 4500-NH4-F, Approved 1997-Rev. 2011.
American Public Health Association, American Water Works Association y Water Environment Federation, 2005e. Standard methods for the examination of water and wastewater. 21a ed. Washington: APHA. Standard Method 2540-D, Approved 1997-Rev. 2011.
American Public Health Association, American Water Works Association y Water Environment Federation, 2005f. Standard methods for the examination of water and wastewater. 21a ed. Washington: APHA. Standard Method 2540-E, Approved 1997-Rev. 2011.
Barros, N., Cole, J., Tranvik, L., Prairie, Y., Bastviken, D., Huszar, V., Del Giorgio, P. y Roland F., 2011. Carbon emission from hydroelectric reservoirs linked to reservoir age and latitude. En: Nature Geoscience, 4(9), pp. 593-596. DOI: https://doi.org/10.1038/ngeo1211
Bonilla, S., Haakonsson, S., Somma, A., Gravier, A., Britos, A., Vidal, L., De León, L., Brena, B., Pírez, M., Piccini, C., Martínez de la Escalera, G., Chalar, G., González-Piana, M., Martigani, F. y Aubriot, L., 2015. Cianobacterias y cianotoxinas en ecosistemas límnicos de Uruguay. En: INNOTEC 10, pp. 9-22. DOI: https://doi.org/10.26461/10.01
Bižić, M. (Bizic), Klintzsch, T., Ionescu, D., Hindiyeh, M.Y., Günthel, M., Muro-Pastor, A.M., Eckert, W., Urich, T., Keppler, F. y Grossart, H., 2020. Aquatic and terrestrial cyanobacteria produce methane. En: Science Advisor, 6(3), eaax5343. DOI: https://doi.org/10.1126/sciadv.aax5343
Brasil. Ministério de Minas e Energia, 2012. Estado da arte em ciclo do carbono em reservatórios – Revisão bibliográfica. Rio de Janeiro: MME. 237p.
Casciotti, K.L. y Buchwald, C., 2012. Insights on the marine microbial nitrogen cycle from isotopic approaches to nitrification. En: Frontiers in Microbiology, 3, pp. 1-14. DOI: https://doi.org/10.3389/fmicb.2012.00356
Castro-González, M. y Torres-Valdés, V., 2015. Gases invernadero en aguas con bajo oxígeno en el reservorio eutrófico de Prado (Colombia). En: Revista Académica Colombiana de Ciencias Exactas Físicas y Naturales, 39(152), pp. 399-407. DOI: https://doi.org/10.18257/raccefyn.228
Ciais, P. y Sabine, C., 2013. The physical science basis. Contribution of working group I to the fifth assessment report of the intergovernmental panel on climate change. En: Stocker, T.F., Qin, D., Plattner, G.K., Tignor, M., Allen, S.K., Boschung, J., Nauels, A., Xia, Y., Bex, V. y Midgleyl, P.M., eds., 2013. Climate Change 2013. Cap. 6. Cambridge: Cambridge University Press.
Chalar, G., Fabián, D., González-Piana, M. y Delbene, L., 2010. Limnología de los embalses del Río Negro: Noviembre 2000 - Marzo 2009 [En línea]. Montevideo: Sección Limnología, Facultad de Ciencias, Udelar. [Consulta: 12 de enero 2022]. Disponible en: http://limno.fcien.edu.uy/pactuales/Rio%20Negro%20Inforrme%202000-2009.pdf
Chalar, G., Gerhard, M., González-Piana, M. y Fabián, D., 2014., Hidroquímica y eutrofización en tres embalses subtropicales en cadena. En: Marcovecchio, J.E., Botté, S.E. y Freije, R.H., eds., 2014. Procesos geoquímicos superficiales en Sudamérica. Salamanca: Nueva Graficesa. pp. 121-148.
Chalar, G., Fabián, D., González-Piana, M. y Piccardo, A., 2015. Informe interanual. Estado y evolución de la calidad de agua de los tres embalses del Río Negro: Convenio UTE- Facultad de Ciencias. Período setiembre 2011 - Marzo 2015. Montevideo: Sección Limnología, Facultad de Ciencias, Udelar. [Consulta: 12 de enero 2022]. Disponible en:http://limno.fcien.edu.uy/pactuales/EUTROFIZACION-Y-CALIDAD-DE-AGUA-DE-LOS-EMBALSES-DEL-RIO-NEGRO-2011-2015.pdf
Chorus, I., Bartram, J., 1999. Toxic cyanobacteria in water: a guide to their public health consequences monitoring and management. Londres: E. & FN Spon.
Cole, J., Prairie, Y., Caraco, N., Mcdowell, W., Tranvik, L., Striegl, R., Duarte, C., Kortelainen, P., Downing, J., Middelburg, J. y Melack, J., 2007. Plumbing the global carbon cycle: Integrating inland waters into the terrestrial carbon budget. En: Ecosystems, 10(1), pp. 171-184.
Donis, D., Flury, S., Stöckli, A., Spangenberg, J., Vachon, D. y McGinnis, D., 2017. Full-scale evaluation of methane production under oxic conditions in a mesotrophic lake. En: Nature Communications, 8, pp.1661. DOI: https://doi.org/10.1038/s41467-017-01648-4
Fearnside, P., 2005. Do hydroelectric dams mitigate global warming? The case of Brazil´s Curuá-Una dam. En: Mitigation and Adaptation Strategies to Global Change, 10, pp.675-691. DOI: https://doi.org/10.1007/s11027-005-7303-7
Galy-Lacaux, C., Delmas, R., Kouadio, G., Richard, S. y Gosse, P., 1999. Long-term greenhouse gas emissions from hydroelectric reservoirs in tropical forest regions. En: Global Biogeochemicals Cycles, 13(2), pp.503-517. DOI: https://doi.org/10.1029/1998GB900015
González-Piana, M., Fabián, D., Delbene, L. y Chalar, G., 2011. Toxics blooms of Microcystis aeruginosa in three Rio Negro reservoirs, Uruguay. En: Harmful Algae News, 43, pp. 16-17.
González-Piana, M., Fabián, D., Piccardo, A. y Chalar, G., 2017. Dynamics of total microcystin LR concentration in three subtropical hydroelectric generation reservoirs in Uruguay, South America. En: Bulletin of Enviromental Contamination and Toxicology, 99(4), pp.488-492. DOI: https://doi.org/10.1007/s00128-017-2158-7
González-Piana, M., Piccardo, A., Ferrer, C., Brena, B., Pirez, M., Fabián, D. y Chalar, G., 2018. Effects of wind mixing in a stratified water column on toxic cyanobacteria and Microcystin-LR distribution in a subtropical reservoir. En: Boulletin of Enviromental Contamination and Toxicology, 101(5), pp.611-616. DOI: https://doi.org/10.1007/s00128-018-2446-x
Guérin, F. y Abril, G., 2007. Significance of pelagic aerobic methane oxidation in the methane and carbon budget of a tropical reservoir. En: Journal of Geophysical Research-Biogeosciences, 112(G03006). DOI: https://doi.org/10.1029/2006JG000393
Günthel, M., Donis, D., Kirillin, G., Ionescu, D., Bizic, M., McGinnis, D.F., Grossart, H. y Tang, K., 2019. Contribution of oxic methane production to surface methane emission in lakes and its global importance. En: Nature Communication, 10, pp.5497. DOI: https://doi.org/10.1038/s41467-019-13320-0
Gruca-Roksz, R., Tomaszek, A., Koszelnik, P. y Czerwieniec, E., 2010. Methane and carbon dioxide fluxes at the sediments-water interface in reservoirs En: Polish Journal of Enviromental Study, 20, pp. 81-86.
Huttunen, J., Väisänen, T., Hellsten, S. y Martikainen, P., 2006. Methane fluxes at the sediment-water interface in some boreal lakes and reservoirs. En: Boreal Enviromental Research,11, pp. 7-34.
International Organization for Standardization, 1992. 10260: Water quality. Measurement of biochemical parameters. Spectrometric determination of the chlorophyll-a concentration. Geneva: ISO.
Kiene, N.P. 1991. Production and consumption of methane in aquatic systems. En: Rogers, J.E. y Whitmann, W.B., ed. Microbial production and consumption of greenhouse gases: methane, nitrogen oxide and halomethanes. Washington: American Society for Microbiology. pp. 111-146.
Klintzsch, T., Langer, G., Nehrke, G., Wieland, A., Lenhart, K. y Keppler, F., 2019. Methane production by three widespread marine phytoplankton species: release rates, precursor compounds, and potential relevance for the environment. En: Biogeosciences, 16, pp.4129-4144. DOI: https://doi.org/10.5194/bg-16-4129-2019
Kuivila, K., Murray, J., Devol, A., Lidstrom, M. y Reimers C., 1988. Methane cycling in the sediments of lake Washington. En: Limnology Oceanography, 33(4), pp.571-581. DOI: https://doi.org/10.4319/lo.1988.33.4.0571
Liikanen, A., Huttunen, J., Valli, K. y Martikainen, P., 2002. Methane cycling in the sediment and water column of mid-boreal hyper-eutrophic Lake Kevätön Finland. En: Archiev fur Hidrobiologische, 154(4), pp.585-603. DOI: 10.1127/archiv-hydrobiol/154/2002/585
León-Palmero, E., Contreras-Ruiz, A., Sierra, A., Morales-Baquero, R. y Reche, I., 2020. Dissolved CH4 coupled to photosynthetic picoeukaryotes in oxic waters and cumulative chlorophyll-a in anoxic waters of reservoirs. En: Biogeoscience, 17(12), pp.3223-3245. DOI: http://dx.doi.org/10.5194/bg-17-3223-2020
Lenhart, K., Klintzsch, T., Langer, G., Nehrke, G., Bunge, M., Schnell, S. y Keppler, F., 2016. Evidence for methane production by the marine algae Emiliania huxleyi. En: Biogeosciences, 13(10), pp.3163-3174. DOI: https://doi.org/10.5194/bg-13-3163-2016
Lovley, D. y Klug, M., 1983. Sulfate reducers can outcompete methanogens at freshwater sulfate concentration. En: Applied Environmental Microbiology, 45(1), pp. 187-192.
Maeck, A., Del Sontro, T., Mc Ginnis, D., Fischer, H., Flury, S., Schmidt, M., Fietzek, P. y Lorke, A. 2013. Sediment trapping by dams creates methane emission hot spots. En: Enviromental Science & Technology, 47, pp.8130-8137. DOI: https://doi.org/10.1021/es4003907
Melack, J.M., 1996. Recent developments in tropical limnology. En: Verhandlungen des Internationalen Verein Limnologie, 26, pp.211–217. DOI: https://doi.org/10.1080/03680770.1995.11900704
Paerl, H. y Otten, T., 2013. Harmful cyanobacterial blooms: causes, consequences and functions. En: Microbial Ecology 65(4), pp.995-1010. DOI: /10.1007/s00248-012-0159-y
Panhniban, A., Patt T., Hart, W. y Hanson, R., 1979. Oxidation of methane in the absence of oxygen in lake water samples. En: Applied Enviromental Microbiology, 66, pp.1126-1132. DOI: 10.1128/aem.37.2.303-309.1979
Peeters, F., Encinas Fernandez, J. y Hofmann, H., 2019. Sediment fluxes rather than oxic methanogenesis explain diffusive CH4 emissions from lakes and reservoirs. En: Scientific Reports, 9, p 243. DOI: https://doi.org/10.1038/s41598-018-36530-w
Rolletschek, H., 1997. Temporal and spatial variations in methane cycling in Lake Müggelsee. En: Archiv fur Hydrobiologie, 140(2), pp.195-206. DOI: https://doi.org/10.1127/archiv-hydrobiol/140/1997/195
Salas, H. y Martino P., 1990. Metodologías simplificadas para la evaluación de la eutrofización en lagos cálidos tropicales. Lima: CEPIS/HPE/OPS.
Sidagis Galli, C., Abe, D., Tundisi, J., Texiera-Silva, V., Medeiros, G., Brum, P. y Cimbleris, A., 2009. Greenhouse gas concentrations and diffusive flux at the sediment-water interface from two reservoirs in Brazil. En: Verhandlungen des Internationalen Verein Limnologie 30, pp.830-833. DOI: https://doi.org/10.1080/03680770.2009.11902250
Sweerts, J., Rudd, J. y Kelly, C., 1996. Metabolic activities in flocculent surface sediments and underlying sandy littoral sediments. En: Limnology Oceanography, 31(2), pp.330-338. DOI: https://doi.org/10.4319/lo.1986.31.2.0330
Smith, K., Ball, T., Conen, F., Dobbie, K., Massheder, J. y Rey, A., 2003. Exchange of greenhouse gases between soil and atmosphere: Interactionsof soil physical factors and biological processes. En: European Journal of Soil Science, 54, pp.779-791. DOI: https://doi.org/10.1111/ejss.12538
Utsumi, M., NoriJi, Y., Nakamura T., Nozawa T., Otsuki A., Takamura N., Watanabe M. y Seki, H., 1998. Dynamics of dissolved methane and methane oxidation in dimictic lake Nojiri during winter. En: Limnology Oceanography, 43(1), pp.10-17. DOI: https://doi.org/10.4319/lo.1998.43.1.0010
Valderrama, J., 1981. The simultaneous analysis of total nitrogen and total phosphorus in natural waters. En: Marine Chemistry, 10(2), pp.109-122. DOI: https://doi.org/10.1016/0304-4203(81)90027-X
Wang, Q., Dore, J. y McDermott, T., 2017. Methylphosphonate metabolism by Pseudomonas sp. populations contributes to the methane oversaturation paradox in an oxic freshwater lake: Methylphosphonate and aquatic CH 4 oversaturation. En: Environmental Microbiology, 19, pp. 2366–2378. DOI: https://doi.org/10.1111/1462-2920.13747
Yao, M., Henny, C. y Maresca, J., 2016. Freshwater bacteria release methane as a by-product of phosphorus acquisition. En: Applied Environmental Microbiology, 82, pp.6994–7003. DOI: https://doi.org/10.1128/AEM.02399-16


