Autores
- SOMMA, ANDREA (1); NOGUEIRA, LUCÍA (1); GONZÁLEZ-MADINA, LUCÍA (1); LANGONE, JOSÉ A. (1)
- (1) LABORATORIO DE HIDROBIOLOGÍA, USINA DE AGUAS CORRIENTES, ADMINISTRACIÓN DE LAS OBRAS SANITARIAS DEL ESTADO. CANELONES, URUGUAY.
El mejillón dorado (Limnoperna fortunei) es una especie exótica invasora que causa grandes perjuicios en América del Sur. El río Santa Lucía es la principal fuente de agua potable que abastece al 60% de la población de Uruguay. L. fortunei ha sido reportado desde 1996 en esta cuenca y actualmente se encuentra en los tres embalses que abastecen a la usina potabilizadora. El objetivo de este trabajo fue caracterizar la dinámica temporal de las larvas de L. fortunei en el embalse de Aguas Corrientes (río Santa Lucía). Para esto se realizaron análisis diarios del embalse, donde se midieron parámetros fisicoquímicos, y se cuantificaron larvas y la comunidad fitoplanctónica. Las larvas de L. fortunei presentaron una dinámica estacional y su desarrollo fue favorable a temperaturas mayores a los 17°C. La temperatura fue la principal variable moduladora de la presencia de larvas. Una vez que la temperatura fue adecuada para su reproducción, la cota del embalse resultó ser la variable clave para determinar la presencia de larvas. Esto evidencia la importancia del manejo del caudal del embalse durante la época reproductiva del mejillón para disminuir sus impactos. Se plantean dos mecanismos de regulación de las larvas que actúan a diferentes escalas: fisiológico y ambiental.
PALABRAS CLAVE: temperatura, caudal, usina potabilizadora de agua, invasión biológica.
O mexilhão dourado (Limnoperna fortunei) é uma espécie exótica invasora que causa grandes danos em America do Sul. O rio Santa Lucía é a principal fonte de água potável que abastece 60% da população do Uruguai. L. fortunei é registrada desde 1996 na bacia e atualmente é encontrada nos três reservatórios principais que abastecem a estação de tratamento de água. O objetivo deste trabalho foi caracterizar a dinâmica temporal de larvas de L. fortunei no reservatório de Aguas Corrientes (rio Santa Lucía). Para isso, foram realizadas análises diárias do reservatório, onde foram medidos parâmetros físico-químicos e quantificadas as larvas e a comunidade fitoplanctônica. As larvas de L. fortunei apresentaram dinâmica sazonal e seu desenvolvimento foi favorável em temperaturas superiores a 17°C. A temperatura foi a principal variável moduladora da presença de larvas. Uma vez que a temperatura foi adequada para sua reprodução, a elevação do reservatório passou a ser a variável chave para determinar a presença de larvas. Isso mostra a importância do gerenciamento da vazão do reservatório para reduzir os impactos do mexilhão dourado. Ao mesmo tempo, dois mecanismos de regulação das larvas são propostos atuando em diferentes escalas: fisiológica e ambiental.
PALAVRAS-CHAVE: temperatura, fluxo, planta de purificação de água, invasão biológica.
Introducción
Las invasiones biológicas son una de las principales pérdidas de biodiversidad a nivel mundial (Gallardo, et al., 2015; Sala, et al., 2000). El mejillón dorado (Limnoperna fortunei) es una especie exótica invasora en América del Sur (Oliveira, et al., 2015). Limnoperna fortunei ingresó al continente por el Río de la Plata, en el año 1990 (Pastorino, et al., 1993), y rápidamente se expandió por toda la cuenca, a contracorriente, afectando a los ríos Paraná y Uruguay, entre otros, y abarcando Argentina, Uruguay, Brasil, Paraguay y Bolivia, en su nueva área de distribución (Oliveira, et al., 2015). Esta especie presenta características morfofuncionales que favorecen la rápida colonización y su éxito en diferentes ambientes (Morton, 2015). Entre estas características, el estadio larval planctónico de L. fortunei puede alcanzar altas densidades (>20.000 ind/m3), lo que le permite una alta dispersión por deriva en el ambiente natural (Cataldo, 2015). A su vez, los organismos adultos adheridos a sustratos como artes de pesca y cascos de embarcaciones resisten la desecación (entre 7 y 11 días fuera del agua) (Darrigran, et al., 2004; Montalto y Ezcurra de Drago, 2003), lo que permite otro mecanismo de dispersión.
El asentamiento de L. fortunei en los ecosistemas ha presentado un alto impacto tanto en el ambiente natural (Darrigran y Damborenea, 2011) como en las infraestructuras humanas (Darrigran, et al., 2020). Se han documentado cambios en la comunidad bentónica (Linares, et al., 2017; Silva, et al., 2020), fitoplanctónica (Boltovskoy, et al., 2015a, 2013) y zooplanctónica (Rojas Molina, et al., 2015), así como su capacidad de incorporarse a las tramas tróficas de los peces (Garcia y Protogino, 2005; González-Bergonzoni, et al., 2020; Penchaszadeh, et al., 2000). Las principales interferencias a nivel humano hasta ahora detectadas son: macrofouling (obstrucción por altas densidades de organismos vivos adheridos) en tomas y tuberías de aguas para potabilización, uso industrial y centrales energéticas, e interferencias en la navegación, y en la pesca comercial y deportiva, entre otras; produciendo elevados perjuicios económicos (Darrigran, et al., 2007, Boltovskoy, et al., 2015c; Xu, et al., 2015). Hay numerosos ejemplos de instalaciones industriales que han tenido problemas en su funcionamiento debido a la colonización del mejillón dorado (Boltovskoy, et al., 2015c). En China y Japón ha afectado diferentes plantas potabilizadoras y sistemas de distribución de agua desde hace décadas (Morton, 1975; Nakanishi y Mukai, 1997). A principios de 1994, Limnoperna fortunei provocó el primer caso de macrofouling de agua dulce en América. Este hecho ocurrió en la planta potabilizadora de agua de la Ciudad de La Plata, Argentina (Darrigran, 1995). Otros casos ocurrieron en las tomas de agua para consumo humano de Bernal (34º40´S - 58º14´O) y de la Ciudad de Buenos Aires (34º35´S - 58º22´O) (Darrigran, 1995; Darrigran y Ezcurra de Drago, 2000). Aunque no han sido formalmente publicados otros registros, se estima que otras plantas potabilizadoras experimenten similares problemas dada la extendida distribución que posee esta especie en la región (Oliveira, et al., 2006).
La cuenca del río Santa Lucía se ubica al sur de Uruguay (entre 33º42’18” - 34º50’24”S y 54º59’24” - 57º07’11”O) y tiene un área de 13.480 km2. Esta cuenca está constituida por cinco grandes tributarios: río Santa Lucía, río Santa Lucía Chico, arroyo Canelón Grande, arroyo Canelón Chico y río San José, y cuenta con tres embalses principales (Aguas Corrientes, Canelón Grande y Paso Severino), que actúan como reservas para garantizar el suministro de agua bruta a la planta potabilizadora de Aguas Corrientes (Figura 1). Esta planta pertenece a la Administración de las Obras Sanitarias del Estado (O.S.E.) y abastece al 60% de la población del país (Figura 1).
En esta cuenca, el primer reporte de Limnoperna fortunei data de 1996 (Brugnoli, et al., 2005). Entre 2000 y 2003 se registró en varias localidades de la cuenca, incluyendo el embalse de Paso Severino (Langone, 2005) y el de Aguas Corrientes (Brugnoli, et al., 2005). En la actualidad también ha colonizado el embalse Canelón Grande (observación personal). Langone (2005) plantea que en el río Santa Lucía, L. fortunei presenta dos mecanismos de colonización: a través de adultos adheridos a pequeñas embarcaciones y por dispersión de sus larvas (en dirección aguas abajo).
En la usina potabilizadora de agua de Aguas Corrientes, Limnoperna fortunei ha causado interferencias en la operativa de la planta desde el año 2000. Entre ellas se destacan: taponamiento de rejas y cribas de las tomas, disminución del caudal de captación debido a la colonización de los túneles, tuberías y parshalls, mayor gasto de energía y baja en el servicio de bombas aductoras. Hasta el momento, la principal medida reactiva ha sido la remoción mecánica de los adultos de las superficies colonizadas. Esta medida fue elegida debido a su bajo costo e inocuidad ambiental. Las sustancias químicas utilizadas para el control del mejillón dorado suelen ser costosas, pueden tener efectos tóxicos, generar subproductos indeseados (Claudi y de Oliveira, 2015) y su aplicación no está regulada por la norma.
El objetivo de este trabajo fue caracterizar la dinámica de las larvas de Limnoperna fortunei en el embalse de Aguas Corrientes (río Santa Lucía) con la finalidad de brindar pautas para la mejora del manejo y gestión de la usina potabilizadora de agua.
Materiales y Métodos
Área de estudio
La represa de Aguas Corrientes, inicialmente construida en 1933, asegura la altura de agua del río necesaria para la succión de las bombas hacia la usina de potabilización. En la actualidad retiene un volumen embalsado aproximado de 1.800.000 m3. Cuando las condiciones de caudal del río no son suficientes para garantizar el nivel operativo, se realizan bombeos desde aguas abajo del embalse hacia aguas arriba de la presa a través de dos bombas. Por otro lado, la represa cuenta con dos compuertas que permiten regular la altura del embalse. La cota de rebase de esta represa es de 2,90 metros en su parte central y 3,10 metros en los laterales (sobre el cero Aguas Corrientes).
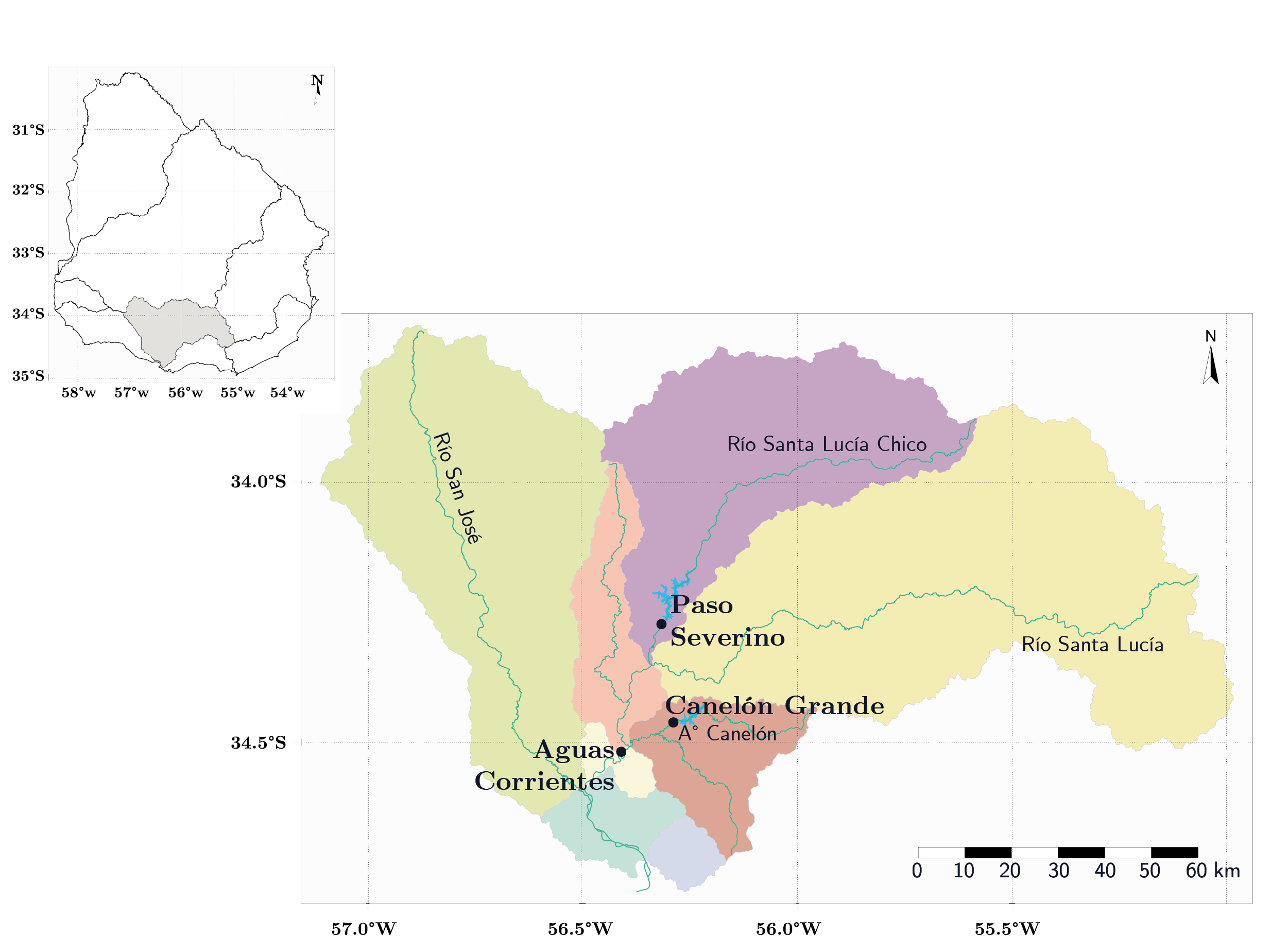
Figura 1. Mapa de la cuenca del río Santa Lucía. Se muestran los principales tributarios y grandes embalses (puntos): Paso Severino, Canelón Grande y Aguas Corrientes. Los colores representan la clasificación de Cuencas Nivel 2 según la DINAMA (Uruguay. Ministerio de Vivienda Ordenamiento Territorial y Medio Ambiente, DINAMA, 2020).
Trabajo de campo y laboratorio
Se realizaron muestreos diarios subsuperficiales del agua del río Santa Lucía en el margen izquierdo del embalse de Aguas Corrientes, entre el 02/11/2016 y el 20/07/2020. Estos muestreos son el resultado de la rutina del programa de monitoreo fisicoquímico e hidrobiológico de usina y cuenca de los respectivos Laboratorios de la Unidad Usinas de O.S.E. En cada muestreo se midió la cota del embalse (m) y la temperatura (ºC), y se tomaron muestras para la cuantificación de las variables fisicoquímicas, la comunidad de fitoplancton y las larvas de Limnoperna fortunei. Las variables fisicoquímicas de turbidez (NTU), color (mg/l Pt), alcalinidad (mg/l CaCo3), pH, oxígeno disuelto (mg/l) y conductividad (μS/cm a 25ºC) fueron determinadas según los procedimientos del Laboratorio Unidad Usinas de Montevideo (American Public Health Association, et al., 2017a, 2017b, 2017c, 2017d, 2017e y 2017f, respectivamente). La cuantificación de la comunidad de fitoplancton se realizó siguiendo el método de Utermöhl (Sournia, 1978), en cámaras de sedimentación de 2 ml en microscopio óptico invertido a 400 aumentos. Se cuantificaron todos los organismos presentes en media cámara o hasta cuantificar 100 organismos de la especie más abundante (Lund, 1958). La abundancia de fitoplancton y cianobacterias fue expresada en células por mililitro (cel/ml). La cuantificación de las larvas de L. fortunei se realizó dentro del programa de monitoreo rutinario de invertebrados. Para esto, se filtraron entre 500 y 1000 ml de muestra (dependiendo de la turbidez) por un copo de 25 μm de poro, y se contabilizaron las larvas bajo microscopio óptico a un aumento de 100x. Solamente se cuantificaron las larvas en estadio “forma de D” o de “charnela recta” (115-180 μm de largo), según Santos y otros (2005) y Cataldo (2015), y se expresó en ind/m3. Esta metodología de conteo permite determinar los períodos en los que las instalaciones industriales son más vulnerables a la colonización de esta especie y es útil para controlar las incrustaciones (Cataldo, et al., 2005).
Análisis de datos
La base de datos obtenida cuenta con 1.356 observaciones diarias. Debido a la distribución de las variables, se realizaron correlaciones no paramétricas de Kruskal-Wallis y pruebas pareadas a posterior de Wilcoxon entre las medianas de las variables ambientales y de los estimadores de la comunidad de fitoplancton, con la finalidad de determinar diferencias significativas entre años, meses y estaciones del año. Las relaciones entre las variables ambientales y fitoplanctónicas fueron evaluadas a través de un análisis de componentes principales (PCA por sus siglas en inglés), con la función base “princomp” del Software R (R Core Team, 2018), y de correlaciones no paramétricas de Spearman. Para el PCA, las variables fueron centradas por la media y estandarizadas por el desvío estándar. En función del resultado de estos análisis, se seleccionó un conjunto de variables que mejor explicaran la variabilidad ambiental y que no fueran redundantes.
Con la finalidad de estudiar el comportamiento intrínseco de las larvas, se analizó la abundancia de larvas en función del tiempo y se determinó si existían diferencias significativas entre la abundancia y los meses, estaciones del año y años a través de pruebas no paramétricas de Kruskal-Walli; y en caso de que hubiera diferencias, se realizaron pruebas a posterior de Wilcoxon. La abundancia de larvas de L. fortunei fue contrastada con las variables ambientales seleccionadas por el PCA. A su vez, a través de árboles de clasificación y regresión (CART por sus siglas en inglés) se determinaron las principales variables ambientales y fitoplanctónicas, y sus umbrales para la clasificación de la presencia/ausencia de larvas. El árbol de complejidad óptima fue determinado en base a la “regla 1-SE” (error estándar estimado, Breiman, et al., 1984). Los CART fueron realizados con el paquete “rpart” (Therneau y Atkinson, 2019).
Los gráficos fueron realizados con “ggplot2” (Wickham, 2016) y “ggpubr” (Kassambara, 2020) y todos los análisis estadísticos se realizaron con el Software R, versión 3.5.2 (R Core Team, 2018).
Resultados
Características ambientales y fitoplanctónicas del embalse
Todas las variables ambientales (menos la lluvia y el cambio de nivel del embalse) presentaron diferencias significativas entre las estaciones del año (Figura 2). El cambio de nivel del embalse y las lluvias presentaron valores promedios similares entre estaciones del año y valores extremos (fuera del 1,5 x rango intercuartil) en todas las estaciones (Figura 2). La temperatura y el oxígeno disuelto (OD) presentaron un patrón estacional (Figura 2) con valores máximos de temperatura y mínimos de OD en el verano. El fitoplancton total y las cianobacterias también presentaron un patrón estacional (Figura 2). Las mayores abundancias de fitoplancton total se registraron en primavera, mientras que las cianobacterias fueron más abundantes durante el otoño y menos abundantes en primavera (Figura 2).
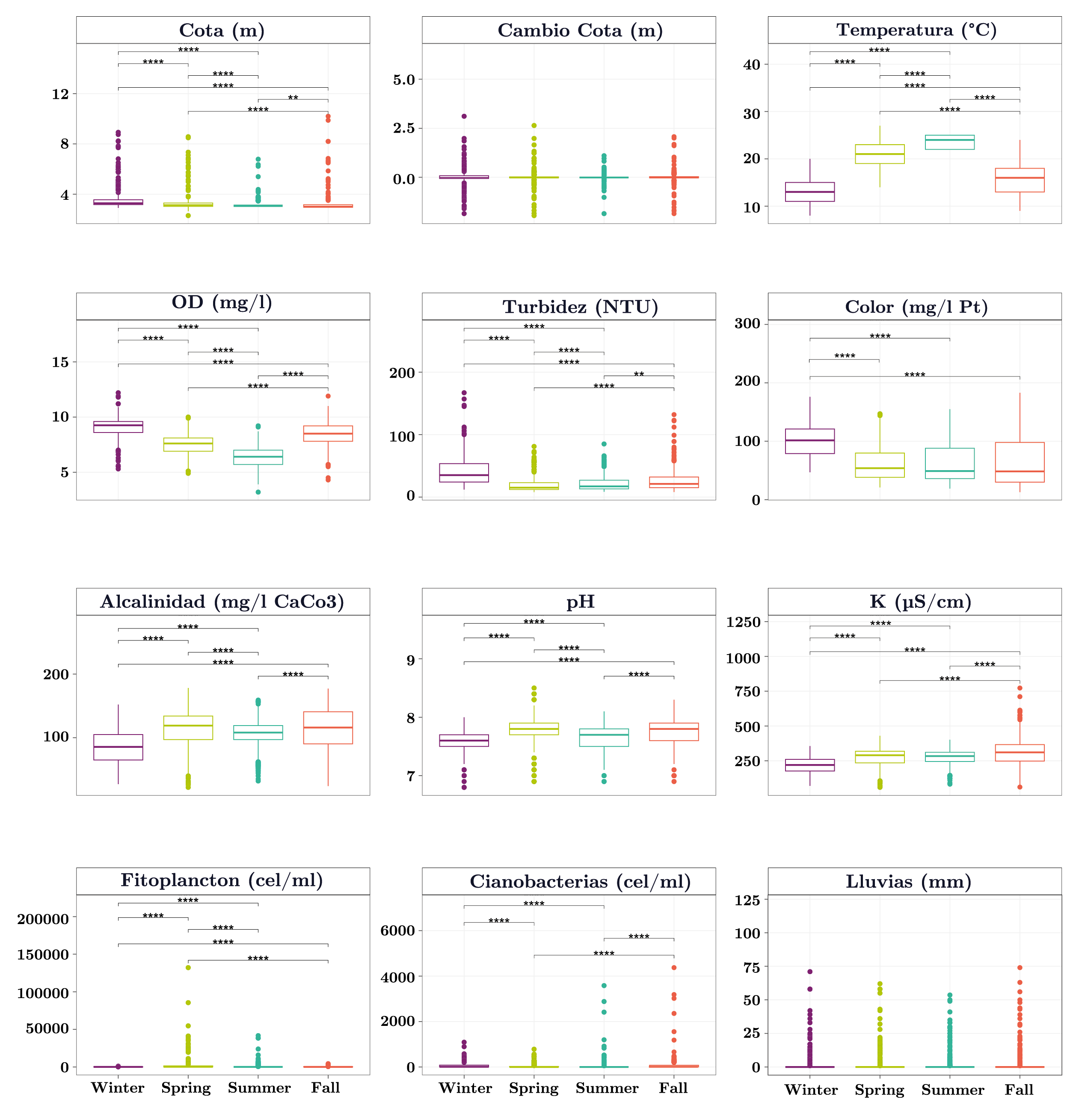
Figura 2. Boxplots de las variables ambientales y fitoplanctónicas en función de las estaciones del año para el embalse de Aguas Corrientes. Se indica la mediana (línea gruesa), los percentiles 25 y 75% (caja) y los valores 1,5 x rango intercuartil (bigotes). Los círculos son valores que se encuentran por fuera del 1,5 x rango intercuartil. Las líneas horizontales indican las comparaciones pareadas significativas y los asteriscos el valor de dicha significancia (*: p-valor <= 0,05; **: p-valor <= 0,01; ***: p-valor <= 0,001; ****: p-valor <= 0,0001).
El análisis de componentes principales (PCA) determinó las variables más importantes que influyeron en la varianza de los datos. Los primeros dos componentes del PCA explicaron el 71,8% de la varianza de los datos (Figura 3). El primer componente estuvo determinado principalmente por la cota (0,34), el color (0,41) y la turbidez (0,35) de forma positiva, y la alcalinidad (-0,44), el pH (-0,42) y la conductividad (-0,41) que influyeron negativamente. Según este componente, se puede establecer un gradiente desde condiciones con mayor cota y aguas turbias y menores valores de pH, conductividad y alcalinidad en un extremo, y condiciones de baja cota y aguas más claras asociadas a mayores valores de pH, conductividad y alcalinidad en el otro extremo. Las variables con mayor importancia para el segundo componente principal fueron la temperatura de forma positiva (0,64) y el oxígeno disuelto de forma negativa (-0,70), generando un gradiente con casos con temperaturas cálidas y bajos valores de OD, mientras que en el otro extremo se presentaron observaciones asociadas a menores temperaturas y mayores niveles de OD (Figura 3).
El pH, la alcalinidad y la conductividad estuvieron correlacionados positivamente entre sí, de la misma manera que la cota, la turbidez y el color. A su vez, estos dos grupos de variables se correlacionaron negativamente (Figura 3, Anexo 1). Cabe destacar que, debido al comportamiento particular del embalse de Aguas Corrientes, en general la cota no presentó una relación lineal con las variables mencionadas, sino que se observó un comportamiento diferencial dependiendo de si el embalse se encontraba rebasando (cota > 3,1m) o no (cota < 3,1m) (Anexo 1).
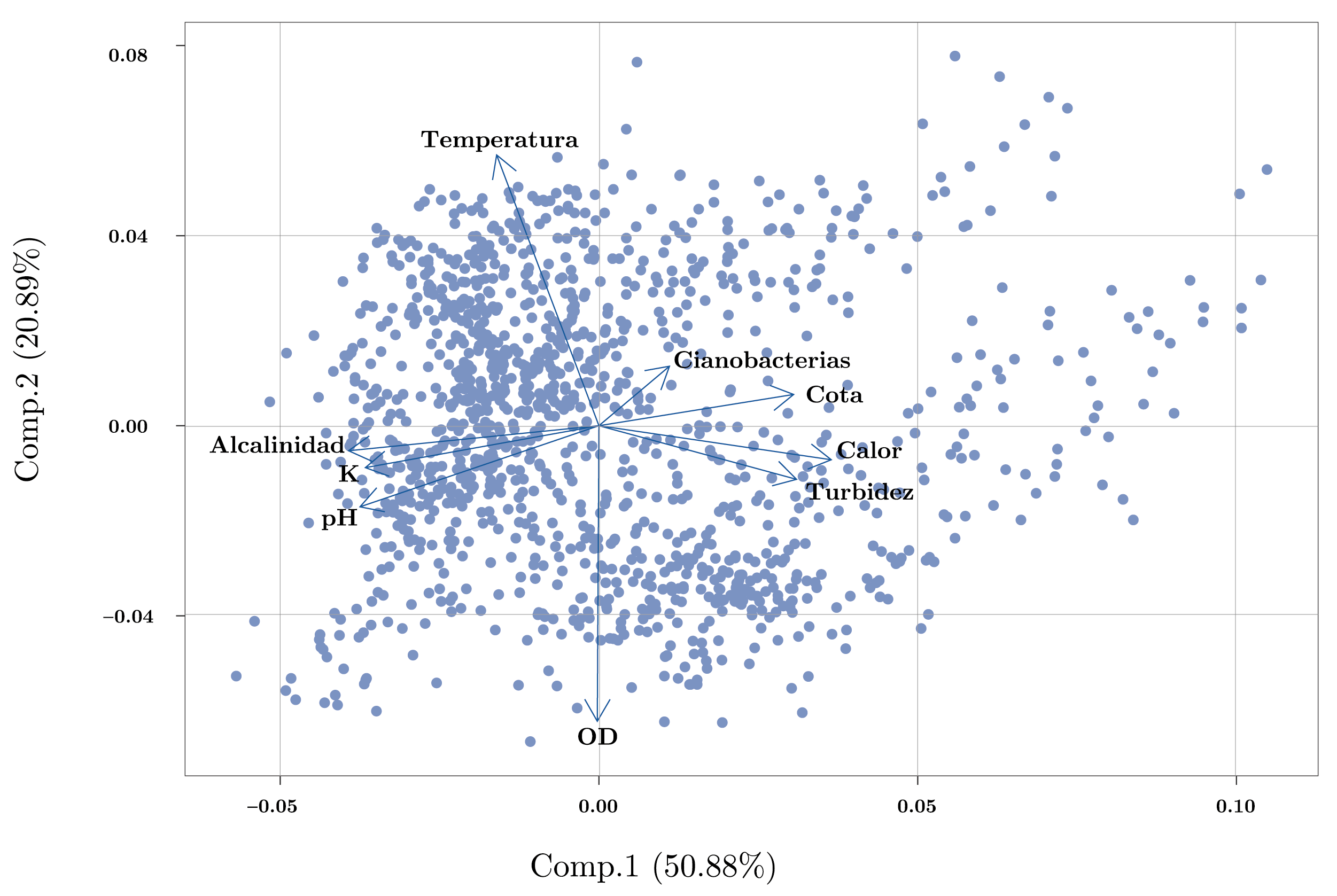
Figura 3. Análisis de componentes principales (PCA) de las principales variables ambientales y fitoplanctónicas del embalse de Aguas Corrientes. Las variables están centradas por la media y estandarizadas por el desvío estándar.
Dinámica de las larvas de Limnoperna fortunei
En la mayoría de los muestreos (76%) no se registraron larvas de Limnoperna fortunei. Las larvas presentaron un comportamiento estacional con mayores abundancias durante los meses más cálidos (noviembre-abril) y abundancias nulas durante el invierno (Figura 4a y b). El análisis estadístico de Kruskal-Wallis y la prueba a posterior de Wilcoxon para la abundancia de larvas en función de la estación del año y los meses evidenciaron dos “bloques” de datos: el primero de ausencia o bajas abundancias de larvas en la época más fría (mayo a octubre), y el segundo de altas abundancias en los meses más cálidos (noviembre a marzo). No se establecieron diferencias significativas a nivel intragrupo (primavera-verano y otoño-invierno), pero sí las hubo entre grupos.
Abril se comportó como un mes de transición entre los dos bloques de datos. En particular, diciembre fue el mes que presentó mayores abundancias de larvas (promedio = 8.600 ind/m3, Figura 4b, Wilcoxon: p-valor < 0,001 con todos los meses); y agosto el único mes que nunca registró larvas. Cabe destacar que la abundancia de larvas también presentó diferencias significativas (χ2 = 123,9, p-valor < 0,0001) entre años. En particular, el verano 2016-2017 fue el que registró la abundancia de larvas más alta (max = 88.000 ind/ m3) y la temporada 2018-2019, la que presentó la abundancia más baja (< 6.000 ind/ m3) (Figura 4a).
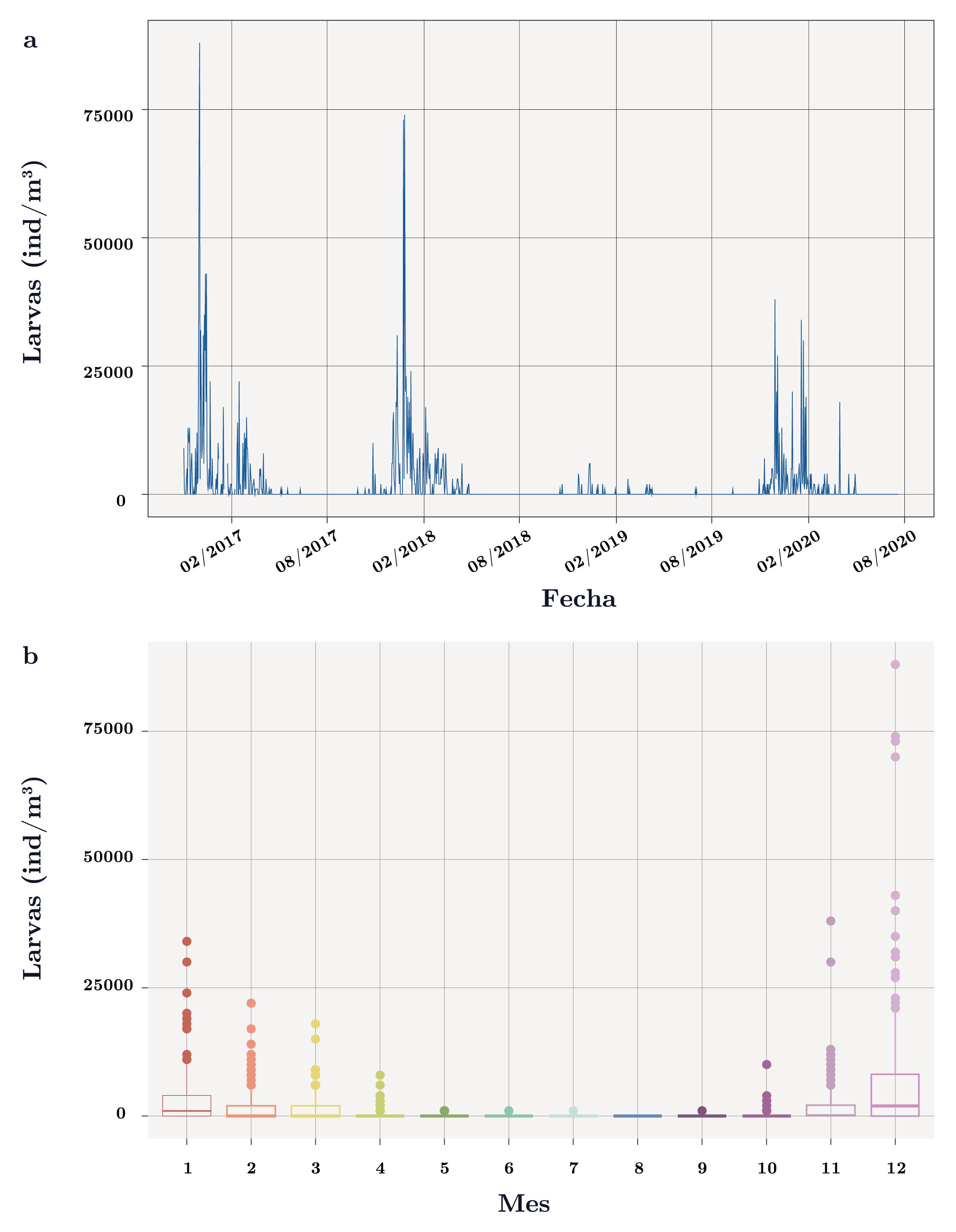
Figura 4. a) Dinámica de larvas de Limnoperna fortunei (ind/m3) en el tiempo en el embalse de Aguas Corrientes. b) Diagrama de cajas para la abundancia de larvas de L. fortunei(ind/m3) para cada mes (1: enero – 12: diciembre). Se indica la mediana (línea gruesa), los percentiles 25 y 75% (caja) y los valores 1,5 x rango intercuartil (bigotes). Los círculos son valores que se encuentran por fuera del 1,5 x rango intercuartil.
La temperatura fue la variable clave que determinó la presencia de larvas de L. fortunei (Figuras 4, 5 y 6). El umbral de temperatura para la presencia de larvas fue 17ºC, encontrándose únicamente 6 casos de presencias de larvas con temperaturas menores a 17ºC (0,4% de los datos, Figura 5).
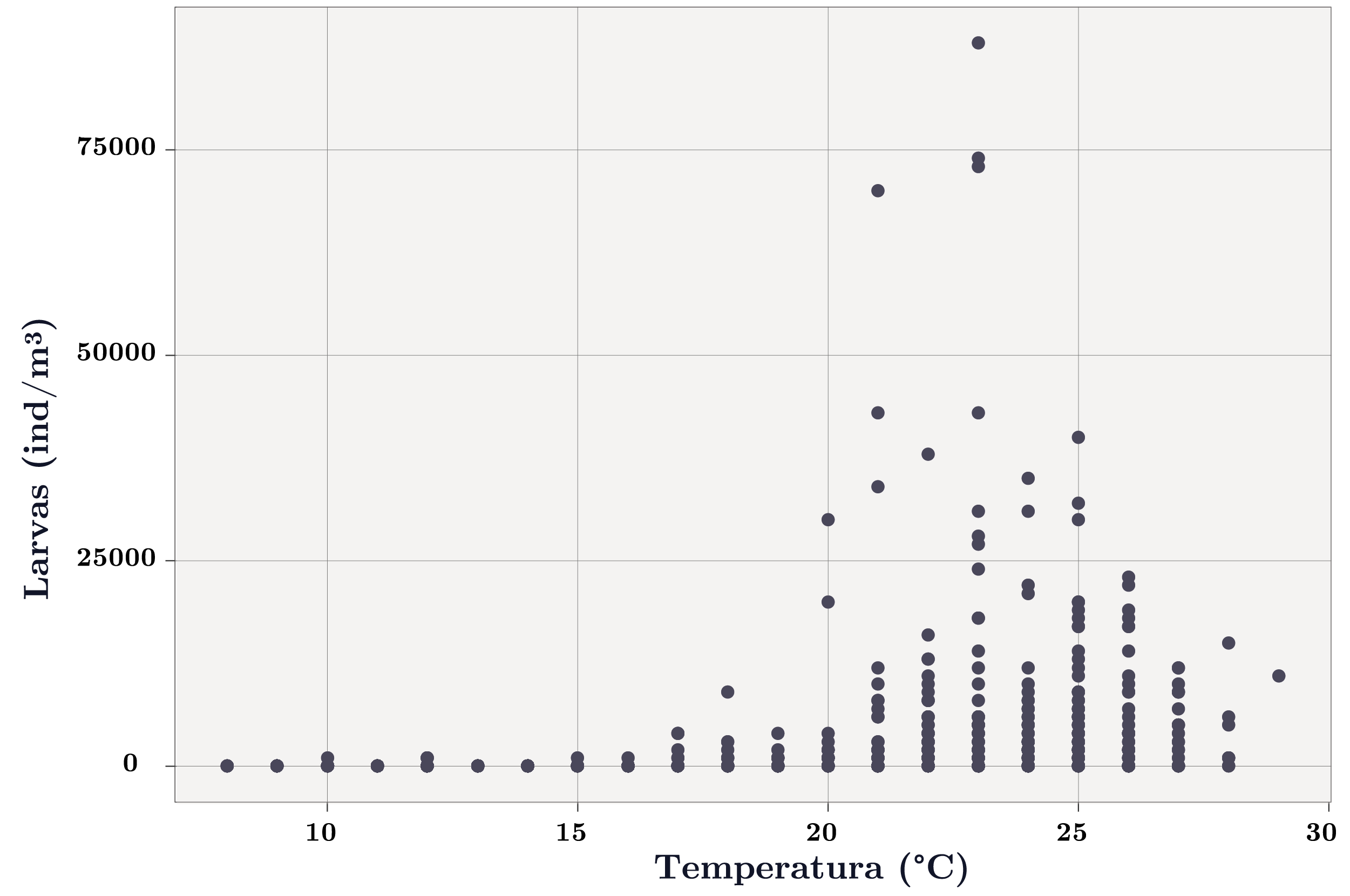
Figura 5. Abundancia de larvas de Limnoperna fortunei en función de la temperatura.
A partir de las variables más relevantes seleccionadas en el PCA como representativas de la variación ambiental (temperatura, cota, turbidez, abundancia de cianobacterias y oxígeno disuelto), se construyó un árbol de clasificación (CART) para la presencia y ausencia de larvas. A partir del CART de clasificación fue posible identificar a la temperatura como la principal variable seleccionada para explicar la presencia de las larvas (Figura 6: nodo 1). En este sentido, temperaturas menores a 21,5ºC registraron sólo un 7% de presencia de larvas (Figura 6: nodo 2). Para temperaturas mayores a 21,5ºC, la siguiente variable en determinar la presencia de larvas fue la cota (Figura 6: nodo 3): con valores mayores a 3,155 m, hubo solamente un 20% de presencias de larvas (Figura 6: nodo 4). Cuando las condiciones del río presentaron cotas menores 3,155 m y temperaturas mayores a 24,5°C, el 81% de los datos fueron presencias (Figura 6: nodo 11). Para temperaturas entre 21,5ºC y 24,5ºC y cotas menores a 3,155 m, la turbidez fue la variable que clasificó a las larvas (Figura 6: nodo 6). Bajo estas condiciones, con valores de turbidez mayores a 18,5 NTU, la mayoría de los datos fueron ausencias de larvas (65%; Figura 6: nodo 7). En los casos en que la turbidez fue menor a 18,5 NTU, las cianobacterias fueron la siguiente variable en explicar el comportamiento de las larvas (Figura 6: nodo 8): a valores de cianobacterias mayores a 8 cel/ml, la mayoría de los datos fueron ausencias de larvas (59%; Figura 6: nodo 9), mientras que ante valores de cianobacterias menores a 8 cel/ml, la mayoría de los datos (68%) correspondieron apresencia de larvas (Figura 6: nodo 10). Por último, cabe destacar que el 78% de las ausencias de larvas registradas se dieron con temperaturas menores a 21,5ºC, mientras que el 80% de las presencias se registraron con temperaturas mayores a 21,5ºC y el 73% de las presencias con temperaturas mayores a 21,5ºC y cotas menores a 3,155 m.
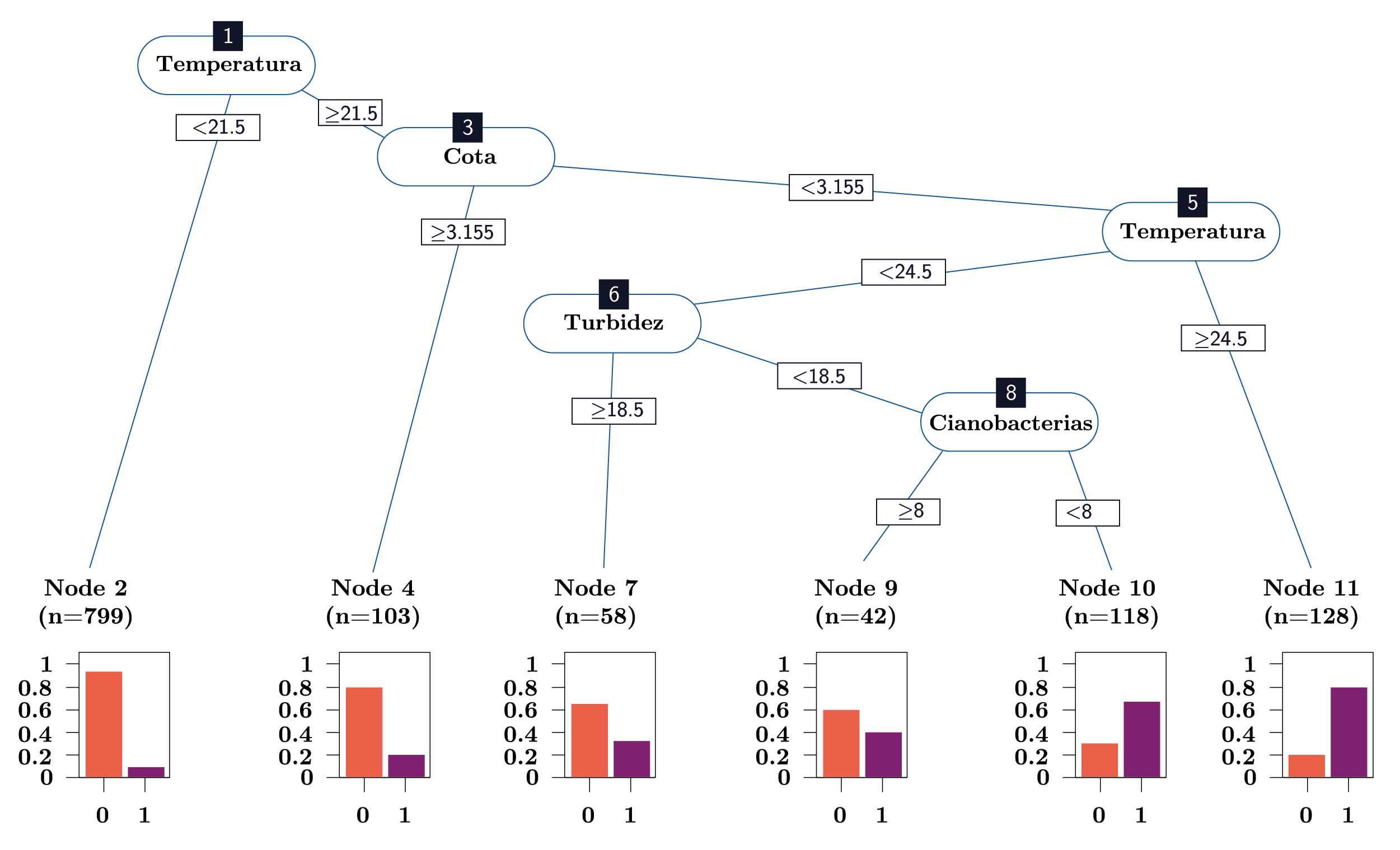
Figura 6. Árbol de clasificación (CART) para la presencia de larvas de L. fortunei. Las gráficas de barras en los nodos terminales representan la proporción de ausencias (0) y presencias (1) de larvas dentro de cada nodo.
Debido al efecto fisiológico que tiene la temperatura en la reproducción de L. fortunei (valor umbral = 17ºC), se analizó de forma univariada la abundancia de larvas en función del resto de las variables ambientales para temperaturas mayores a 17ºC.
Las mayores abundancias de larvas se registraron entre los 20 y 25ºC (Figura 5). Cuando la temperatura fue favorable para la reproducción de la especie (>17ºC), las larvas presentaron mayores abundancias en condiciones de cota por debajo del nivel de rebase de toda la presa (3,1 m; Figura 7) y/o cuando el cambio de nivel del río fue nulo, es decir, cuando el tiempo de residencia fue alto (Figura 7). Por su lado, la abundancia de larvas en función del color y la turbidez también presentaron un patrón similar: a mayor turbidez y color, menor abundancia de larvas (Figura 7). La alcalinidad, el pH y la conductividad influyeron de forma similar sobre la abundancia de larvas (solo se muestra K): mayor abundancia de larvas a mayores valores de estas variables (Figura 7). Las larvas y el fitoplancton total no evidenciaron un patrón marcado (Figura 7). Sin embargo, se observa que las mayores abundancias de larvas se dieron a bajas concentraciones de cianobacterias (Figura 7). Las menores abundancias de larvas se dieron frente a eventos extremos de precipitación estando sujetos a dinámicas similares a las del caudal y cota (Figura 7).
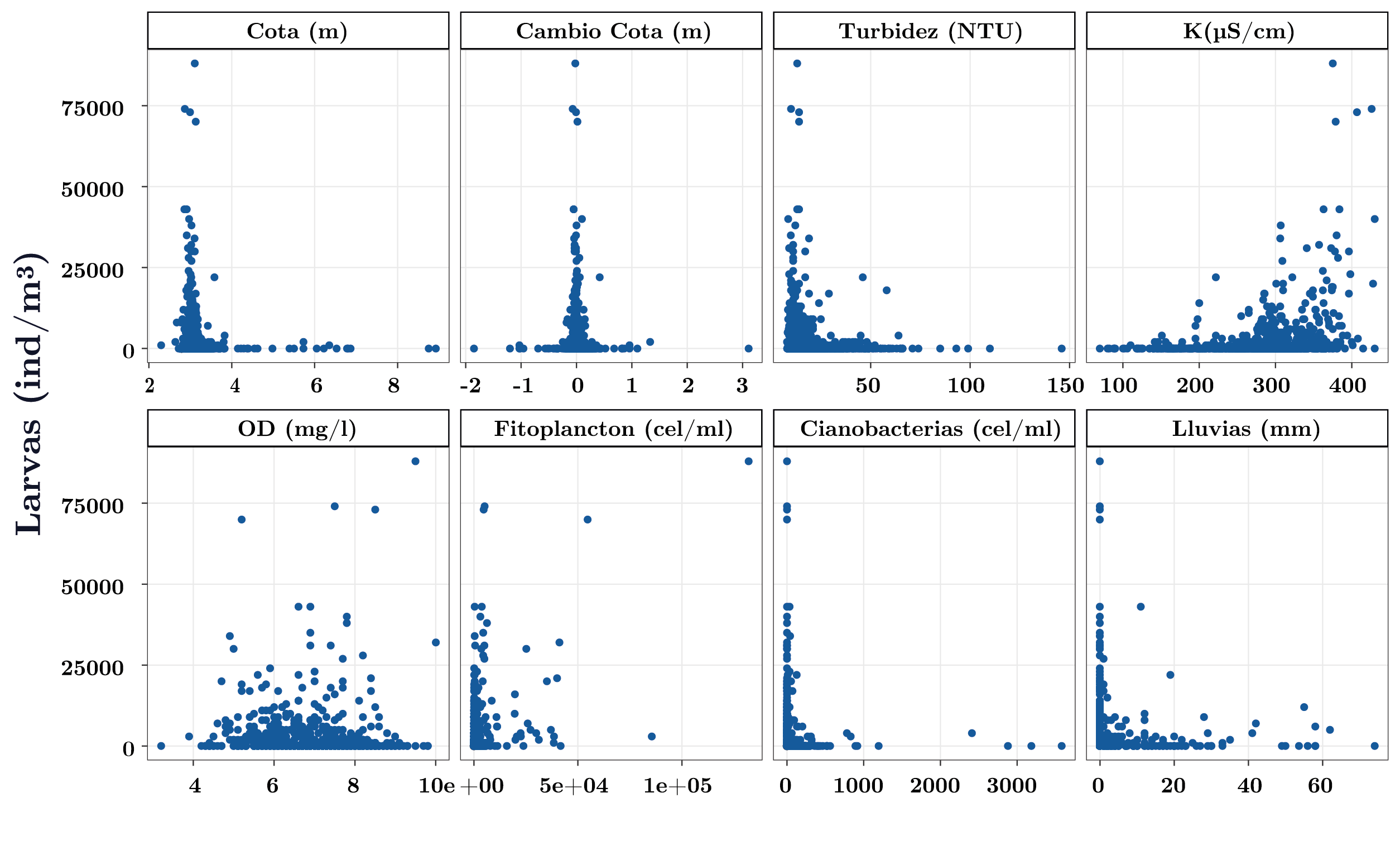
Figura 7. Abundancia de larvas de Limnoperna fortunei en función de las principales variables ambientales y fitoplanctónicas para temperaturas mayores a 17ºC.
Discusión
En este trabajo se determinaron por primera vez las principales variables ambientales y biológicas que modularon la dinámica de larvas de Limnoperna fortunei en el embalse de Aguas Corrientes. La alta abundancia de larvas encontradas refleja el grado de colonización del mejillón dorado en la cuenca en contraste con otros ecosistemas de la región (Boltovskoy, et al., 2009; Boltovskoy, et al., 2015b; Cataldo y Boltovskoy, 2000). En este estudio se observó que la dinámica larval estuvo determinada por características fisiológicas propias de la especie y por factores ambientales. En este sentido, y en concordancia con la literatura existente para la especie, se estableció un umbral de temperatura de 17ºC para la aparición de las larvas (Boltovskoy, et al., 2015b, 2009; Cataldo y Boltovskoy, 2000). Una vez que las condiciones de temperatura fueron adecuadas para su reproducción, la cota fue la segunda variable determinante de la presencia de larvas.
El éxito de una especie exótica invasora depende de las características fisiológicas de la especie y de su desempeño ante los filtros ambientales. El proceso de invasión puede definirse en cuatro etapas: transporte, establecimiento de la nueva población, crecimiento y expansión (Lockwood, et al., 2007). En general, el transporte está relacionado a la acción humana (accidental o intencionalmente) (Lockwood et al., 2007), como es el caso de L. fortunei, que llegó al Río de la Plata en el agua de lastre de barcos provenientes de Asia (Pastorino, et al., 1993) y fue transportado aguas arriba (Darrigran, et al., 2012; Oliveira, et al., 2015, 2006). Las características fisiológicas de la especie, como presentar un rápido crecimiento y maduración sexual y tener la capacidad de adaptarse a un amplio rango de condiciones ambientales (Morton, 1987), incluso limitantes para otras especies bentónicas, le permitió dispersarse no solo en la Cuenca del Plata sino en otras cuencas de América del Sur, como la del Guaiba, Patos-Mirím, Mar Chiquita y la del Río San Francisco, lo cual señala la agresividad de la invasión del mejillón dorado (Barbosa, et al., 2016; Giglio, et al., 2016; Oliveira, et al., 2015).
En localidades de la región donde L. fortunei es invasora, el rango normal de densidad de larvas es 6.000-7.000 ind/m3 y excepcionalmente puede alcanzar los 100.000 ind/m3, mostrando grandes fluctuaciones en cortos períodos de tiempo, dependiendo del tiempo post colonización y la disponibilidad de sustratos para el asentamiento de los adultos (Boltovskoy, et al., 2015b). Si bien las densidades larvales promedio observadas en el embalse de Aguas Corrientes se encuentran dentro del rango propuesto por Boltovskoy y otros (2015b), los valores máximos (88.000 ind/m3) se encuentran entre los más altos reportados. Esto refleja una avanzada colonización de individuos adultos tanto en el mismo embalse de Aguas Corrientes como aguas arriba. Grandes densidades de organismos adultos del mejillón dorado también pueden observarse en dos de los embalses más grandes de la cuenca: Paso Severino (Brugnoli, et al., 2005; Langone, 2005) y Canelón Grande (observación personal), que se encuentran a 37 y 20 km de distancia de Aguas Corrientes, respectivamente. Considerando que las larvas pueden demorar hasta 20 días en asentarse (Cataldo, et al., 2005) y que el agua demora unas 24 horas entre que sale de dichos embalses y llega al de Aguas Corrientes, las larvas encontradas podrían estar generándose en estos cuerpos de agua que presentan condiciones hidrológicas más favorables, como un mayor tiempo de residencia. A su vez, cabe destacar que a lo largo del río Santa Lucía existen varios sustratos aptos para la colonización del mejillón dorado (piedras, puentes, muelles, troncos, etc.) que también podrían oficiar de fuentes de larvas para el embalse de Aguas Corrientes.
En este trabajo se observaron larvas de L. fortunei durante una única estación reproductiva (6 meses: noviembre-abril). Este comportamiento ha sido encontrado por Boltovskoy y otros (2009) y por Cataldo y Boltovskoy (2000) en varios sistemas de la región (ej. Río Uruguay, Paraná y Río de la Plata). Por su lado, otros autores realizaron estudios histológicos de las gónadas de organismos adultos de L. fortunei y concluyeron que la especie presenta picos de reproducción (Giglio, et al., 2016; Darrigran, et al., 1999; Morton, 1977). En particular, Giglio y otros (2016) plantean que las especies invasoras requieren de un período de tiempo para el desarrollo de un patrón reproductivo una vez asentado en un nuevo entorno. Si se tiene en cuenta el grado de colonización de la cuenca y los múltiples posibles orígenes de las larvas en el embalse de Aguas Corrientes, es posible que estos picos de reproducción se encuentren solapados.
Este estudio demostró que en la cuenca del río Santa Lucía, la dinámica de larvas de L. fortunei dependió fuertemente de la temperatura. En concordancia con otros trabajos para la región (Boltovskoy, et al., 2015b, 2009; Cataldo y Boltovskoy, 2000), se determinó un umbral de 17°C para la aparición de larvas, donde por debajo de esta temperatura la producción de larvas es cercana a cero. Según Boltovskoy y otros (2015b), temperaturas entre 15 y 18°C han sido citadas por varios autores como el umbral para el desarrollo larval. Estas limitaciones se relacionan con la regulación de la maduración de las gónadas de la especie que está ligada a la temperatura (Morton, 1982; Darrigran, et al., 1999, 2003; Boltovskoy, et al., 2009; Giglio, et al., 2016). Si bien esto no es aplicable para cuerpos de agua tropicales (Giglio, et al., 2016), en muchas localidades templadas donde está presente L. fortunei es usual un período definido de “relajación reproductiva”, el cual invariablemente ocurre en los meses más fríos (Boltovskoy, et al., 2009). La variación térmica de las regiones templadas determina que el desencadenante reproductivo principal de la especie sea la temperatura (Boltovskoy, et al., 2015b). Sin embargo, otros factores asociados al tiempo y a la intensidad de la reproducción como pH, caudal, sólidos suspendidos, oxígeno disuelto y disponibilidad de fitoplancton son menos claros y parecerían estar basados en evidencia circunstancial (Boltovskoy, et al., 2009; Ernandes-Silva, et al., 2017, 2016; Oliveira, et al., 2011).
En el embalse de Aguas Corrientes, las mayores abundancias de larvas asociadas a cotas menores al nivel de rebase de todo el embalse (3,1m) y a los cambios de nivel nulos (estabilidad de la columna de agua) reflejan el efecto de la hidrología sobre las larvas planctónicas. En este sentido, durante cotas menores al nivel de rebase y con las compuertas cerradas, el sistema aumentaría su tiempo de residencia y se comportaría como un sistema “léntico”, lo que favorecería la abundancia de larvas planctónicas al disminuir el “lavado” o arrastre de larvas aguas abajo. Por su lado, el flujo continuo del embalse (tanto por rebase como por manejo de compuertas), que disminuiría el tiempo de residencia, favorecería el lavado de larvas aguas abajo y disminuiría la probabilidad de asentamiento en las rejillas, túneles, tuberías y parshalls de la usina potabilizadora.
La construcción de embalses para acopiar agua es un fenómeno en aumento a nivel mundial (Maberly y Wang, 2018; Zarfl, et al., 2015). El manejo de los caudales de los embalses es esencial en el proceso de potabilización del agua, no solo por asegurar la cantidad de agua y el nivel adecuado para el funcionamiento de las bombas, sino porque el tiempo de residencia de los mismos puede determinar el desarrollo de organismos nocivos. Algunos autores plantean que en los protocolos de manejo de los embalses deben tenerse en cuenta los parámetros de calidad de agua y no solamente la disponibilidad de agua (Bowling, et al., 2013; Mitrovic, et al., 2011). En este sentido, un manejo integral de los embalses de la cuenca es fundamental para el mantenimiento de la calidad del agua y la disminución de impactos indeseados, como floraciones algales nocivas y colonización de especies exóticas invasoras.
Agradecimientos
A Magno V. Segalla por traducir el resumen al portugués. Agradecemos a las personas que revisaron este manuscrito, quienes nos permitieron mejorar y aclarar buena parte del mismo.
Referencias
Anexos
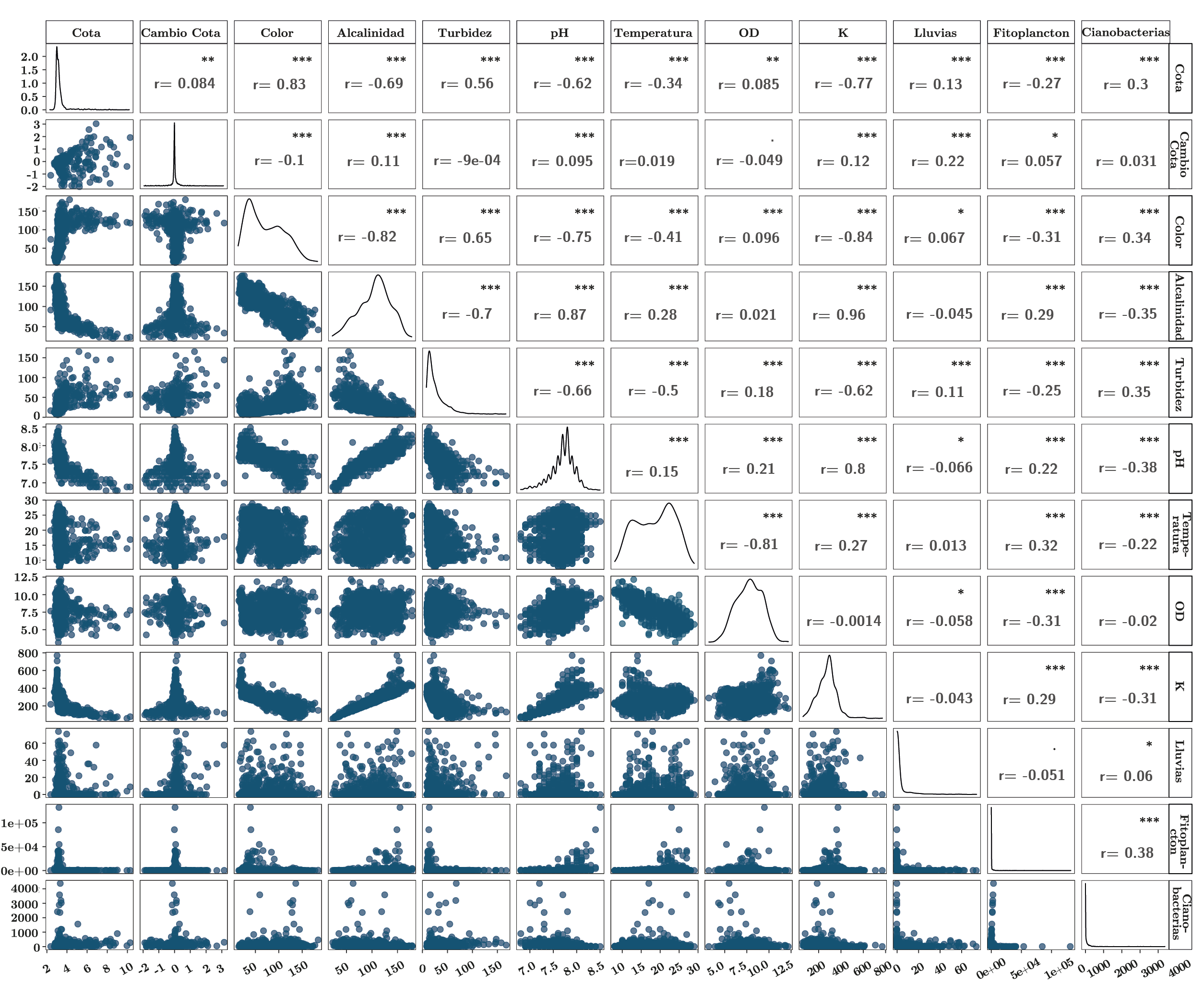
Anexo 1. Matriz de correlación entre las variables ambientales y fitoplanctónicas. Panel superior: coeficientes de correlación de Spearman y diferencias significativas marcadas con * (p-valores: ***, 0; **, 0.001; *, 0.05) entre las variables. Panel inferior: biplots entre las variables. Diagonal: gráfico de distribución de cada variable