El proceso de bioincrustación puede dañar varias estructuras construidas por el hombre y, junto con el agua de lastre, es el principal vector para la transferencia de especies invasoras en todo el mundo. El control de las especies invasoras, principalmente mejillones, se ha debatido durante mucho tiempo, pero las diferentes técnicas utilizadas aún tienen limitaciones. Por lo tanto, el propósito de esta revisión fue recopilar información sobre los avances en el control de la incrustación de mejillones invasores. Se utilizó la base de datos del portal de publicaciones Periódicos CAPES (Brasil), con la búsqueda de palabras clave: “(invasive mussel biofouling) AND control”. Se analizaron 53 artículos publicados entre 1999 y 2020. Se identificó que se han realizado más estudios experimentales en agua dulce que en otros sistemas acuáticos. La mayoría se llevó a cabo en laboratorios, involucrando las fases del mejillón juvenil y adulto. El control químico fue el más discutido en la literatura analizada en comparación con los controles físicos y biológicos. Entre los tipos de controles químicos se destaca el uso de extractos naturales por ser efectivo y causar menos daño al ambiente.
Palabras clave: antiincrustante, depredación, extractos naturales, luz ultravioleta, macroincrustación.
O processo de bioincrustação pode danificar várias estruturas feitas pelo homem e, junto com a água de lastro, é o principal vetor de transferência de espécies invasoras em todo o mundo. O controle de espécies invasoras, principalmente mexilhões, é debatido há muito tempo, mas as diferentes técnicas utilizadas ainda apresentam limitações. Portanto, o objetivo desta revisão foi coletar informações sobre os avanços no controle de incrustação de mexilhões invasores. Foi utilizada a base de dados do portal de publicações Periódicos CAPES (Brasil), com a busca das palavras-chave: “(invasive mussel biofouling) AND control”. Foram analisados 53 artigos publicados entre 1999 e 2020. Identificou-se que mais estudos experimentais foram realizados em água doce do que em outros sistemas. A maioria desses estudos foi realizada em laboratórios, envolvendo as fases juvenil e adulta do mexilhão. O controle químico foi o mais discutido na literatura analisada em relação aos controles físicos e biológicos. Dentre os tipos de controles químicos, o uso de extratos naturais destaca-se por ser eficaz e causar menos danos ao meio ambiente.
Palavras-chave: anti-incrustante, predação, extratos naturais, luz ultravioleta, macroincrustação.
Introducción
En el ambiente acuático, la bioincrustación puede definirse como la acumulación no deseada de depósitos biológicos en superficies sumergidas (sustratos), ya sea en ambientes naturales o artificiales (Agostini, et al., 2018). Este es un proceso natural que se inicia con la adsorción de moléculas orgánicas en un sustrato sumergido y su posterior colonización por especies microbianas pioneras. Con la progresión de la sucesión ecológica ocurre el asentamiento de organismos macroscópicos, facilitado por los colonizadores pioneros (Agostini, et al., 2018).
La bioincrustación puede causar varios efectos: en los cascos de los barcos, la superficie se vuelve irregular, incrementando la resistencia y provocando un mayor consumo de combustible (Schultz, 2007). Además promueve la corrosión y aumenta el peso de las estructuras artificiales, modificando su formato original (Hertiani, et al., 2010) y causando serios problemas al obstruir tuberías de conducción y otros componentes (Schaefer, et al., 2010). Esto supone un gasto global superior a los 340 mil millones de dólares por año para la industria acuática (Cuthbert, et al., 2021), que incluye el costo de la prevención de la bioincrustación, el mantenimiento de las estructuras dañadas y el aumento del consumo de combustible en barcos.
La bioincrustación, junto con el agua de lastre y sus sedimentos, es el vector más importante en la transferencia de organismos invasores marinos en todo el mundo. La colonización en los cascos de los barcos, plataformas, boyas y otras estructuras está directamente relacionada con la dispersión y propagación a nivel global de especies exóticas e invasoras en los ecosistemas marinos (Uliano-Silva, et al., 2018). Las especies exóticas invasoras colonizan hábitats diferentes al ambiente natural, reproduciéndose fácilmente y superando la densidad de las especies nativas, lo que causa daños en la biodiversidad, y en las relaciones sociales y económicas (Boltovskoy y Correa, 2015). Los mejillones son exitosos en la colonización de ambientes acuáticos, principalmente las especies de las familias Dreissenidae y Mytilidae (Boltovskoy y Correa, 2015). Estos organismos tienen características fisiológicas -como alta tasa de dispersión, plasticidad fenotípica, polifagia y alta variabilidad genética- que garantizan su establecimiento en diferentes ambientes (Lockwood y Somero, 2011). Controlar la propagación e invasión de especies exóticas, principalmente de mejillones, ha sido un desafío mundial durante las últimas décadas, incrementado especialmente con la invasión de Limnoperna fortunei en América del Sur y Norte, y de Dreissena polymorpha en Europa (Silva, et al., 2021).
Como estrategia para controlar la incrustación de dichos mejillones invasores, a lo largo de los años se han utilizado controles poblacionales que presentan diferentes metodologías (Boltovskoy y Correa, 2015). Estos controles se pueden dividir en tres: biológicos, físicos y químicos. El control biológico consiste en la utilización de un organismo para la depredación de las especies invasoras. Esta metodología puede implicar una amenaza para el ambiente, y existen controversias en torno a la selección de las especies utilizadas para la depredación de la especie objetivo (invasora) (Rosa, et al., 2019). El control físico implica el uso de cambios de temperatura y luces ultravioleta que pueden generar importantes consumos de energía eléctrica, lo que hace que el método sea costoso (Boltovskoy y Correa, 2015). El control químico implica el uso de productos químicos para controlar las incrustaciones, y a menudo es necesario desintoxicar el agua después de aplicar la metodologia; además puede causar contaminación en el ambiente receptor (Boltovskoy y Correa, 2015; Rosa, et al., 2019). Para el control químico se destaca el uso de cloro, pinturas antiincrustantes, sustancias naturales con fines antiincrustantes y el control de pH (Davis, et al., 2015; Matsui, et al., 2018; Lepoutre, et al., 2018).
El propósito de esta revisión fue recopilar información sobre el progreso de la investigación en el control de la incrustación de mejillones, con enfoque en las siguientes preguntas: (i) ¿Ha aumentado el número de trabajos con los años?; (ii) ¿Qué países estudiaron el mayor número de alternativas de control?; (iii) ¿Qué tipo de ambiente acuático fue el más estudiado?; (iv) ¿Los trabajos se realizaron mayormente en el laboratorio o in situ?; (v) ¿El propósito de los trabajos fue controlar larvas, juveniles o adultos?; (vi) ¿Qué especie, orden y familia fueron los más estudiados?; (vii) ¿Cuál es el mejor método de control utilizado: biológico, físico o químico?
Se evaluaron los estudios publicados con el objetivo de resaltar la forma de control de mejillones invasores más eficiente y ambientalmente segura.
Materiales y Métodos
Se desarrolló una revisión de artículos científicos considerando la base de datos del portal de publicaciones periódicas de la Coordinación de Perfeccionamiento del Personal de Educación Superior (CAPES), del Ministerio de Educación de Brasil, que incluye colecciones de Scopus, Web of Science y Science Direct Journals. La búsqueda fue realizada considerando el período entre 1990 y 2020 (junio). Se consideró la combinación de palabras en inglés: “(invasive mussel biofouling) AND control”. Se identificó y cuantificó el número de publicaciones, y se seleccionaron los artículos de los temas de interés. Posteriormente se realizó el análisis de los datos en los diferentes artículos, considerando autor, año, país del autor, país de desarrollo de la investigación, revista, estudio de agua dulce (marina o estuarina), experimento de campo o laboratorio, especie considerada, tipo de control (biológico, químico o físico). No se consideró en esta revisión la literatura gris (tesis y disertaciones, resúmenes de congresos y artículos de revisión).
Para la determinación de los factores “control biológico, químico o físico” se tomaron en cuenta las siguientes reglas de clasificación: (i) control biológico, artículos que trataban de depredación o competencia por algún recurso alimenticio para control de los mejillones; (ii) control químico, artículos sobre la utilización de compuestos químicos aislados o brutos, o de factores abióticos (pH, oxígeno y salinidad); (iii) control físico, artículos sobre la utilización de barreras físicas como filtros, diferentes tipos de sustratos o distintos tipos de olas o temperaturas. Para la nomenclatura actual de especies marinas y dulceacuícola se utilizó el registro mundial de especies marinas WoRMS (WoRMS, 2020).
Resultados y Discusión
Se encontró un total de 453 artículos, del cual se seleccionaron 53 para su análisis. Los resultados se presentan a continuación, de acuerdo con el orden de las preguntas planteadas en la presente revisión:
¿Ha aumentado el número de trabajos con los años?
De los 53 artículos seleccionados, el primero fue publicado en 1999 y el segundo en 2002 (Figura 1). Desde fines de la década de los noventa hasta la actualidad se han explorado alternativas para controlar los impactos de mejillones invasores, con una explosión máxima de generación de información sobre el tema a partir de 2009. Desde ese año se registró al menos una investigación anual (Figura 1).
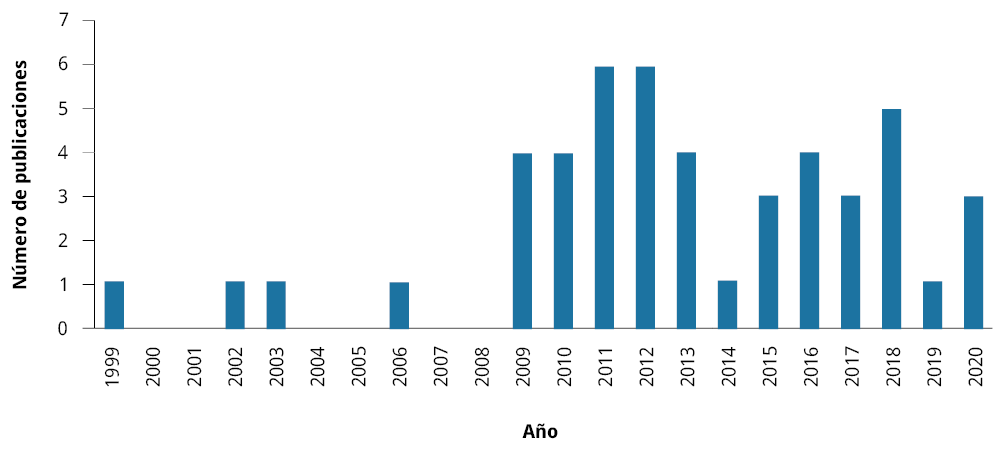
Figura 1. Número de trabajos desarrollados a lo largo de los años sobre estrategias de control de mejillones invasores (1999-2020).
También se analizaron los principales investigadores de las especies de mejillón estudiadas y el origen (continente) de los autores. Quienes se destacaron fueron: Perepelizin y Boltovskoy en América del Sur para la especie L. fortunei; Costa y Kobak en Europa para D. polymorpha; y Hicks y Mcmahon en América del Norte para P. perna.
¿Qué países estudiaron el mayor número de alternativas de control?
Los países en los que se identificó un mayor número de publicaciones referidas al control de mejillones invasores fueron Estados Unidos (20,8%); seguido de Argentina (11,3%); Brasil (9,4%); Holanda y Japón (7,5% cada uno); China, India, Polonia y Reino Unido (5,7% cada uno); Irlanda y Canadá (3,8% cada uno); Alemania, Australia, Francia, Corea, Nueva Zelanda, Portugal y Túnez (1,9% cada uno).
¿Qué tipo de ambiente acuático fue el más estudiado?
De los 53 artículos analizados, el 51% se ocupó de estudios sobre mejillones de agua dulce, seguido de agua marina (41%) y finalmente de agua salobre (estuario) (8%), dejando en evidencia que los mejillones pueden causar problemas en diferentes tipos de ambientes acuáticos. Según Schultz y otros (2011) y Ozkan y Berberoglu (2013), la bioincrustación puede causar daños a diferentes sustratos como plataformas marítimas y portuarias, tuberías, cables submarinos y cascos de barcos. En este sentido, a partir de los datos recopilados podemos observar que los trabajos en el entorno de agua dulce se realizaron en plantas hidroeléctricas, vías fluviales de construcción, plantas de tratamiento de agua, represas y fábricas (Nakano, et al., 2010; Schaefer, et al., 2010; Costa, et al., 2011; Matsui, et al., 2018). Los estudios en agua marina se realizaron en los sistemas de agua de lastre, acuicultura y enfriamiento de agua (Rajagopal, et al., 2006; Piola y Hopkins, 2012).
¿Los trabajos se realizaron mayormente en el laboratorio o in situ?
El 73% de los trabajos correspondió a experimentos de laboratorio y el 27% a trabajos realizados in situ. En tres de los estudios se realizaron tanto experimentos de laboratorio como in situ (Matsuo, et al., 2009; Piola y Hopkins, 2012; Comeau, et al., 2017). Específicamente, Comeau y otros (2017) observaron que el hidróxido de calcio causa un efecto agudo y un estrés conductual a corto plazo en Mytilus edulis (Linnaeus, 1758) tanto en un experimento en tanques acrílicos (laboratorio) como en barcos de pesca (campo). Por otro lado, Piola y Hopkins (2012) analizaron la mortalidad de Perna canaliculus (Gmelin, 1791) y Mytilus galloprovincialis (Lamarck, 1819) frente a la temperatura, y observaron que temperaturas entre 40 y 60 ℃ controlan estas especies de mejillones en el campo (en botes) y en el laboratorio (en tanques). Matsuo y otros (2009) utilizaron un sistema de fibra óptica llamado técnica de emisión acústica (AE) para analizar la incrustación por M. galloprovincialis en el laboratorio y en el campo (en las tuberías). En los tres estudios fue posible notar el potencial del control analizado tanto in situ como en el laboratorio. Por lo tanto, se demuestra que es importante realizar experimentos en ambos lugares ya que el laboratorio ofrece condiciones más controladas, mientras que el campo refleja las condiciones del ambiente con las diferentes variables que regulan la ocurrencia de mejillones, complejas de verificar en el laboratorio.
¿El propósito de los trabajos fue controlar larvas o mejillones juveniles y adultos?
De los estudios analizados, el 80% realizó bioensayos para el control de mejillones en su estado juvenil y adulto, mientras que el 20% analizó mejillones en su estado larvario. De acuerdo con Murray y otros (2011) y Crego-Prieto y otros (2015), las especies invasoras pueden transportarse en su fase larval en agua de lastre y en los cascos de los barcos en su fase juvenil o adulta. Por lo tanto, llevar a cabo una metodología para controlar estos organismos en diferentes etapas de la vida es de suma importancia. En seis estudios analizados se abordaron las diferentes etapas de vida de los mejillones (Folino-Rorem, et al., 2006; Matsuo, et al., 2009; Schaefer, et al., 2010; Sahu, et al., 2013; Yuan, et al., 2016).
¿Qué especie, orden y familia fueron los más estudiados?
Las especies más estudiadas fueron el mejillón cebra Dreissena polymorpha (Pallas, 1771) de la familia Dreissenidae (35%) y el mejillón dorado Limnoperna fortunei (Dunker, 1857) de la familia Mytilidae (65%). Estas especies se encuentran en hábitats de agua dulce y salobres, corroborando los resultados presentados previamente sobre el ambiente acuático más estudiado (Figura 2). Además, los órdenes más abundantes en los artículos fueron Mytiloida (38%) y Mytilida (25%), de la familia Mytilidae; seguidos por Veneroida (25%) y Myida (12%), de la familia Dreissenidae.
En algunos estudios se encontraron especies cuya clasificación taxonómica fue modificada con el paso del tiempo. La especie Xenostrobus securis (Lamarck, 1819) es actualmente sinónimo de Limnoperna fortunei. Del mismo modo, Modiolus metcalfei (Hanley, 1843) y Perna indica (Kuriakose y Nair, 1976) ahora se clasifican como Modiolus modulaides (Röding, 1798) y P. perna, respectivamente. En este estudio se adoptó la nomenclatura actualizada en el WoRMS (WoRMS, 2020).
Las especies D. polymorpha, D. bugensis, M. leucophaeata y M. sallei -de la familia Dreissenidae- se describen en la literatura como invasoras (Schaefer, et al., 2010; Cai, et al., 2014; Gaag, et al., 2017). La especie L. fortunei es una de las especies invasoras más estudiadas (Xu, et al., 2015) en América del Sur (Schwindt y Bortolus, 2017). El género Perna, compuesto por las especies P. perna y P. viridis (Linnaeus, 1758), y el género Modiolus, compuesto por las especies M. modulaides, M. modiolus (Linnaeus, 1758), M. philippinarum (Hanley, 1843) y M. edulis, también se consideran mejillones invasores (WoRMS, 2020). Las especies Mytella charruana (d’Orbigny, 1842) y M. galloprovincialis se identifican en algunas regiones como no nativas (Yuan, et al., 2016; Olabarria, et al., 2016). La especie P. canaliculus (Gmelin, 1791) es endémica de Nueva Zelanda; sin embargo, se introdujo en Australia (WoRMS, 2020) y se encontró en artículos junto a M. galloprovincialis, discutiendo el control de la bioincrustación de ambas especies invasoras (Piola y Hopkins, 2012). Por lo tanto, consideramos que todas las especies en este estudio son invasoras.
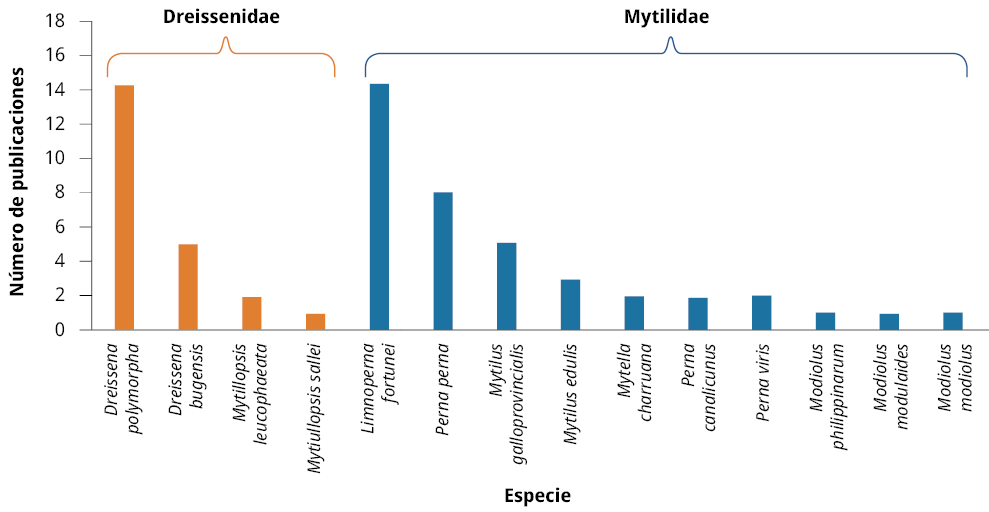
Figura 2. Número de publicaciones por especie de mejillones encontradas en los artículos analizados entre 1999 y 2020.
¿Cuál fue el tipo de control más utilizado?
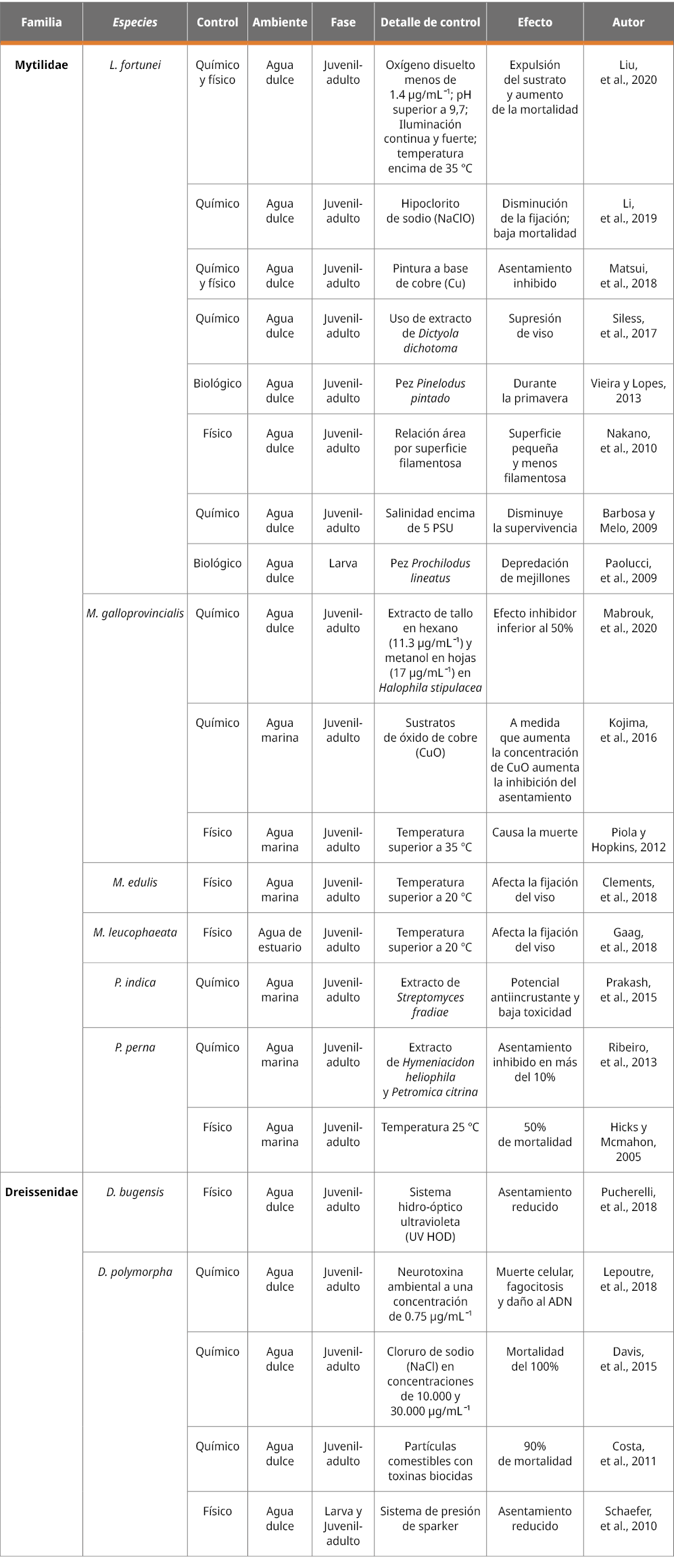
De los artículos analizados, el 13% estudió el control biológico; del cual el 50% resultó efectivo para el control del mejillón. En tanto, el 20% analizó el control físico, del cual el 86% obtuvo resultados satisfactorios. El control químico presentó un mayor número de reportes (67%), del cual el 84% mostró efectividad en el control de mejillones (Figura 3). En el Anexo 1 se detallan los tipos de control de mejillones invasores encontrados que han demostrado ser satisfactorios.
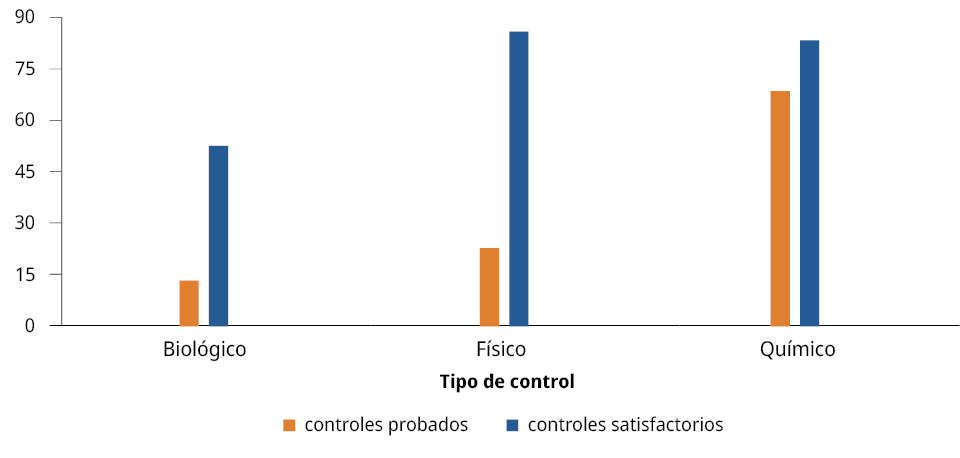
Figura 3. Número de publicaciones por tipo de control de mejillones testeadas en los artículos analizados entre 1999 y 2020.
¿Cuál fue el mejor control biológico?
El primer artículo donde se estudió el control biológico fue publicado en 2009, en el cual se comprobó la selectividad alimentaria del pez Prochilodus lineatus (Valenciennes, 1837) sobre larvas de L. fortunei (Paolucci, et al., 2009). Vieira y Lopes (2013) investigaron el contenido estomacal de Pimelodus pintado (Azpelicueta, Lundberg y Loureiro, 2008) para verificar la presencia de L. fortunei en su dieta, y encontraron una preferencia por los mejillones durante la primavera. En el 60% de los peces estudiados se comprobó la presencia del mejillón dorado en su contenido estomacal. Otro trabajo también evidenció la capacidad de los peces de consumir L. fortunei: de 81 especies de peces, 28 de ellas presentaron mejillón dorado en el estómago (González-Bergonzoni, et al., 2019). Estos peces podrían usarse como un posible depredador del mejillón L. fortunei; sin embargo, sería necesario realizar un mayor número de estudios sobre dicho potencial.
En tanto, Kobak y otros (2012) analizaron el potencial de depredación de los anfípodos Dikerogam marusvillosus (Sowinsky, 1894), Pontogammarus robustoides (Sars, 1894) y Gammarus fossarum (Koch, 1836) y de los peces Corydoras paleatus (Jenyns, 1842) sobre el mejillón D. polymorpha, no siendo exitosos en su depredación.
Otros estudios utilizaron la coexistencia de especies en el mismo hábitat para generar una competencia entre ellos (Olabarria, et al., 2016; Cai, et al., 2014). Estos estudios concluyeron que ambas especies de mejillones analizadas -L. fortunei y Mytilopsis sallei (Recluz, 1849)- son más resistentes a las variaciones ambientales y tienden a impactar especies que ya existen en el agua, pudiendo disminuir la existencia de especies nativas en el ambiente.
Los métodos biológicos se basan en el uso de organismos que actúan con depredación sobre el mejillón invasor. Sin embargo, de los trabajos que utilizaron esta metodología solo el 50% mostró efectividad (Figura 3). Esta alternativa para el control del mejillón es muy delicada cuando se utilizan especies no nativas como depredadores debido a que pueden afectar no solo a la especie objetivo, sino también a otras que habitan en el medio; sumado a su alto costo (Kobak, et al., 2012; Rosa, et al., 2019). No obstante, cuando se utilizan especies nativas como agente de control, el costo puede ser menor y el efecto ambiental puede disminuir, causando un menor riesgo para el ambiente acuático (Rosa, et al., 2019).
La solución más efectiva es el uso de peces que depreden mejillones. Sin embargo, debido a las consecuencias que puede ocasionar en los ecosistemas, este método debe ser estudiado en mayor profundidad para conocer sus interacciones con el medio en el que se aplica y evitar amenazas en el ecosistema receptor (Rosa, et al., 2019). Según los datos analizados sobre las consecuencias ambientales que puede ocasionar este tipo de control, se recomienda su uso en entornos industriales como empresas hidroeléctricas y plantas de energía. En estos lugares es posible tener un mayor control de las especies introducidas para actuar como depredadores y controlar los mejillones, y en consecuencia, causar un menor impacto al medio ambiente.
¿Cuál fue el mejor control físico?
Como una forma de inhibir el asentamiento se identificaron estudios que evaluaron el tipo de sustrato (material) y el formato del sustrato, la efectividad de la luminosidad y la gravedad, la luz ultravioleta, la presión para reducir la bioincrustación y los sensores de fibra óptica para detectar el mejillón en el agua. A excepción de la obra de Kobak y otros (2008), donde se evaluó la luminosidad y la gravedad en el laboratorio, las otras metodologías identificadas de control físico se realizaron in situ. Además, se llevaron a cabo estudios sobre el control del mejillón a través del uso de diferentes temperaturas del agua (Perepelizin y Boltvoskoy, 2011; Piola y Hopkins, 2012; Yuan, et al., 2016; Gaag, et al., 2018; Liu, et al., 2020). De hecho, la temperatura fue identificada entre los factores con mayor capacidad de control: las temperaturas superiores a 20 ℃ afectan la fijación del viso de los mejillones Mytillopsis leucophaeata (Conrad, 1831) (Gaag, et al., 2018) y M. edulis (Clements, et al., 2018), y las superiores a 35 ℃ pueden matar a L. fortunei (Liu, et al., 2020) y M. galloprovincialis (Piola y Hopkins, 2012). Sin embargo, otros estudios encontraron que M. charruana, P. viridis (Yuan, et al., 2016) y L. fortunei (Perepelizin y Boltvoskoy, 2011) son tolerantes a las variaciones de temperatura, y dependiendo de la localización geográfica de la especie y su abundancia en el medio ambiente, la temperatura no resulta eficaz para controlar estos mejillones.
Como forma de controlar la incrustación del mejillón cebra (D. polymorpha), un estudio analizó diferentes tipos y formas de sustratos utilizando in situ placas de policloruro de vinilo (PVC), con y sin filamentos de polipropileno (PP), durante seis semanas. Los resultados sugirieron que los filamentos artificiales facilitan el reclutamiento, principalmente al aumentar la superficie disponible para la fijación (Folino-Rorem, et al., 2006). Estos resultados corroboran lo encontrado por Nakano y otros (2010) al investigar la distribución de poslarvas de L. fortunei, donde las densidades de mejillones en las jaulas huecas con malla de 5 mm fueron mayores que en jaulas no huecas en todas las profundidades analizadas. En base a dichos estudios es posible señalar que un área de superficie más pequeña y poco filamentosa se vuelve más ventajosa para controlar la bioincrustación de esta especie. Con respecto al tipo de revestimiento de sustrato utilizado, se comparó el uso de hormigón, madera y piedra caliza como forma de repeler el asentamiento del mejillón. Entre estos sustratos, el concreto no presentó efectos que rechacen significativamente el asentamiento del mejillón dorado L. fortunei (Matsui, et al., 2018). Por lo tanto, las construcciones de hormigón en los ríos pueden ser el sustrato preferido para la colonización del mejillón dorado. Otro estudio mostró que el movimiento de fuerza de fijación del asentamiento del mejillón cebra D. polymorpha puede cambiar según los parámetros físicos de luminosidad y gravedad (Kobak, et al., 2008).
Pucherelli y otros (2018) instalaron durante dos años en sistemas de refrigeración un generador de luz ultravioleta hidro óptica (HOD UV) para monitorear el impacto de HOD UV en el asentamiento del mejillón Dreissena bugensis (Andrusov, 1897). Al comparar los pesos secos de bioincrustación entre las placas expuestas al agua tratada con HOD UV y el control (sin usar HOD UV), se encontró una reducción significativa después de la exposición: el asentamiento de mejillones D. bugensis y la formación de biopelículas bacterianas se redujeron constantemente en las cámaras de prueba. Además, se confirmó que el mantenimiento del enfriador relacionado con la bioincrustación se redujo un 75% después del primer año de funcionamiento del HOD UV, eliminándose en el segundo y tercer año después de la implementación. Las pruebas de campo usando pulsos de presión (sistema sparker) mostraron un uso efectivo para el control de los mejillones cebra (Schaefer, et al., 2010). Estos resultados indicaron que más pulsos de presión pueden erradicar los mejillones adultos existentes y evitar el establecimiento de estadios larvarios posteriores (Schaefer, et al., 2010). La detección temprana de la obstrucción por mejillones ha sido estudiada utilizando un sistema de fibra óptica llamado técnica de emisión acústica (AE) (Matsuo, et al., 2009). En este trabajo se desarrolló un sensor para la percepción de señales AE de ondas procedentes de mejillones, donde solo se pueden detectar conchas de mejillón con el tamaño de más de 11 mm. Esta metodología no es necesariamente una forma de control ya que no evita la inhibición del asentamiento de macroinvertebrados.
Entre las formas de control físico analizadas, los estudios reflejaron que los sustratos de madera y piedra caliza tienen resultados significativos en disminuir y/o impedir la bioincrustación de los mejillones. A su vez, la luz ultravioleta y los pulsos de presión mostraron un resultado prometedor. Para algunas especies, la temperatura fue un factor que afectó la fijación del viso y consecuentemente aumentó la mortalidad de los mejillones. Finalmente, como medida de prevención fue posible detectar la fijación de mejillones a través de un sistema de fibra óptica AE.
De los trabajos que utilizaron el control físico, el 86% fue eficaz para controlar los mejillones invasores. Sin embargo, este control se vuelve costoso ya que depende del uso de equipos. En ese sentido, el costo del sistema térmico alcanza los 300 mil dólares (Phillips, et al., 2005), y el sistema sparker tiene un costo promedio de 65 mil dólares (instalación, formación de profesionales, electricidad y mantenimiento de equipos). La lámpara ultravioleta tiene un costo más alto que el sistema sparker (Schaefer, et al., 2010) ya que el gasto de electricidad es mucho mayor: las lámparas UV funcionan continuamente, con un mayor consumo de correspondencias eléctricas. Además, las lámparas UV deben reemplazarse cada mil horas, y si se rompen agregan mercurio al agua, creando un riesgo para el suministro de agua (Schaefer, et al., 2010). Por lo tanto, al comparar estas diferentes tecnologías, el sistema sparker tiene mayor potencial ya que es menos costoso y posiblemente menos contaminante que otras tecnologías de control físico.
Para identificar el control físico a utilizar se deben considerar previamente el costo y el daño ambiental, el tiempo de residencia de los organismos en el sistema acuático y otros factores ambientales en el ecosistema. A través del tiempo de residencia del mejillón es posible estimar el período de reproducción del organismo, la abundancia y la dispersión, siendo un factor muy importante para mitigar los impactos que provocan los mejillones en las estructuras artificiales (Somma, et al., 2021).
¿Cuál fue el mejor control químico?
La mayoría de los estudios realizados con control químico fue efectivo para combatir la macroincrustación (84%). En este tipo de control se destacan las modificaciones de pH en el agua (Comeau, et al., 2017; Liu, et al., 2020), la salinidad (Barbosa y Melo, 2009; Yuan, et al., 2016) y el uso de diferentes tipos de reactivos químicos. Entre estos últimos se encuentran el cloro (Rajagopal, et al., 2006), el cloruro de sodio (Davis, et al., 2015), el óxido de cobre (Kojima, et al., 2016; Matsui, et al., 2018) y los compuestos extraídos de material biológico (Lepoutre, et al., 2018).
Yuan y otros (2016) analizaron diferentes temperaturas en conjunto con la influencia de la salinidad para el control de M. charruana y P. viridis. En este trabajo, la salinidad fue un factor tolerante para ambas especies, por lo que no mostró un control sobre los mejillones. Rice y otros (2016) señalaron que M. charruana se adapta a diferentes salinidades. Barbosa y Melo (2009) predijeron que L. fortunei podría sobrevivir a una salinidad de hasta 5 y que a medida que aumenta la salinidad la supervivencia disminuye. De esta manera, salinidades superiores a 5 podrían usarse para controlar el mejillón dorado, disminuyendo su supervivencia.
También se estudió la exposición del mejillón dorado a la variación de hipoclorito de sodio (NaClO), permanganato de potasio (KMnO4) o peróxido de hidrógeno (H2O2) (Li, et al., 2019). Únicamente el NaClO debilitó la fijación de los filamentos del viso del mejillón, con baja mortalidad y alta tasa de apertura de la concha en estas condiciones (Li, et al., 2019). Además, de las tres especies reportadas previamente la fijación puede verse comprometida por la concentración de oxígeno disuelto por debajo de 1.46 μg/mL-1, un pH por encima de 9.7, y puede causar la expulsión del sustrato con una iluminación fuerte y continua (Liu, et al., 2020). La exposición del mejillón al cloruro de sodio (NaCl) también fue un factor limitante para la mortalidad de la especie D. polymorpha: la mortalidad puede alcanzar el 100% a concentraciones de 10.000 y 30.000 μg/mL-1 (Davis, et al., 2015).
Hicks y Mcmahon (2005) evaluaron en el mejillón P. perna los efectos de la presión parcial de O2 (PO2) en concentraciones de 0, 1, 2, 4 y 6 kPa, junto con la temperatura del agua. Encontraron que la especie tolera PO2 en concentraciones de 4 y 6 kPa a temperaturas de 15 y 20 ℃, mientras que expuesta a una temperatura de 25 ℃ presenta una mortalidad del 50%. Estos resultados confirmaron que la presión parcial de oxígeno (PO2) presenta menores efectos sobre la supervivencia del mejillón que la temperatura (Hicks y Mcmahon, 2005).
Por otro lado, Clements y otros (2018) evaluaron la presión parcial de CO2 (PCO2), junto con la temperatura del agua, sobre la especie M. edulis. Dichos autores encontraron que la especie es tolerante a diferentes concentraciones de PCO2; sin embargo, a altas temperaturas existe una disminución en la fijación del viso y, en consecuencia, un aumento de la mortalidad corporal. Los mencionados estudios que evaluaron oxígeno disuelto, pH, presión parcial de oxígeno y CO2 no obtuvieron resultados positivos para el control de los mejillones analizados (Hicks y Mcmahon, 2005; Clements, et al., 2018).
Solo el trabajo realizado por Liu y otros (2020) sobre las variaciones en el oxígeno disuelto y el pH obtuvo resultados positivos para el control del mejillón, específicamente en su estudio con L. fortunei. Es necesario aclarar que estos factores se analizaron junto con la iluminación fuerte y continua del sustrato, lo que refleja la importancia de utilizar factores físicos y químicos para controlar el mejillón dorado. Aunque usar diferentes metodologías sería un enfoque costoso de aplicar y mantener, lo que afectaría la elección de este método por parte de los usuarios.
En la presente revisión se encontraron trabajos que utilizaron productos antiincrustantes. Un experimento de inmersión de cuatro años de duración usó sustratos a base de cobre que demostraron tener un fuerte efecto repelente sobre la bioincrustación de L. fortunei (Matsui, et al., 2018). Y para M. Galloprovincialis tuvo su fijación en sustrato inhibido a medida que aumentó la concentración de la pintura en base de óxido de cobre (CuO) (Kojima, et al., 2016). Costa y otros (2011) administraron toxinas que contienen biocidas en partículas comestibles para D. polymorpha, encontrando una mortalidad del 90% en dicha especie en un tratamiento de 12 horas.
De los estudios realizados con control químico, el 84% demostró efectividad (Barbosa y Melo, 2009; Costa, et al., 2011; Davis, et al., 2015; Kojima, et al., 2016; Matsui, et al., 2018; Li, et al., 2019; Liu, et al., 2020), mientras que el 16% restante no presentó resultados satisfactorios (Hicks y Mcmahon, 2005; Yuan, et al., 2016; Clements, et al., 2018). Sin embargo, los estudios que mostraron efectividad utilizaron en su mayoría metodologías que implican altas concentraciones de productos químicos en el agua (Barbosa y Melo, 2009; Davis, et al., 2015; Kojima, et al., 2016; Matsui, et al., 2018; Li, et al., 2019).
En el ambiente acuático, el uso de sustancias químicas podría afectar no solo a las especies objetivo sino también a las especies no objetivo (Dafforn, et al., 2011; Turner, 2010), y tener un impacto en la calidad del agua (Soroldoni, et al., 2017), causando pérdidas de la biodiversidad y ocasionando un desequilibrio en los diferentes niveles tróficos del ecosistema. Además, el hipoclorito de sodio (NaClO) puede ser efectivo (Li, et al., 2019), pero se estima que el gasto por su uso alcanza los 100 mil dólares (entre instalación, operación y mantenimiento de la metodología) (Phillips, et al., 2005), lo que hace que el método sea costoso.
Entre las formas de control de bioincrustación, el control químico más utilizado corresponde a las pinturas antiincrustantes; sin embargo, puede causar efectos tóxicos a diferentes organismos que se encuentran en el medio acuático (Soroldoni, et al., 2017; Agostini, et al., 2021a). Además, los efectos de las pinturas antiincrustantes pueden prolongarse a largo plazo debido a su acumulación en el sedimento (Thomas, et al., 2003). Por eso se han desarrollado alternativas con productos naturales como forma de control de la bioincrustación, siendo más seguras para el ecosistema (Agostini, et al., 2021b).
En esta revisión se encontraron artículos sobre alternativas antiincustrantes naturales, en los que los autores utilizaron compuestos químicos extraídos de diferentes tipos de materiales biológicos con fines antiincrustantes. Mabrouk y otros (2020) observaron que los extractos de los tallos de la hierba marina Halophila stipulacea (Forsskal Ascherson, 1867), usando el diluyente de hexano en la concentración de 11.3 μg/mL-1 y metanol de las hojas con 17 μg/mL-1, mostraron un efecto inhibidor de menos del 50% en el mejillón M. galloprovincialis.
El uso de extractos crudos de plantas naturales también se registró en otro trabajo, en el cual se evidenció la acción antiincrustante del extracto de Streptomyces fradiae (Waksman y Curtis, 1916; Waksman y Henrici, 1948) en el mejillón P. indica, consiguiendo un resultado satisfactorio para el mejillón estudiado (Prakash, et al., 2015). Los autores informan que la investigación se desarrolló en el laboratorio y para estudios posteriores se debe realizar un experimento in situ. El uso de extractos también fue analizado por Ribeiro y otros (2013), quienes utilizaron diferentes extractos elaborados a partir de doce especies de esponjas de Brasil contra la fijación de P. perna. Solo el extracto de dos de las especies inhibió significativamente el asentamiento del mejillón en más del 10%: Hymeniacidon heliophila (Wilson, 1911) y Petromica citrina (Muricy, Hajdu, Minervino, Madeira y Peixinho, 2001).
Otros autores utilizaron extractos de compuestos específicos extraídos de organismos naturales para verificar su potencial antiincrustante. Lepoutre y otros (2018) evaluaron el impacto de la neurotoxina ambiental en los hemocitos en relación con la mortalidad celular, fagocitosis e integridad del ADN de D. polymorpha. En el estudio se demostró que una concentración de 0.75 µg/mL-1 está contenida en la hemolinfa e induce daño transitorio al ADN, en consecuencia, conduce a la muerte celular y al daño de otras estructuras del mejillón. En esta línea, Siless y otros (2017) utilizaron cuatro compuestos naturales aislados del alga Dictyota dichotoma (Hudson, JVLamouroux, 1809), en los que los compuestos Paquidictyol A y Dictyoxide -en una concentración de 4.7 μg/mL-1- llevaron a la supresión del viso para su fijación en el sustrato por L. fortunei.
En esta revisión, solo se encontraron cinco trabajos de control químico que utilizaron sustancias naturales como alternativa para el control de mejillones (Ribeiro, et al., 2013; Prakash, et al., 2015; Siless, et al., 2017; Lepoutre, et al., 2018; Mabrouk, et al., 2020), y todas han demostrado ser efectivas para controlar la bioincrustación ocasionada por estas especies. Por lo tanto, a la hora de buscar una alternativa eficaz y menos dañina para el ambiente la mejor opción de control químico sería el uso de sustancias naturales como los extractos crudos de organismos o compuestos específicos extraídos de los materiales biológicos, los cuales han mostrado resultados prometedores tanto para el control de la microincrustación como de la macroincrustación (Agostini, et al., 2021b).
Conclusiones
El número de trabajos publicados sobre el control de mejillones invasores ha variado a lo largo de los años: a partir de 2009 oscila entre 1 y 6 estudios anuales. El país que investigó más alternativas de control fue Estados Unidos. El ambiente acuático más estudiado fue el agua dulce, y la mayoría de las investigaciones se llevó a cabo en el laboratorio -comparado con trabajos in situ-, centrándose en el control de mejillones en su fase juvenil y adulta. Las principales familias evaluadas fueron Mytilidae y Dreissenidae, con las especies L. fortunei y D. polymorpha, respectivamente.
El control químico fue el más utilizado y mostró una alta eficacia en el control de mejillones. Las metodologías efectivas fueron el uso de salinidad, hipoclorito de sodio, óxido de cobre, pinturas, oxígeno disuelto y extractos naturales. El control físico, a pesar de tener pocos trabajos publicados, también fue muy efectivo: tanto el uso de la luz UV como los pulsos de presión y alta temperatura lograron inhibir la incrustación del mejillón. Sin embargo, tienen un alto costo ya que depende del uso de equipos caros. El control biológico fue el menos ensayado hasta la fecha y también el menos efectivo. Además, este control solo se puede utilizar con el uso de peces como especie de depredación.
Dentro del control químico se identifica el problema de usar productos químicos como una forma de controlar los mejillones debido a su posible contaminación al ecosistema acuático y daño a las especies objetivo y no objetivo. Sin embargo, fue demostrado que el uso de extractos naturales tiene un gran potencial para el control de los mejillones, además de ser menos nocivo para el ecosistema. Por esta razón, se destaca el control químico mediante el uso de extractos naturales ya que es efectivo y genera menos daño al ambiente acuático.
Agradecimientos
Agradecemos a la Universidade Federal do Rio Grande (FURG), la Universidade Federal do Rio Grande do Sul (UFRGS), y la Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) por su apoyo financiero para la investigación de maestría del Programa de Pós-Graduação em Oceanografia Biológica (FURG), y doctorado y pos-doctorado del Programa de Pós-Graduação em Oceanologia (FURG).
Referencias
Agostini, V.O., Macedo, A.J. y Muxagata, E., 2018. O papel do biofilme bacteriano no acoplamento bentopelágico, durante o processo de bioincrustação. En: Revista Liberato, 19(31), pp.1–134. DOI: 10.31514/rliberato.2018v19n31.p23
Agostini, V.O., Muxagata, E., Pinho, G., Pessi, I. y Macedo, A. J, 2021a. Bacteria-invertebrate interactions as an asset in developing new antifouling coatings for man-made aquatic surfaces. En: Environmental Pollution, 271. DOI: https://doi.org/10.1016/j.envpol.2020.116284
Agostini, V.O., Pinho, G., Muxagata, E., Macedo, A. J., Boccardi, L., Dabezies, M. J y Brugnoli, E., 2021b. Pinturas antiincrustantes derivados de plantas terrestres: una solución segura para el ambiente en el control de la bioincrustación. En: Innotec, 22, pp.559. DOI: https://doi.org/10.26461/22.01
Barbosa, F. y Melo, A., 2009. Modelo preditivo de sobrevivência do Mexilhão Dourado (Limnoperna fortunei) em relação a variações de salinidade na Laguna dos Patos, RS, Brasil. En: Biota Neotropica, 9(3), pp.407-412. DOI: https://doi.org/10.1590/S1676-06032009000300037
Boltovskoy, D. y Correa, C., 2015. Ecosystem impacts of the invasive bivalve Limnoperna fortunei (golden mussel) in South America. En: Hydrobiologia, 746, pp.81-95. DOI: https://doi.org/10.1007/s10750-014-1882-9
Cai, L.Z., Hwang, J.S., Dahms, H.U., Fu, S.J., Zhuo, Y. y Guo, T., 2014. Effect of the invasive bivalve Mytilopsissallei on the macrofaunal fouling community and the environment of Yundang Lagoon, Xiamen, China. En: Hydrobiologia, 741, pp.101–111. DOI: https://doi.org/10.1007/s10750-014-2012-4
Clements, J.C., Hicks, C., Tremblay, R. y Comeau, L.A., 2018. Elevated seawater temperature, not pCO2, negatively affects post-spawning adult mussels (Mytilus edulis) under food limitation. En: Conservation Physiology, 6(1). DOI: https://doi.org/10.1093/conphys/cox078
Comeau, L.A., Sonie, R., Guyondet, T., Landry, T., Ramsay, A. y Davidson, J., 2017. Behavioural response of bivalve molluscs to calcium hydroxide. En: Aquaculture, 466, pp.78–85. DOI: https://doi.org/10.1016/j.aquaculture.2016.09.045
Costa, R., Aldridge, D.C. y Moggridge, G.D., 2011. Preparation and evaluation of biocide-loaded particles to control the biofouling zebra mussel, Dreissena polymorpha. En: Chemical Engineering Research and Design, 89(11), pp.2322-2329. DOI: https://doi.org/10.1016/j.cherd.2011.02.027
Crego-Prieto, V., Ardura, A., Juanes, F., Roca, A., Taylor, J.S. y Garcia- Vazquez, E., 2015. Aquaculture and the spread of introduced mussel genes in British Columbia. En: Biological Invasions, 17(7), pp.2011–2026. DOI: https://doi.org/10.1007/s10530-015-0853-z
Cuthbert, R.N., Pattison, Z., Taylor, N.G., Verbrugge, L., Diagne, C., Ahmed, D.A., Leroy, B., Angulo, E., Briski, E., Capinha, C., Catford, J.A., Dalu, T., Essl, F., Gozlan, R.E., Haubrock, P.J., Kourantidou, M., Kramer, A.M., Renault, D. y Courchamp, F., 2021. Global economic costs of aquatic invasive alien species. En: Science of the total environment, 775. DOI: https://doi.org/10.1016/j.scitotenv.2021.145238
Dafforn, K.A., Lewis, J.A., y Johnston, E.L, 2011. Antifouling strategies: history and regulation, ecological impacts and mitigation. En: Marine Pollution Bulletin, 62, pp.453-465. DOI: https://doi.org/10.1016/j.marpolbul.2011.01.012
Davis, E.A., Wong, W.H. y Harman, W.N., 2015. Comparison of Three Sodium Chloride Chemical Treatments for Adult Zebra Mussel Decontamination. En: Journal of Shellfish Research, 34(3), pp.1029-1036. DOI: https://doi.org/10.2983/035.034.0329
Folino-Rorem, N., Stoeckel, J., Thorn, E. y Page, L., 2006. Effects of Artificial Filamentous Substrate on Zebra Mussel (Dreissena polymorpha) Settlement. En: Biological Invasions, 8(1), pp.89–96. DOI: https://doi.org/10.1007/s10530-005-0330-1
Gaag, M.V.D, Velde, G.V.D., Collas, F.P.L. y Leuven, R.S.E.W., 2018. Growth, Survival, and Mortality of Juvenile and Adult Alien Conrad’s False Mussel Mytilopsis leucophaeata (Conrad, 1831) (Mollusca, Bivalvia, Dreissenidae) in a Brackish Canal. En: Journal of Shellfish Research, 37(1), pp.139-147. DOI: https://doi.org/10.2983/035.037.0112
Gaag, M.V.D., Velde, G.V.D. y Leuven, R.S.E.W., 2017. Settlement, Seasonal Size Distribution, and Growth of the Invasive Bivalve Mytilopsisleucophaeata (Conrad, 1831) (Dreissenidae) in Relation to Environmental Factors. En: Journal of Shellfish Research, 36(2), pp.417-426. DOI: https://doi.org/10.2983/035.036.0214
González-Bergonzoni, I., D’Anatro, A., Vidal, N., Stebniki, S., Tesitore, G., Silva, I. y Teixeira de Mello, F., 2019. Origin of fish biomass in a diverse subtropical river: An allochthonic-supported biomass increase following flood pulses. En: Ecosystems, 22(8). DOI: https://doi.org/10.1007/s10021-019-00370-0
Hertiani, T., Edrada-Ebel, R., Ortlepp, S., Soest, R.W.M., Voogd, N.J. y Wray, V., 2010. From anti-fouling to biofilm inhibition: new cytotoxic secondary metabolites from two Indonesian Agelas sponges. En: Bioorganic & Medicinal Chemistry, 18, pp.1297–1311. DOI: https://doi.org/10.1016/j.bmc.2009.12.028
Hicks, D. y Mcmahon, R., 2005. Effects of temperature on chronic hypoxia tolerance in the non-indigenous brown mussel, Pernaperna (bivalvia: mytilidae) from the Texas Gulf of Mexico. En: Journal of Molluscan Studies, 71(4). DOI: https://doi.org/10.1093/mollus/eyi042
Kobak, J., Poznanska, M. y Kakareko, T., 2008. Effect of attachment status and aggregation on the behaviour of the zebra mussel Dreissena polymorpha. En: Journal of Molluscan Studies, 75, pp.109-117. DOI: https://doi.org/10.1093/mollus/eyn046
Kobak, J., Poznańska, M. y Kakareko, T., 2012. Behavioural changes of zebra mussel Dreissena polymorpha (Bivalvia) induced by Ponto-Caspian gammarids. En: Biological Invasions, 14(9), pp.1851-1863. DOI: https://doi.org/10.1007/s10530-012-0197-x
Kojima, R., Kobayashi, S., Satuito, C.G.P., Katsuyama, I., Ando, H., Seki, Y. y Senda, T., 2016. A method for evaluating the efficacy of antifouling paints using Mytilus galloprovincialis in the laboratory in a flow-through system. En: Plos one, 11(12), e0168172. DOI: https://doi.org/10.1371/journal.pone.0168172
Lepoutre, A., Milliote, N., Bonnard, M., Ladeiro, M.P., Rioult, D., Bonnard, I., Bastien, F., Faassen, E., Geffard, A. y Lance, E., 2018. Genotoxic and Cytotoxic Effects on the Immune Cells of the Freshwater Bivalve Dreissena polymorpha Exposed to the Environmental Neurotoxin BMAA. En: Toxins, 10(3). DOI: https://doi.org/10.3390/toxins10030106
Li, S., Chen, Y., Gao, Y., Xia, Z. y Zhan, A., 2019. Chemical oxidants affect byssu adhesion in the highly invasive fouling mussel Limnoperna fortunei. En: Science of the Total Environment, 646, pp.1367-1375. DOI: https://doi.org/10.1016/j.scitotenv.2018.07.434
Liu, W., Xu, M., Zhang, J. y Zhang, T., 2020. Survival and attachment of biofouling freshwater mussel (Limnoperna fortunei) to environmental conditions: potential implications in its invasion, infection, and biofouling control. En: Limnology, 21, pp.245–255. DOI: https://doi.org/10.1007/s10201-020-00607-1
Lockwood, B.L. y Somero, G.N., 2011. Invasive and native blue mussels (genus Mytilus) on the California coast: The role of physiology in a biological invasion. En: Journal of Experimental Marine Biology and Ecology, 400(1-2), pp.167–174. DOI: https://doi.org/10.1016/j.jembe.2011.02.022
Mabrouk, S.B., Reis, M., Sousa, M.L., Ribeiro, T., Almeida, J.R., Pereira, S., Antunes, J., Rosa, F., Vasconcelos, V., Achour, L., Kacem, A. y Urbatzka, R., 2020. The Marine Seagrass Halophila stipulacea as a Source of Bioactive Metabolites against Obesity and Biofouling. En: Marine Drugs, 18(2), pp.88. DOI: https://doi.org/10.3390/md18020088
Matsui, K., Fumoto, T. y Kawakami, H., 2018. Testing the repellent effects of construction materials on the attachment of the invasive golden mussel, Limnopernafortunei, in a Japanese urban tidal river. En: Limnology, 20, pp.131–136. DOI: https://doi.org/10.1007/s10201-018-0559-x
Matsuo, T., Mizuno, Y. y Cho, H., 2009. Monitoring of pipe clogging by mussels utilizing an optical fiber AE system. En: Journal of Acoustic Emission, 27.
Murray, C.C., Pakhomov, E.A. y Therriault, T.W., 2011. Recreational boating: a large unregulated vector transporting marine invasive species. En: Diversity and Distributions, 17(6), pp.1161–1172. DOI: https://doi.org/10.1111/j.1472-4642.2011.00798.x
Nakano, D., Kobayashi, T. y Sakaguchi, I., 2010. Predation and depth effects on abundance and size distribution of an invasive bivalve, the golden mussel Limnopernafortunei, in a dam reservoir. En: Limnology, 11(3), pp.259–266. DOI: https://doi.org/10.1007/s10201-010-0314-4
Olabarria, C., Gestoso, I., Lima, F.P., Vázquez, E., Comeau, L.A., Gomes, F., Seabra, R. y Babarro, J.M.F., 2016. Response of two mytilids to a heatwave: the complex interplay of physiology, behaviour and ecological interactions. En: Plos One, 11(10), e0164330. DOI: https://doi.org/10.1371/journal.pone.0164330
Ozkan, A. y Berberoglu, H., 2013. Adhesion of algal cells to surfaces. En: Biofouling, 29(4), pp.469–482. DOI: https://doi.org/10.1080/08927014.2013.782397
Paolucci, E., Cataldo, D. y Boltovskoy, D., 2009. Prey selection by larvae of Prochiloduslineatus (Pisces: Curimatidae): indigenous zooplankton versus veligers of the introduced bivalve Limnopernafortunei (Bivalvia: Mitilidae). En: Aquatic Ecology, 44, pp.255–267. DOI: https://doi.org/10.1007/s10452-009-9263-6
Perepelizin, P.V. y Boltovskoy, D., 2011. Thermal tolerance of Limnoperna fortunei to gradual temperature increase and its applications for biofouling control in industrial and power plants. En: Journal of Bioadhesion and Biofilm Research, 27(6), pp.667-674. DOI: https://doi.org/10.1080/08927014.2011.594504
Phillips, S., Darland, T. y Systema, M., 2005. Potential economic impacts of Zebra Mussels on the hydropower facilities in the Columbia River basin: prepared for the Bonneville Power Admin. Portland: Pacific States Marine Fisheries Commission.
Piola, R.F. y Hopkins, G.A., 2012. Thermal treatment as a method to control transfers of invasive biofouling species via vessel sea chests. En: Marine Pollution Bulletin, 64(8), pp.1620–1630. DOI: https://doi.org/10.1016/j.marpolbul.2012.05.028
Prakash, S., Ramasubburayan, R., Iyapparaj, P., Arthi, A.P.R., Ahila, N.K., Ramkumar, V.S., Immanuelb, G. y Palavesam, A., 2015. Environmentally benign antifouling potentials of triterpene-glycosides from Streptomyces fradiae: a mangrove isolate. En: RSC Advances, 5, pp.29524 - 29534. DOI: 10.1039/C4RA15335A
Pucherelli, S.F., Claudi, R. y Prescott, T., 2018. Control of biofouling in hydropower cooling systems using HOD ultraviolet light. En: Management of Biological Invasions, 9(4), pp.451-461. DOI: https://doi.org/10.3391/mbi.2018.9.4.08
Rajagopal, S., Venugopalan, V., Velde, G. y Jenner, H., 2006. Control of Modiolid Mussels in Cooling Water Systems by Continuous Chlorination. En: Archives of Environmental Contamination and Toxicology, 51(2), pp.215-222. DOI: https://doi.org/10.1007/s00244-005-0257-7
Ribeiro, S.M., Rogers, R., Rubem, A.C., Gama, B.A.P., Muricy, G. y Pereira, R.C., 2013. Antifouling activity of twelve demosponges from Brazil. En: Brazilian Journal of Biology, 73(3), pp.501-506. DOI: https://doi.org/10.1590/S1519-69842013000300006
Rice, M.A., Rawson, P.D., Salinas, A.D. y Rosario, W.R., 2016. Identification and salinity tolerance of the western hemisphere mussel Mytellacharruana (d’orbigny, 1842) in the philippines. En: Journal of Shellfish Research, 35(4), pp.865-873. DOI: https://doi.org/10.2983/035.035.0415
Rosa, D.M., Gaspar, M.R.C., Silva, F.A. y Pompeu, P.S, 2019. Impacts of predation by piapara Megaleporinus obtusidens (Valenciennes, 1837) on the population densities of the invasive golden mussel Limnoperna fortunei (Dunker, 1857). En: Biological Control, 129, pp.158-163. DOI: https://doi.org/10.1016/j.biocontrol.2018.10.012
Sahu, G., Satpathy, K., Mohanty, A., Biswas, S., Achary, M. y Sarkar, S., 2013. Larval abundance and its relation to macrofouling settlement pattern in the coastal waters of Kalpakkam, southeastern part of India. En: Environmental Monitoring and Assessment, 185, pp.1951–1967. DOI: https://doi.org/10.1007/s10661-012-2679-9
Schaefer, R., Claudi, R. y Grapperhaus, M., 2010. Control of zebra mussels using sparker pressure pulses. En: Journal American Water Works Association, 102(4), pp.113–122. DOI: https://doi.org/10.1002/j.1551-8833.2010.tb10096.x
Schultz, M.P., 2007. Effects of coating roughness and biofouling on ship resistance and powering. En: Biofouling, 23(5), pp.331–341. DOI: https://doi.org/10.1080/08927010701461974
Schultz, M.P., Bendick, J.A., Holm, E.R. y Hertel, W.M., 2011. Economic impact of biofouling on a naval surface ship. En: Biofouling, 27(1), pp.87–98. DOI: https://doi.org/10.1080/08927014.2010.542809
Schwindt, E. y Bortolus, A., 2017. Aquatic invasion biology research in South America: Geographic patterns, advances and perspectives. En: Aquatic Ecosystem Health & Management, pp.322-333. DOI: https://doi.org/10.1080/14634988.2017.1404413
Siless, G.E., Garcia, M., Perez, M., Blustein, G. y Palermo, J., 2017. Large-scale purification of pachydictyol A from the brown alga Dictyota dichotoma obtained from algal wash and evaluation of its antifouling activity against the freshwater mollusk Limnoperna fortunei. En: Journal of Applied Phycology, 30(1), pp.629–636. DOI: https://doi.org/10.1007/s10811-017-1261-9
Silva, I., Naya, D., Mello, F.T., D’Anatro, A., Tesitore, G., Clavijo, C. y Gonzáles-Bergonzoni, I., 2021. Fish vs. Aliens: predatory fish regulate populations of Limnoperna fortunei mitigating impacts on native macroinvertebrate communities. En: Hydrobiologia, 848, pp.2281-2301. DOI: https://doi.org/10.1007/s10750-020-04421-9
Somma, A., Nogueira, L., González-Madina, L. y Langone, J.A., 2021. Dinámica larval del mejillón dorado Limnoperna fortunei en el embalse de Aguas Corrientes, Río Santa Lucía, Uruguay. En: INNOTEC, 21, pp.132-152. DOI: https://doi.org/10.26461/21.06
Soroldoni, S., Abreu, F., Castro, I.B., Duarte, F.A. y Pinho, G.L.L., 2017. Are antifouling paint particles a continuous source of toxic chemicals to the marine environment? En: Journal of Hazardous Materials, 15(330), pp.76–82. DOI: https://doi.org/10.1016/j.jhazmat.2017.02.001
Thomas, K.V., McHugh, M., Hilton, M. y Waldock, M., 2003. Increased persistence of antifouling paint biocides when associated with paint particles. En: Environmental Pollution, 123, pp.153-161. DOI: https://doi.org/10.1016/S0269-7491(02)00343-3
Turner, A., 2010. Marine pollution from antifouling paint particles. En: Marine Pollution Bulletin, 60, pp.159-171. DOI: https://doi.org/10.1016/j.marpolbul.2009.12.004
Uliano-Silva, M., Dondero, F., Otto, T.D., Costa, I., Lima, N.C.B., Americo, J.A., Mazzoni, C.J., Prosdocimi, F. y Rebelo, M.F., 2018. A hybrid-hierarchical genome assembly strategy to sequence the invasive golden mussel, Limnoperna fortunei. En: Giga Science, 7(2). DOI: https://doi.org/10.1093/gigascience/gix128
Vieira, J. y Lopes, M., 2013. Size-selective predation of the catfish Pimelodus pintado (Siluriformes: Pimelodidae) on the golden mussel Limnoperna fortunei (Bivalvia: Mytilidae). En: Zoologia, 30(1), pp.43-48. DOI: https://doi.org/10.1590/S1984-46702013000100005
WoRMS, 2020. World Register of Marine Species. [s.l.]: WoRMS. [Consulta: 28 de julio de 2020]. Disponible en: http://www.marinespecies.org/
Xu, M.Z., Darrigran, G., Wang, Z.Y., Zhao, N., Lin, C.C. y Pan, B.Z., 2015. Experimental study on control of Limnoperna fortunei biofouling in water transfer tunnels. En: Journal of Hydro-environment Research, 9, pp.248–258. DOI: https://doi.org/10.1016/j.jher.2014.06.006
Yuan, W.S., Walters, L.J., Brodsky, S.A., Schneider, K.R. y Hoffman, E.A., 2016. Synergistic Effects of Salinity and Temperature on the Survival of Two Nonnative Bivalve Molluscs, Perna viridis (Linnaeus 1758) and Mytella charruana (d’Orbigny 1846). En: Journal of Marine Biology, 2016(1), pp.1-14. DOI: https://doi.org/10.1155/2016/9261309
Anexos
Anexo 1. Experimentos probados con resultados satisfactorios sobre el uso de métodos de control de mejillones invasores, según familia y especie de mejillón. La información bibliográfica completa se puede encontrar en el documento principal.