Autores
- IRIGARAY, BRUNO (1); CALLEJAS, NICOLÁS (1); ESTRADÉ, DOLORES (1); REBELLATO, CECILIA (1); VIEITEZ, IGNACIO (1).
- (1) DEPARTAMENTO DE CIENCIA Y TECNOLOGÍA DE ALIMENTOS, FACULTAD DE QUÍMICA, UNIVERSIDAD DE LA REPÚBLICA. MONTEVIDEO, URUGUAY.
Los frutos secos contienen un alto contenido de ácido oleico y/o ácidos poliinsaturados, por lo que su ingesta reduce los niveles de colesterol total y colesterol LDL en sangre, lo que se asocia a una menor incidencia de enfermedades cardiovasculares. A su vez, los frutos secos podrían tener efectos beneficiosos en la salud humana debido a la presencia de antioxidantes (polifenoles y tocoferoles). En el presente trabajo se determinó el contenido de lípidos, el perfil en ácidos grasos y el contenido de polifenoles y tocoferoles de algunos frutos secos: nueces, nueces pecan, avellanas, almendras, maní, pistachos y castañas de cajú. Se optimizó la extracción de los polifenoles en avellanas mediante la utilización de diferentes mezclas de solventes y distintas condiciones de temperatura y tiempos de extracción. Con la mezcla agua/acetona (80:20) a 25 ºC, durante 24 horas, se obtuvo el mayor contenido de polifenoles. El contenido de polifenoles de los extractos obtenidos de los frutos secos presentó valores en el rango entre 427 ppm (almendras) y 8805 ppm (nueces), mientras que el contenido de tocoferoles, entre 160 ppm (castañas de cajú) y 358 ppm (nueces). Se concluye que los frutos secos analizados poseen contenidos importantes de antioxidantes, pero en cantidades diferentes. Además, la cáscara ofrece una barrera para enlentecer los procesos de oxidación del aceite presente en el fruto.
PALABRAS CLAVE: ácidos grasos, polifenoles, tocoferoles, oxidación.
Os frutos secos possuem alto teor de ácido oleico e/ou ácidos poliinsaturados, razão pela qual sua ingestão reduz os níveis de colesterol total e LDL no sangue, que está associado à menor incidência de doenças cardiovasculares. Além disso, os frutos secos poderiam apresentar efeitos benéficos à saúde humana devido à presença de antioxidantes (polifenóis e tocoferóis). No presente trabalho, foram determinados o teor de lipídios, o perfil de ácidos graxos e o teor de polifenóis e tocoferóis de alguns frutos secos: nozes, noz-pecã, avelã, amêndoa, amendoim, pistache e castanha de caju. A extração dos polifenóis nas avelãs foi otimizada pelo uso de diferentes misturas de solventes em diferentes condições de temperatura e tempos de extração. Com a mistura água/acetona (80:20) a 25 ºC por 24 horas, obteve-se o maior teor de polifenóis. O teor de polifenóis dos extratos obtidos dos frutos secos apresentou valores na faixa de 427 ppm (amêndoas) a 8805 ppm (nozes), enquanto o teor de tocoferol, entre 160 ppm (castanha de caju) e 358 ppm (nozes). Consequentemente, os frutos secos analisados têm um conteúdo antioxidante significativo, mas em quantidades diferentes. Além disso, a casca oferece uma barreira para retardar os processos de oxidação do óleo presente.
PALAVRAS-CHAVE: ácidos graxos, polifenóis, tocoferóis, oxidação.
Introducción
Los frutos secos son alimentos grasos tradicionalmente asociados a la dieta mediterránea. Su consumo habitual, en dosis moderadas, reduce los niveles de colesterol total y de colesterol LDL en sangre y se los asocia, junto con otros alimentos, a una menor incidencia de enfermedades cardiovasculares (Garrido, et al., 2007; Chang; et al., 2016; Bitok y Sabaté, 2018). En julio del 2003, la FDA autorizó a los productores de estos alimentos a exhibir sus propiedades benéficas declarando que el consumo de 42 gramos diarios de muchos de estos frutos, como parte de una dieta baja en grasas saturadas y colesterol, puede reducir el riesgo de enfermedades cardiovasculares (Miraliakbari y Shahidi, 2008a). En general, los aceites derivados de frutos secos son ricos en ácidos grasos monoinsaturados (entre los cuales predomina el ácido oleico), en menor cantidad en ácidos grasos poliinsaturados (predominantemente ácido linoleico), y en una cantidad muy baja en ácidos grasos saturados (Miraliakbari y Shahidi, 2008a, 2008b).
Además de su contenido y perfil lipídico, los efectos beneficiosos de los frutos secos en la salud humana se atribuyen a la presencia, entre otros, de compuestos con actividad antioxidante (Göncüoğlu y Gökmen, 2017). Estos compuestos antioxidantes se encuentran tanto en la semilla como en las diferentes cubiertas que recubren al fruto, evitando o retrasando la oxidación de los ácidos grasos (Garrido, et al., 2007). Dentro de los antioxidantes naturales presentes se encuentran los polifenoles y los tocoferoles. Estudios previos señalan que los polifenoles poseen efectos antioxidantes, que previenen determinadas patologías como enfermedades coronarias y algunos tipos de cáncer, entre otros (Contini, et al., 2008). En tanto, los tocoferoles presentan tanto actividad antioxidante in vitro, protegiendo de la oxidación al aceite y a los alimentos que los contienen, como actividad in vivo, protegiendo a células y tejidos humanos frente a los radicales libres. El α-tocoferol presenta máxima actividad in vivo, mientras los demás tocoferoles (β, γ y δ-tocoferol) otorgan gran protección a los aceites y, en consecuencia, a los alimentos que los contienen (del Moral Navarrete, 2016). Un review reciente (Machado De Souza, et al., 2017) es importante para entender los efectos de los frutos secos sobre la salud humana.
El agregado de antioxidantes a los alimentos es uno de los métodos más efectivos para retrasar la oxidación lipídica. Ello mejora la estabilidad oxidativa de los lípidos y, por ende, aumenta la vida útil de los alimentos de manera de prevenir la pérdida de calidad sensorial y nutricional. Los antioxidantes sintéticos como BHA (Butilhidroxi-anisol), BHT (Butilhidroxi-tolueno), TBHQ (Terbutilhidroquinona) y PG (Galato de propilo) son utilizados habitualmente en muchos alimentos para prevenir la rancidez de las grasas y/o aceites. Estos antioxidantes presentan una serie de desventajas, por ejemplo: poseen diferente volatilidad y se descomponen fácilmente a altas temperaturas, lo que restringe su uso (Maestro y Borja, 1993). Además, existe una preocupación cada vez mayor respecto a los peligros potenciales que pueden causar los antioxidantes sintéticos debido a su posible toxicidad y a la presunción de una posible acción como promotores de la carcinogénesis (Namiki, 1990, Pokorny, 1991). En nuestro país se permite el uso de ciertas cantidades de BHA, BHT y TBHQ como aditivos en algunos alimentos, ejerciendo la función de antioxidantes. Los límites en grasas y aceites son de 100 mg/Kg para el BHA, y 200 mg/Kg para BHT y TBHQ. Por lo tanto, existe interés en aumentar el uso de antioxidantes naturales ya que se presume que podrían ser más seguros para la salud humana (Nepote, et al., 2002).
Los polifenoles y tocoferoles son antioxidantes naturales, y se clasifican como primarios ya que intervienen directamente en la interrupción de la cadena de oxidación mediante la donación de hidrogeniones: no detienen la formación de los radicales libres que se generan en la oxidación sino que, al reaccionar con ellos, los estabilizan y se producen radicales del antioxidante que son menos activos, o sea que el antioxidante se consume durante la reacción de oxidación (Badui, 2006; Armenteros, et al., 2012).
Existen diversos factores que afectan la eficiencia de extracción de distintos compuestos, entre los que se encuentran: la naturaleza del material del cual se extrae, los solventes empleados en el procedimiento y las condiciones en las que se realiza la extracción (tiempo, temperatura, etcétera) (Kumar y Keum, 2016). Muchos investigadores han estudiado diversos sistemas de solventes con el objetivo de analizar dicha influencia, pero un análisis bibliográfico detallado permite comprobar que los solventes más utilizados y convenientes para la extracción de compuestos fenólicos son soluciones metanólicas, etanólicas y acetónicas al 70-80% (Contini, et al., 2008). Además, los mismos presentan distintas polaridades, factor que se espera influya de manera importante en la extracción de estos compuestos (Delgado, et al., 2010).
Delgado y otros (2010) utilizaron los siguientes solventes y condiciones para la extracción de polifenoles en avellanas: agua en ebullición (45 minutos), metanol a temperatura ambiente (24 hs.), metanol a temperatura ambiente (48 hs.), agua/acetona (80:20) (24 hs.), agua/acetona (80:20) (48 hs.), agua/acetona (80:20) (72 hs.), encontrando que las condiciones dadas por el agua en ebullición durante 45 minutos fueron las que determinaron los mayores contenidos de polifenoles totales ((44.3 ± 7.7) mg GAE/g extracto). Las extracciones con metanol siempre mostraron las menores concentraciones, observando además que un aumento en el tiempo de extracción condujo a una reducción del contenido de polifenoles ((9.82-12.1) mg GAE/g extracto). Respecto a los extractos obtenidos con la solución de acetona, se observó que el tiempo de contacto de 24 horas es aparentemente suficiente para la extracción de polifenoles, dado que no se presentaron variaciones significativas en las tres extracciones realizadas en diferentes tiempos de extracción.
Garrido y otros (2007) realizaron un estudio similar sobre distintos subproductos del procesado de la almendra (piel, cáscara y mesocarpio), utilizando 8 mezclas de extracción diferentes durante 3 minutos en baño de ultrasonido: metanol/HCl (1000:1), metanol/agua (50:50), [metanol/HCl (1000:1)/agua] (50:50), acetona/agua (50:50), [acetona/HCl (1000:1)/agua] (50:50), acetona/agua (80:20), [acetona/HCl (1000:1)/agua] (80:20), agua en ebullición. Los resultados muestran diferencias respecto a cuál solvente permite obtener la mayor concentración de polifenoles en las distintas partes del fruto: en la piel, la mezcla acetona (acidulada y no acidulada)/agua (50:50) y acetona acidulada/agua (80:20); en la cáscara, la mezcla acetona (acidulada y no acidulada)/agua (80:20); y en el mesocarpio, la mezcla acetona (acidulada y no acidulada)/agua (50:50). Gao y otros (2019) utilizaron como solventes de extracción en nueces: hexano, acetato de etilo, éter de petróleo, mezcla cloroformo/metanol, (2:1) y acetona. Los autores determinaron que el acetato de etilo fue el mejor solvente para extraer lípidos de nuez (68.3%), mientras que la extracción con hexano dio comparativamente menor contenido de ácido linoleico (62.9%), la mezcla cloroformo/metanol fue adecuada para extraer tocoferoles (578,0 mg/kg) y finalmente en la extracción con acetona se obtuvo el mayor contenido de polifenoles (98,1 mg GAE/kg).
En el estudio desarrollado por Miraliakbari y Shahidi (2008a) se utiliza el método HPLC para determinar el contenido de tocoferoles totales en almendras, avellanas, nueces pecan, pistachos y nueces, entre otros, utilizando hexano como solvente de extracción. Sus resultados muestran que el aceite de avellana presenta el mayor contenido de tocoferoles totales (461.8 ±1.9 mg/kg de aceite), seguido por el aceite de nuez pecan (453.9 ± 1.8 mg/kg de aceite), el aceite de nuez (402.3 ± 1.9 mg/kg de aceite), el aceite de pistacho (334.3 ± 1.7 mg/kg de aceite) y por último el aceite de almendra (243.8 ± 1.1 mg/kg de aceite). Stuetz y otros (2017) determinaron que el contenido de α tocoferoles es elevado en las almendras y las avellanas, mientras que los pistachos y las nueces son ricos en γ tocoferoles.
Por todo lo expuesto anteriormente, resulta de interés la extracción y cuantificación de polifenoles y tocoferoles presentes en diferentes frutos secos comercializados en Uruguay mediante HPLC, y el estudio de la estabilidad de los aceites derivados de los mismos con el tiempo. Además, se consideró la extracción y cuantificación de polifenoles y tocoferoles en maníes, antes y después de diferentes procesos de cocción.
Materiales y Métodos
Los frutos secos utilizados fueron los siguientes: almendras (con cáscara), avellanas, castañas de cajú, nueces (con cáscara), nueces pecan (con cáscara), maní (con cáscara) y pistachos adquiridos crudos en comercios locales. Es importante resaltar que, para asegurar un muestreo representativo en todos los ensayos que posteriormente se detallan, se molieron entre 20-30 unidades de cada fruto seco, y luego se extrajo de esta muestra la masa necesaria para cada análisis.
Extracción de aceite: se pesó 0.5 g de fruto seco finamente molido y se agregó 25 mL de una mezcla hexano/isopropanol (3:2, vol/vol) (Hara y Radin, 1978). Se realizó la extracción a temperatura ambiente con agitación magnética vigorosa, por 1,5 horas, en tubos con tapa a rosca. El extracto resultante se centrifugó a 3000 rpm, por 10 minutos (a temperatura ambiente), en una centrífuga marca Hermle, modelo Z 200A, y posteriormente se extrajo la fase líquida a un segundo tubo con tapa a rosca. El primer tubo se lavó dos veces con 5 mL de hexano/isopropanol, los extractos orgánicos restantes se juntaron en el segundo tubo para luego realizar la eliminación del solvente mediante venteo con nitrógeno. Los aceites obtenidos fueron almacenados en freezer hasta el momento de los análisis.
Para caracterizar los aceites de los diferentes frutos secos desde el punto de vista de su composición en ácidos grasos, se utilizó cromatografía de gases, siendo nitrógeno el gas portador, por lo que primeramente se derivatizó la materia grasa extraída según la técnica IUPAC 2.301 (International Union of Pure and Applied Chemistry, 1987). Se utilizó un cromatógrafo de gases marca Shimadzu, modelo 14B, equipado con una columna marca Supelco SP2560 (100 m x 0,25 mm x 0,2μm) con el siguiente programa de temperatura: temperatura inicial de 90 ºC, durante 2 minutos, aumento hasta 175 ºC con una velocidad de 20 ºC/min y permanencia durante 35 minutos a esa temperatura; aumento de temperatura desde 175 ºC hasta 240 ºC con una velocidad de 15 ºC/min, y permanencia a esa temperatura final durante 25 minutos.
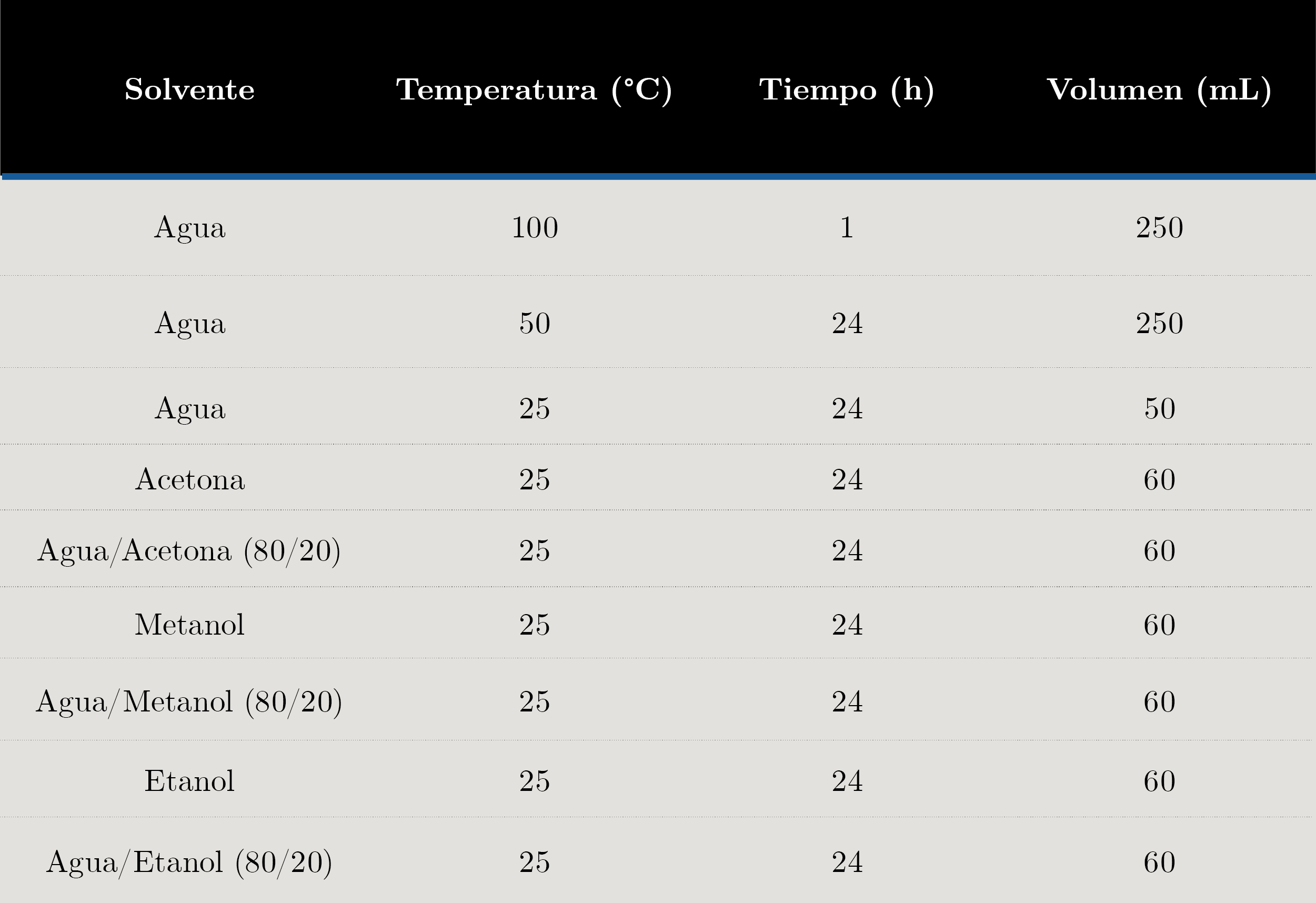
Optimización del método de extracción de polifenoles en avellanas: se pesaron 6 g. de avellana finamente molida y se agregó el volumen de solvente correspondiente en un matraz Erlenmeyer de 125 mL, según la condición a ensayar. Posteriormente, se agitó la mezcla durante el tiempo y temperatura establecidos por medio de un agitador magnético. El extracto resultante fue filtrado a vacío, incluyendo tres etapas de lavado del residuo con 5 mL del solvente en ensayo, y luego fue eliminado mediante liofilización, utilizando un Liofilizador Chirst alpha 1-4/Loc-1m. Los extractos obtenidos fueron almacenados en freezer hasta el momento del análisis. Las condiciones de extracción ensayadas se presentan en la Tabla 1.
Tabla 1. Diferentes condiciones de extracción de polifenoles ensayadas en avellanas.
Determinación de polifenoles totales: para el análisis de polifenoles totales, la extracción se realizó con una mezcla agua/acetona, dado que resultó ser el método óptimo de extracción en avellanas. Se pesó 6 g del fruto seco finamente molido y se agregó 60 mL de agua/acetona (80:20) en un matraz Erlenmeyer de 125 mL. Posteriormente, se agitó la mezcla durante 24 horas a temperatura ambiente por medio de un agitador magnético. El extracto resultante se filtró a vacío en un embudo Büchner con papel de filtro. Se realizaron tres etapas de lavado del residuo con 5 mL de mezcla, y el solvente fue eliminado mediante liofilización, utilizando un Liofilizador Chirst alpha 1-4/Loc-1m. Los extractos obtenidos fueron almacenados en freezer hasta el momento del análisis.
Análisis de polifenoles totales en el extracto: la determinación del contenido total de polifenoles se realizó por cromatografía líquida de alta resolución (HPLC), utilizando un cromatógrafo Shimadzu, modelo 20-A, equipado con un detector de arreglo de diodos y con una columna Macherey-Nagel C18 (250 × 4,6 mm, 100 μm) a 40 °C. Se pesaron 10 mg del extracto obtenido en el liofilizador en un vial y se adicionó 1 mL de mezcla metanol/agua (80:20). La detección de los polifenoles fue realizada a una longitud de onda de 280 nm, según el método descrito por Jakopic y otros (2011). Para la cuantificación de los polifenoles se utilizó como estándar externo ácido siríngico (Sigma Aldrich).
Análisis de tocoferoles totales: la determinación del contenido total de tocoferoles se realizó por cromatografía líquida de alta resolución (HPLC), utilizando un cromatógrafo marca Shimadzu, modelo 20 A, equipado con un detector de fluorescencia modelo RF 20A XS y con una columna Macherey-Nagel C18 (250 × 4,6 mm, 100 μm) a 40 °C. Se pesaron 30 mg de aceite en un vial y se adicionó 1 mL de isopropanol (calidad HPLC). Se inyectó 50 μL de muestra y se registró el cromatograma a una longitud de onda de excitación de 290 nm y a una longitud de onda de emisión de 330 nm, utilizando como fase móvil acetonitrilo, metanol, isopropanol y agua bajo condiciones descritas en Andrikopoulos y otros (1991). La cuantificación de los tocoferoles se realizó mediante la utilización de una curva de calibración, que fue realizada con estándares de tocoferoles α, β, γ γ δ (Sigma Aldrich).
Estabilidad oxidativa del aceite obtenido de los diferentes frutos secos: se estudió la influencia que tienen en el deterioro oxidativo, el tiempo de almacenamiento y el contenido de tocoferoles en las distintas muestras (almendras, avellanas, castañas de cajú, maní, nueces, nueces pecan y pistachos). Las nueces, nueces pecan, maní y almendras fueron compradas con cáscara con el objetivo de evaluar la protección adicional que pudiese brindarle al fruto; para ello, se realizaron los análisis de estabilidad sobre la misma muestra de estos frutos con y sin cáscara. El primer día se retiró la cáscara para obtener la cantidad necesaria estimada para los análisis sin cáscara, y fueron almacenados de esta forma durante el tiempo de estudio. También fueron almacenados los frutos con cáscara desde el primer día. Tanto los frutos con y sin cáscara fueron guardados a temperatura ambiente en bandejas plásticas con tapa agujereada para permitir el intercambio de oxígeno y simular las condiciones reales de almacenamiento. El tiempo de estudio fue de 6 meses, tomándose muestras de las bandejas plásticas cada dos meses para los análisis correspondientes.
Determinación del Índice de Peróxidos: para la determinación del Índice de Peróxidos se utilizó como referencia la técnica AOCS Cd 8-53 (American Oil Chemists’ Society, 1998).
Determinación del contenido de polifenoles y tocoferoles totales en maní expuesto a diferentes tratamientos térmicos: se estudió la influencia que tienen distintos tratamientos térmicos de tostado en el contenido de polifenoles y tocoferoles totales en las distintas partes que constituyen el maní. Los tratamientos seleccionados fueron horno a 200 °C, durante 20 minutos, y microondas a potencia máxima (potencia de salida de microonda 800 W, potencia nominal 1200 W, frecuencia de microonda 2450 MHz), durante 4 minutos. Estos tratamientos fueron comparados con los frutos sin ningún tipo de proceso de tostado. Con el objetivo de establecer qué parte del maní tiene mayor contenido de estos antioxidantes y evaluar en cuáles el tratamiento tiene mayor incidencia, se sometieron a los procedimientos antes citados la piel, el fruto y la cáscara separadamente. En el caso del estudio del maní sin tratamiento térmico, se analizaron la piel y el fruto en su conjunto, y la cáscara por separado, debido a la dificultad de extraer la piel del fruto que no ha sido sometido a un proceso de tostado.
Resultados y Discusión
En la Figura 1 se muestra el porcentaje de grasa y la composición en ácidos grasos de los aceites.
Entre los frutos secos en estudio, la nuez pecan presentó el mayor contenido de lípidos (73,2 %). El contenido de lípidos en orden decreciente fue el siguiente: nueces pecan (73,2%) > nueces (65,9%) > avellanas (60,4%) > pistachos (54,5%) > maní (51,4%) > almendras (48,3%) > castañas (48,1%). Kornsteiner y otros (2006) estudiaron el contenido de lípidos (por el método de Soxhlet) de algunos frutos secos y sus resultados muestran que el porcentaje varía desde 60,2% en avellanas, 56,7% en almendras, 64,2 % en nueces, 71,8 % en nueces pecan, 52,8 % en pistachos, 47,1 % en castañas de cajú y 51,6 % en maní. Los resultados obtenidos en el presente estudio son similares a los mencionados anteriormente y también a los reportados por otros autores, con variaciones dependiendo del origen y el estado de los frutos secos (referido al momento de la vida útil del fruto en que se realiza la determinación del contenido de lípidos) (Miraliakbari y Shahidi, 2008b). Los ácidos grasos que se identificaron como mayoritarios son el ácido oleico (18:1), con valores que oscilan entre 14,2% para nueces y 84,7% para avellanas, y el ácido linoleico (18:2), con contenidos en el rango de 6,6% para avellanas y 63% para nueces. El ácido oleico fue el mayoritario en todas las muestras analizadas, a excepción del aceite de nuez que contiene ácido linoleico en forma predominante (63%). De las muestras analizadas, el aceite de avellana presentó el mayor contenido de ácido oleico (84,7%), seguido del aceite de almendras (72,0%). El aceite de nuez fue el de menor porcentaje de ácido oleico (14,2%), pero resultó el más rico en ácido linoleico (63%) y linolénico (13,2%). Entre los aceites en estudio, el de pistacho mostró los mayores porcentajes de ácido palmítico (12,2%), mientras que el aceite de castañas de cajú fue el más rico en ácido esteárico (7,1%). Teniendo en cuenta la totalidad de los ácidos grasos saturados, el aceite de maní presentó el mayor porcentaje (20%) (Figura 1). La composición en ácidos grasos determinada en este estudio es similar a la reportada por Miraliakbari y Shahidi (2008b), donde las extracciones fueron realizadas con Hexano o con una mezcla cloroformo/metanol y determinaron para los aceites de avellana y almendra un 83,4% y 69,9% de ácido oleico, respectivamente, y para el aceite de nuez pecan un 37,7% de ácido linoleico. También, en esta investigación, el aceite de nuez resultó el menos concentrado en ácido oleico (12,1%), en tanto las concentraciones del ácido linoleico y del linolénico fueron de 49,6% y 12,9%, respectivamente.
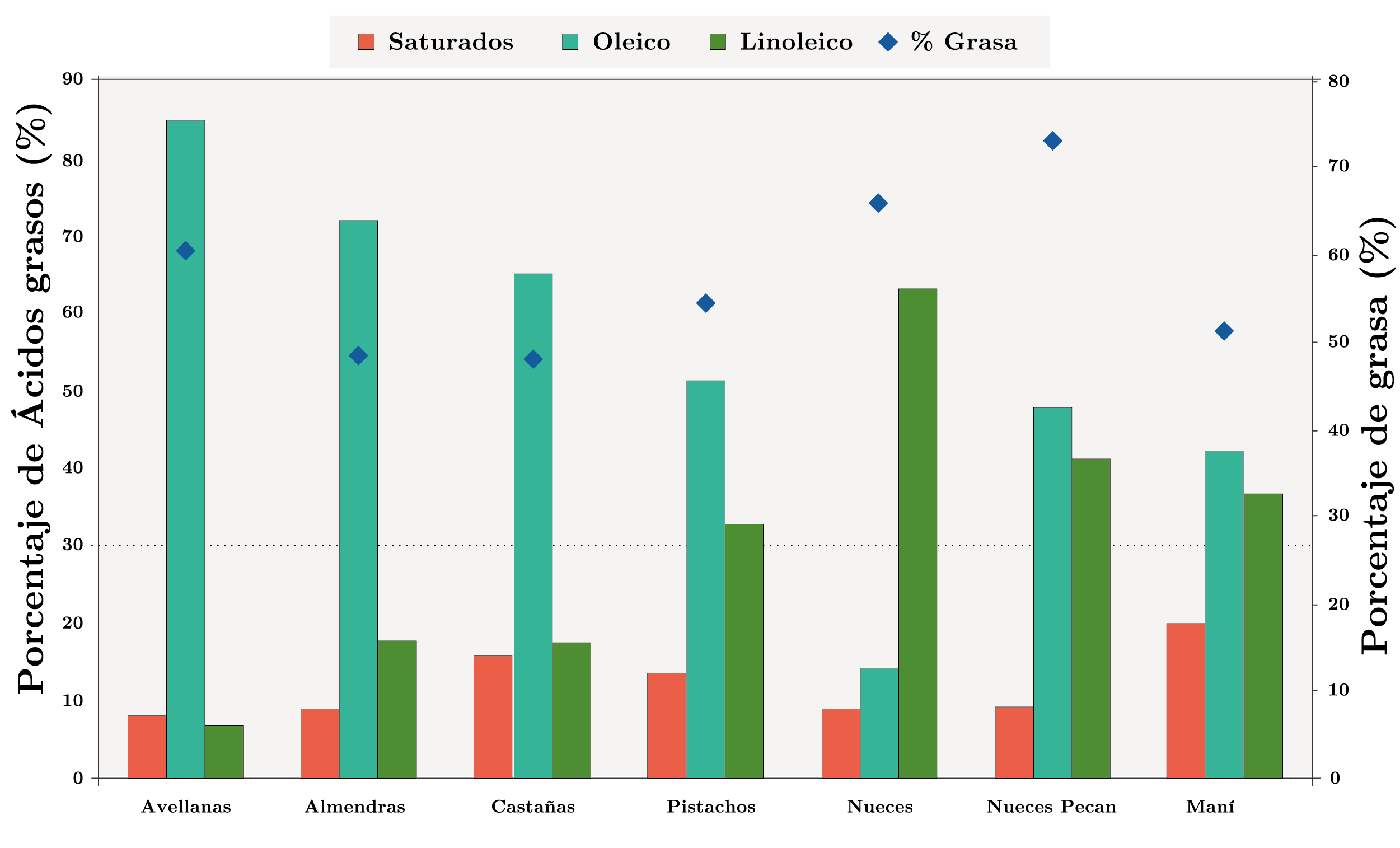
Figura 1. Composición en ácidos grasos (% m/m) de los aceites obtenidos
Optimización de la extracción de polifenoles: se seleccionaron como solventes de extracción agua, acetona, metanol, etanol y soluciones metanólicas, etanólicas y acetónicas al 80% (v/v) (20 % de agua) para evaluar la incidencia de estos solventes en la concentración de polifenoles en los extractos resultantes. Para ello se seleccionó la avellana como el fruto seco a utilizar, ya que existen trabajos previos donde se identifican y cuantifican los polifenoles por cromatografía líquida de alta resolución (Jakopic, et al., 2011). Un factor que incide en la eficiencia de extracción es la temperatura, ya que un aumento de la misma provoca el incremento de la velocidad de extracción debido a que los compuestos aumentan su solubilidad. Sin embargo, debe tenerse en cuenta que los compuestos en estudio son termolábiles y, por lo tanto, pueden degradarse durante el proceso de extracción o perder propiedades que los hacen interesantes para su uso, información que se consideró al momento de determinar los tiempos de extracción a utilizar para cada temperatura.
Por lo expuesto anteriormente, resulta de interés el estudio de la temperatura para conocer la condición más adecuada para realizar la extracción. Se ensayaron 3 temperaturas diferentes utilizando agua como solvente: 25ºC (24 horas), 50ºC (24 horas) y 100ºC (1 hora). En el caso de la extracción con agua a ebullición (100ºC), un tiempo de 24 horas provocaría la degradación de los antioxidantes, disminuyendo su recuperación. Por esta razón, el tiempo de extracción se redujo considerablemente a 1 hora. La Figura 2a muestra los resultados obtenidos. Como se observa, la condición que resultó en extractos más concentrados en polifenoles es la que utiliza una temperatura de 50ºC (24 horas), con 1691 ppm, seguida de aquella llevada a cabo a 25ºC (24 horas), con 1305 ppm; la condición menos favorable para la extracción fue la que utiliza agua en ebullición (1 hora), con 971 ppm. Otros investigadores han estudiado la concentración de polifenoles en extractos obtenidos utilizando mezclas de solventes con agua, observándose resultados acertados en la extracción (Contini, et al., 2008). En consecuencia, para la extracción de compuestos fenólicos se ensayaron 3 mezclas de solventes con agua: agua/acetona (80/20) (v/v), agua/metanol (80/20 (v/v) y agua/etanol (80/20) (v/v), con fin de determinar cuáles de los solventes y mezclas resultaron óptimos para la extracción de polifenoles. La Figura 2b muestra los resultados obtenidos utilizando las mezclas ensayadas. Los resultados permiten concluir que la extracción llevada a cabo con la mezcla agua/acetona (80/20), durante 24 horas y a temperatura ambiente (25ºC), fue la que resultó más eficiente para la extracción de polifenoles en avellanas, con 3786 ppm en el extracto. Por este motivo, se eligieron estas condiciones de extracción (mezcla de solventes, temperatura, tiempo) para desarrollar los análisis que permiten determinar el contenido de polifenoles en los distintos frutos secos. Sin embargo, debe tenerse presente que la condición determinada no necesariamente tiene que ser la más eficiente para el resto de los frutos secos analizados. Por otra parte, la solución agua/etanol (80/20) mostró ser la menos adecuada en la extracción, con 410 ppm en el extracto. Respecto al solvente más adecuado en la extracción de polifenoles, Delgado y otros (2010) observaron que el orden respecto a la eficiencia de extracción que muestran los distintos solventes y condiciones utilizadas es: agua en ebullición (45 min) > solución de acetona al 80 % (v/v) (24, 48 y 72 horas dado que no presentaron diferencias significativas) > metanol (24 horas) > metanol (48 horas). Los autores atribuyen estos resultados a la polaridad de los solventes, concluyendo que los solventes más polares como el agua extraen mejor los polifenoles, seguido de solventes con mayor tendencia a participar en interacciones dipolares. Los autores proponen también que los solventes con mayor tendencia a participar en interacciones de hidrógeno, como el metanol, son menos eficientes en la extracción de polifenoles en avellanas. Además, se debe tener en cuenta que, al tratarse de una mezcla de solventes, la condición más eficiente para la extracción es debido a las interacciones con los grupos funcionales de los polifenoles.
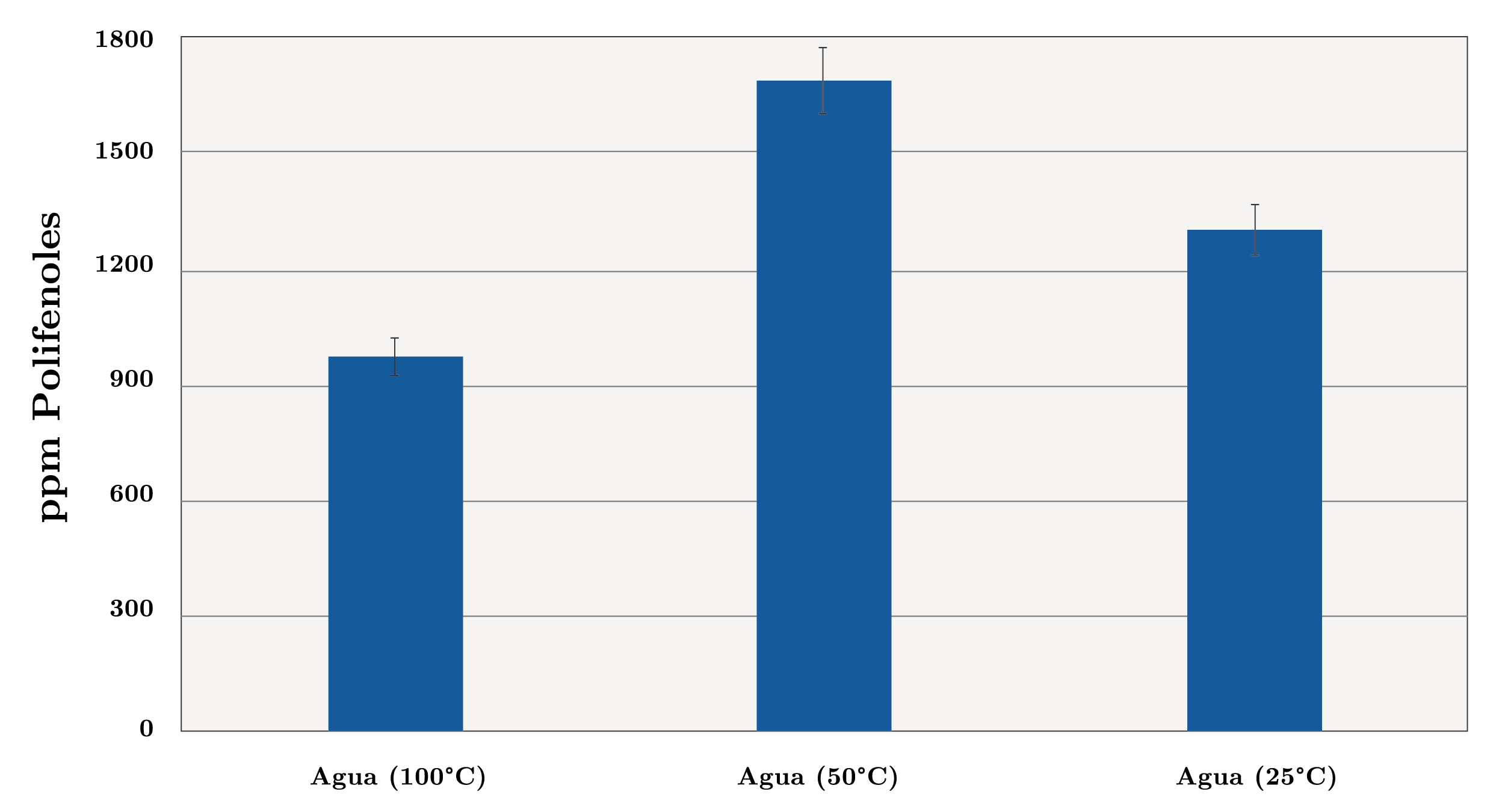
Figura 2a. Contenido de polifenoles en extractos de avellana (ppm) utilizando agua como solvente de extracción a diferentes temperaturas y tiempos: 100ºC (1 hora), 50ºC (24 horas) y temperatura ambiente (24 horas).
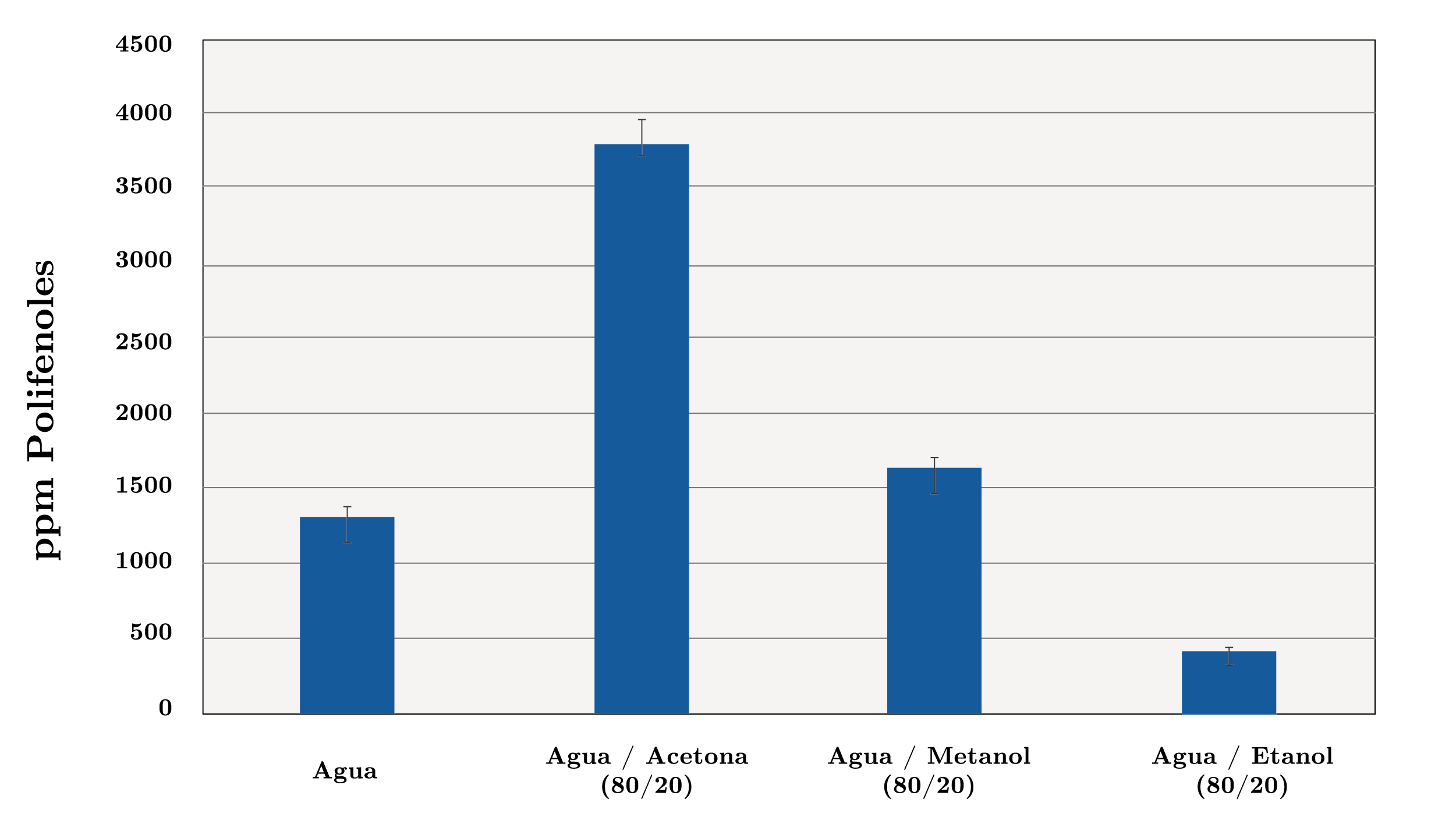
Figura 2b. Contenido de polifenoles en extractos de avellana (ppm) obtenidos a partir de agua como solvente de extracción y mezclas de extracción distintos solventes: agua/acetona (80/20), agua/metanol (80/20, v/v) y agua/etanol (80/20), a 25 ºC durante 24 horas.
Contenido inicial de polifenoles y tocoferoles en distintos frutos secos: los análisis del contenido de polifenoles y tocoferoles contribuyen a comprender y explicar la evolución de dichos antioxidantes naturales en el fruto durante el almacenamiento. Sin embargo, también se debe tener en cuenta que no todos los polifenoles presentan la misma protección como antioxidantes naturales. Es conocido que la actividad antioxidante de una determinada molécula se ve afectada por la naturaleza del grupo funcional responsable de dicha actividad y de las características de los diferentes grupos funcionales enlazados a él, lo que ha sido reportado para antioxidantes con diferentes estructuras químicas (López-Giraldo, et al., 2009).
Los resultados referentes al contenido de polifenoles totales en los extractos obtenidos de los frutos secos en estudio se presentan en la Figura 3. La concentración de polifenoles totales en los extractos presentó una variación entre 427 ppm (almendras) y 8805 ppm (nueces). Por lo tanto, el extracto de nuez resultó el más concentrado en polifenoles totales. El contenido de polifenoles totales en los extractos en orden decreciente fue: nueces (8805 ppm) > avellanas (3786 ppm) > nueces pecan (1475 ppm) > maní (1453 ppm) > castañas de cajú (654 ppm) > pistachos (450 ppm) > almendras (427 ppm).
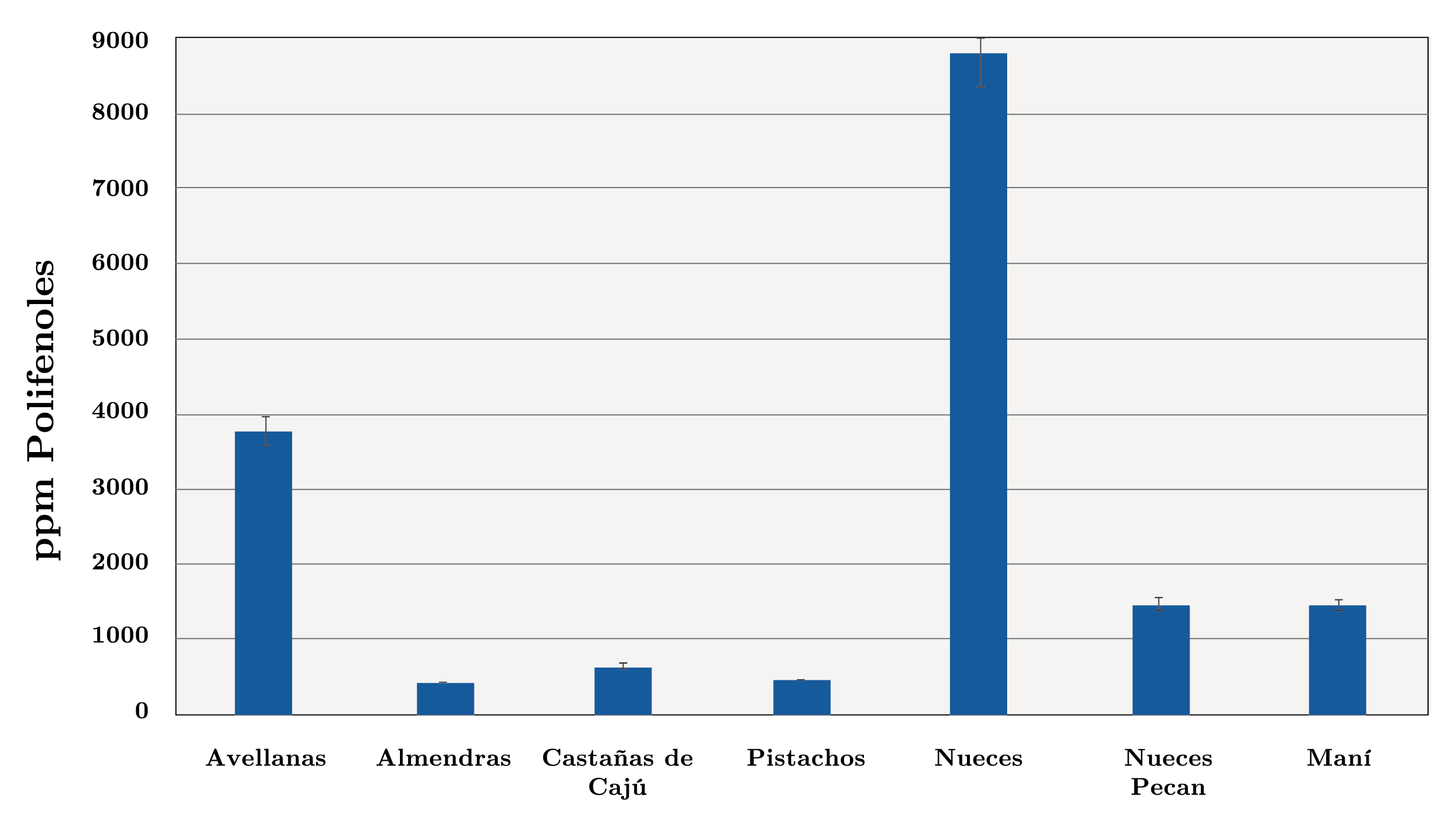
Figura 3. Contenido de polifenoles totales en los extractos de distintos frutos secos (ppm).
Respecto a la distribución del contenido de tocoferoles de cada tipo (Figura 5), se observa que los α-, β- y γ-tocoferoles se detectaron en todos los aceites de los frutos secos en estudio, siendo el α-tocoferol el predominante en almendras y avellanas (94% y 55%, respectivamente), mientras que el β- y γ-tocoferol lo fueron en pistachos (90%), nueces pecan (96%), nueces (88%), maní (84%) y castañas de cajú (92%). El δ-tocoferol fue detectado en menor proporción en la mayoría de los aceites en estudio, a excepción del aceite de almendra. La variación de los diferentes tocoferoles presentes en los frutos secos fue: α-tocoferol entre 1% (nueces) y 94% (almendras), β- y γ tocoferoles entre 6% (almendras) y 96% (nueces pecan), y δ-tocoferol entre 0% (almendras) y 11% (nueces). Estos resultados son similares a los reportados en el trabajo de Stuetz y otros (2017).
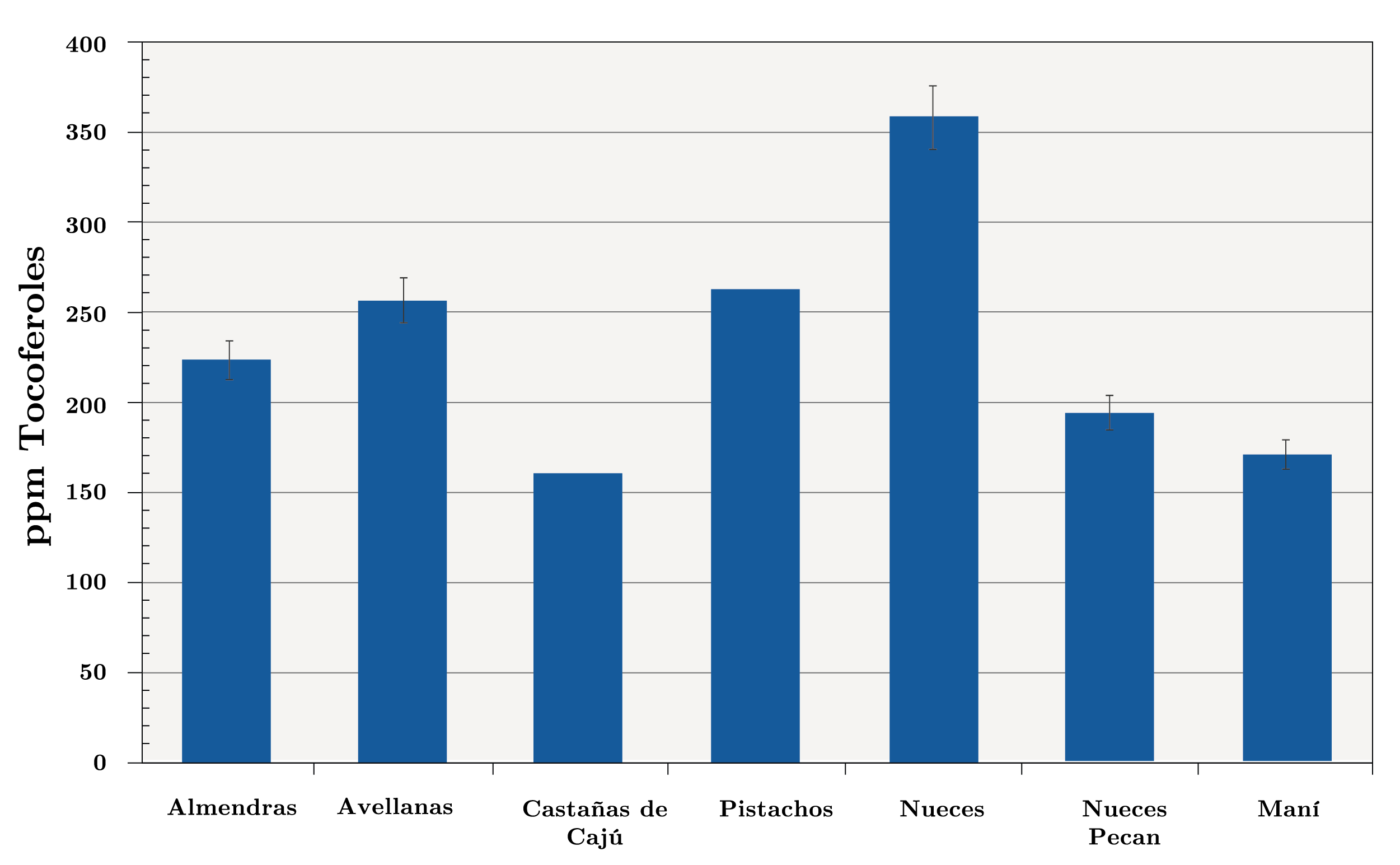
Figura 4. Contenido de tocoferoles totales en los aceites de distintos frutos secos (ppm).
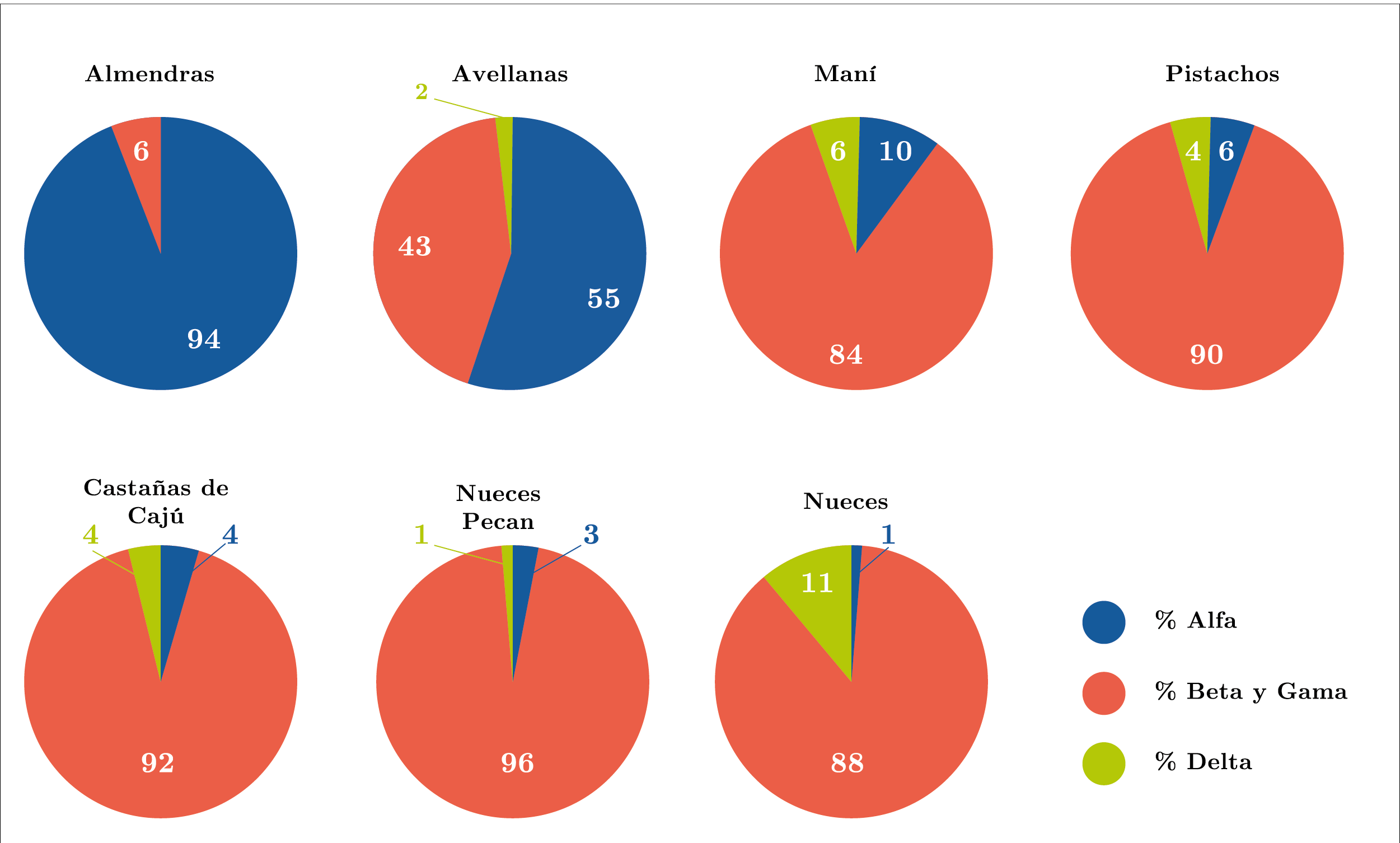
Figura 5. Distribución en porcentaje de α-, β + γ y δ-tocoferoles en los aceites extraídos de distintos frutos secos.
Evolución de los parámetros de oxidación con el transcurso del tiempo: la Figura 6 muestra los resultados del índice de peróxidos y el contenido de tocoferoles totales para los aceites obtenidos de los diferentes frutos secos durante los meses de almacenamiento (mes 1, mes 3 y mes 6). Estos resultados muestran que el orden de estabilidad respecto a la oxidación primaria en el último mes de estudio (mes 6) para los frutos sin cáscara es el siguiente: almendras > nueces > maní > castañas de cajú > avellanas > pistachos > nueces pecan. El índice de peróxidos aumenta durante el período de almacenamiento de los frutos secos. Esto indica un deterioro creciente del aceite contenido en ellos a medida que transcurre el tiempo. El Reglamento Bromatológico Nacional establece que los aceites comestibles refinados no son aptos para el consumo cuando tienen un índice de peróxidos superior a 10 meq O2/kg de aceite (Uruguay. Ministerio de Salud Pública, 1994). Considerando el valor anteriormente mencionado, todos los aceites extraídos de los frutos secos cumplen con esta normativa en el mes 1. El único aceite que mantiene un índice de peróxidos por debajo de 10 meq O2/kg durante todo el estudio es el de almendras. En general, para todos los frutos secos el contenido de tocoferoles totales presente en los aceites de los mismos disminuye apreciablemente durante los meses de almacenamiento. Esto mostraría una relación inversa con el índice de peróxidos a lo largo de los meses de almacenamiento. Es claro en el caso del aceite de nuez, en el cual el índice de peróxidos al final del estudio se duplica respecto al inicial, mientras que el contenido de tocoferoles se reduce a la mitad aproximadamente, siendo este aceite el que presenta mayor disminución al final del estudio (mes 6).
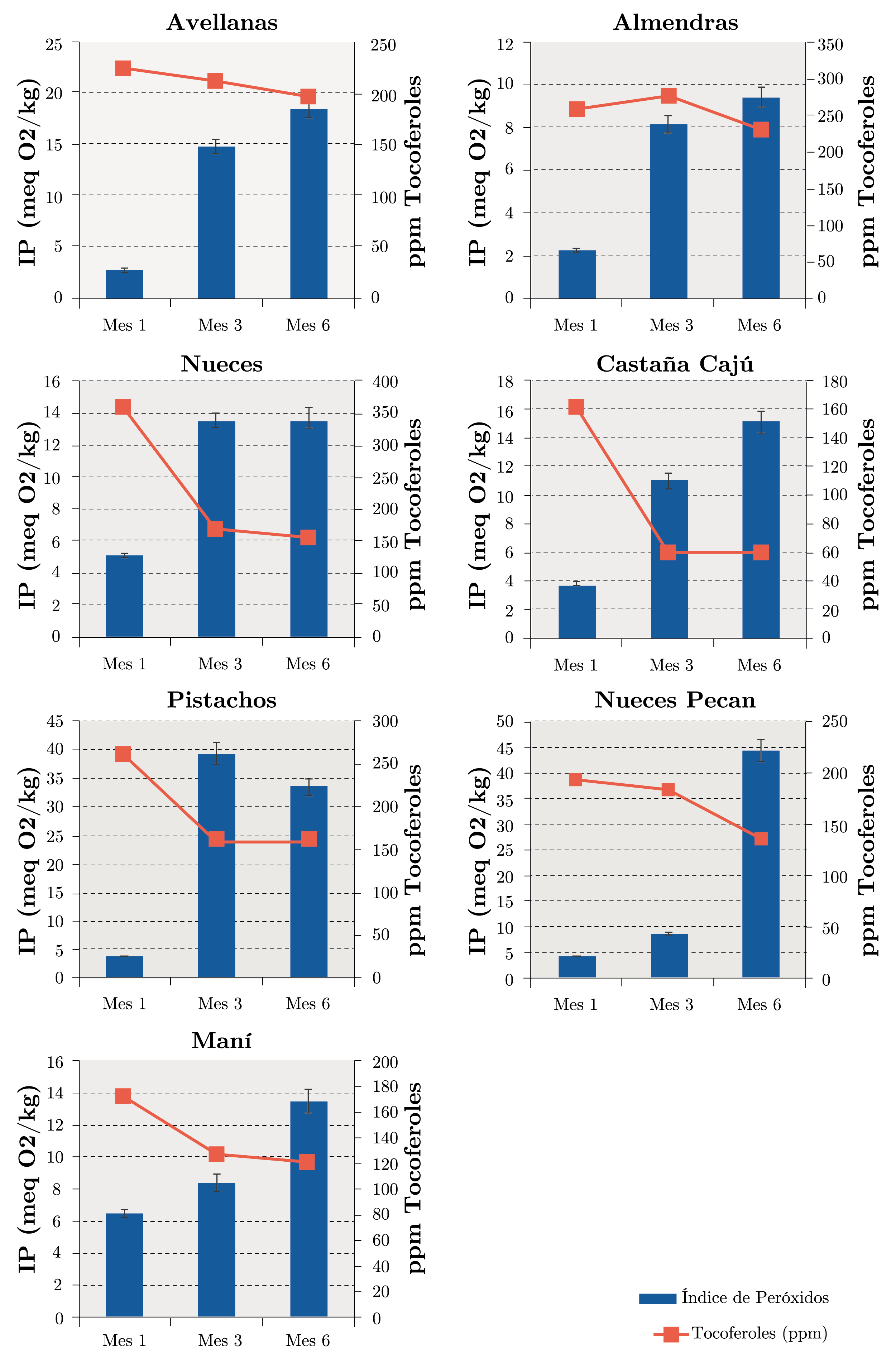
Figura 6. Índice de peróxidos y contenido de tocoferoles totales durante los meses de almacenamiento para los aceites de los diferentes frutos secos.
Determinación del contenido de polifenoles y tocoferoles en maníes antes y después de diferentes procesos de cocción: un gran número de frutos secos es consumido luego de un proceso de tostado. Esta es una forma de procesamiento que puede originar cambios en los componentes, la textura, el color, el sabor y la apariencia, según el grado de tostado de los productos; pero fundamentalmente se puede ver afectado el contenido de antioxidantes naturales presentes. Por lo tanto, resulta de interés la extracción y cuantificación de polifenoles y tocoferoles presentes antes y después de su cocción para evaluar cómo afecta al contenido en antioxidantes naturales.
De acuerdo con la Figura 7, el contenido de polifenoles en los maníes con piel sin tratamiento de cocción fue de 480 ppm, mientras que en la piel y en la cáscara el contenido fue de 732 y 138 ppm, respectivamente. En consecuencia, la presencia tanto de la piel como de la cáscara ofrecen un contenido adicional de antioxidantes que contribuye a enlentecer los procesos de oxidación del aceite presente en el maní. Locatelli y otros (2010) señalan que la piel y la cáscara de frutas, vegetales y semillas pueden contribuir en su protección contra los procesos oxidativos. Locatelli y otros (2010) afirman también que la cáscara es una barrera de defensa clave en las semillas de las plantas y que además la mayoría contiene polifenoles y taninos. Por lo tanto, los resultados del presente estudio coinciden con lo esperado según lo anteriormente citado.
Cuando los maníes enteros son calentados en un horno de convección, se puede observar que el contenido de polifenoles disminuye en el maní sin piel (323 ppm) y en la cáscara (64 ppm). Sin embargo, en la piel se observa un incremento (1878 ppm). Resultados similares (pero con menor efecto del tratamiento de calentamiento respecto a los resultados obtenidos sin tratamiento de cocción) se observan cuando el proceso de calentamiento se realiza en un horno de microondas: el contenido de polifenoles en la piel fue de 1066 ppm, mientras que en el maní sin piel y en la cáscara el contenido fue de 462 y 106 ppm, respectivamente.
Chandrasekara y Shahidi (2011) presentaron resultados con una tendencia similar, con procesos de cocción a baja temperatura (70ºC, 6 horas) y alta temperatura (130ºC, 33 minutos) para castañas de cajú, donde encontraron un aumento en la concentración de los compuestos fenólicos y de las propiedades antioxidantes en la semilla y en la piel. Las concentraciones de polifenoles totales en la piel y semilla crudas fueron 269 y 0.1 mg GAE/g, respectivamente; mientras que en tostadas a baja temperatura el contenido de polifenoles totales fue de 309 en piel y 0.5 mg GAE/g en semilla. Cuando la piel y semilla se tostaron a alta temperatura, los valores obtenidos fueron 348 y 0.5 mg GAE/g, respectivamente (Chandrasekara y Shahidi, 2011). En dicha investigación se muestra, por tanto, que el procesamiento térmico aumenta el contenido de polifenoles totales de la piel y la semilla. Estos aumentos se atribuyen a que el proceso de tostado ayudaría a la liberación de compuestos fenólicos, los que tienen mayor solubilidad en el solvente de extracción (etanol). Además, dado que la piel y la semilla de castañas contienen proteínas y azúcares, es posible el desarrollo de la reacción de Maillard durante el tostado con la formación de compuestos que contribuyen al contenido de polifenoles totales y a la actividad antioxidante (Chandrasekara y Shahidi, 2011). Los autores resaltan que las capas externas como la piel o cáscara de extractos vegetales contienen mayores concentraciones de compuestos fenólicos, dado que actúan como agentes de defensa contra patógenos, parásitos, entre otros, y contribuyen al color de las plantas. Además, sus estudios muestran que el procesado térmico aumenta el contenido de polifenoles totales en piel y semilla. Los resultados mostrados están en concordancia con estudios similares realizados con otro tipo de frutos secos como maní y avellanas (Yu, et al., 2005, Locatelli, et al., 2010) y en la revisión realizada por Chang y otros (2016). Estudios complementarios deberían realizarse para comprender los mecanismos físicos y/o bioquímicos de estos cambios producidos durante el calentamiento de los frutos secos.
Respecto al contenido de tocoferoles totales (Figura 8), el contenido en los maníes con piel sin tratamiento de cocción fue de 83 ppm. En los extractos obtenidos de la piel y la cáscara, el contenido fue de 132 y 103 ppm, respectivamente. Se observa que cuando los maníes enteros son calentados, ya sea en un horno de convección o en un horno de microondas, el contenido total de tocoferoles disminuye en la cáscara a valores de 46 y 89 ppm, respectivamente. Al igual que en la determinación del contenido de polifenoles, el efecto es más pronunciado en el calentamiento a 180ºC por un período de tiempo más extenso. En cambio, en la piel se observa un aumento en el contenido de tocoferoles (como en el caso de los polifenoles), alcanzando valores de 160 y 222 ppm para la cocción en horno de convección y de microondas, respectivamente. Por tanto, la piel de los maníes resulta una fuente rica en compuestos fenólicos y tocoferoles, los cuales ayudan a proteger al maní de los procesos oxidativos.
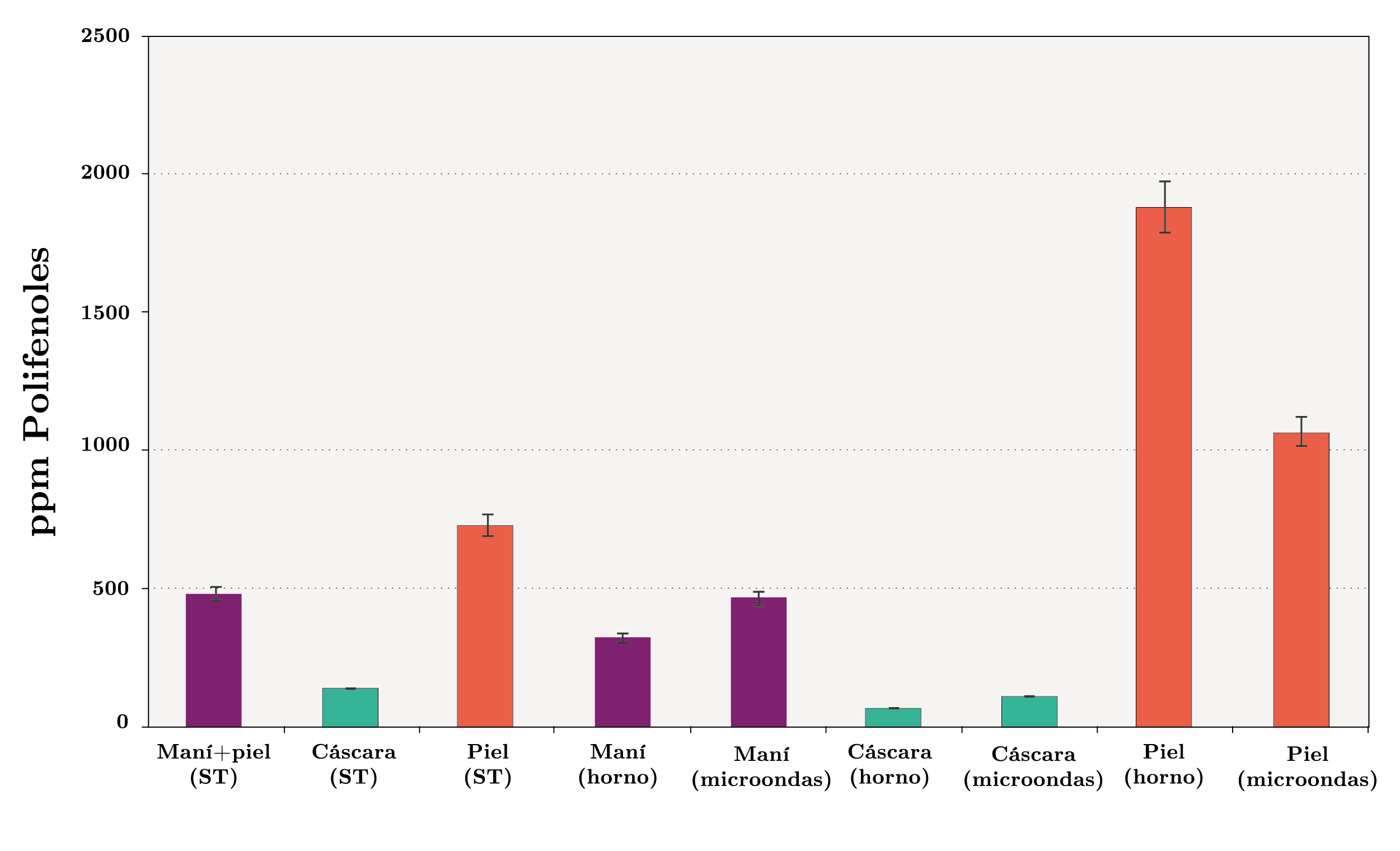
Figura 7. Contenido de polifenoles totales (ppm) en los maníes, en la cáscara de los maníes y en la piel de los maníes, sin tratamiento de cocción (ST), con cocción en horno de convección y con cocción en horno de microondas.
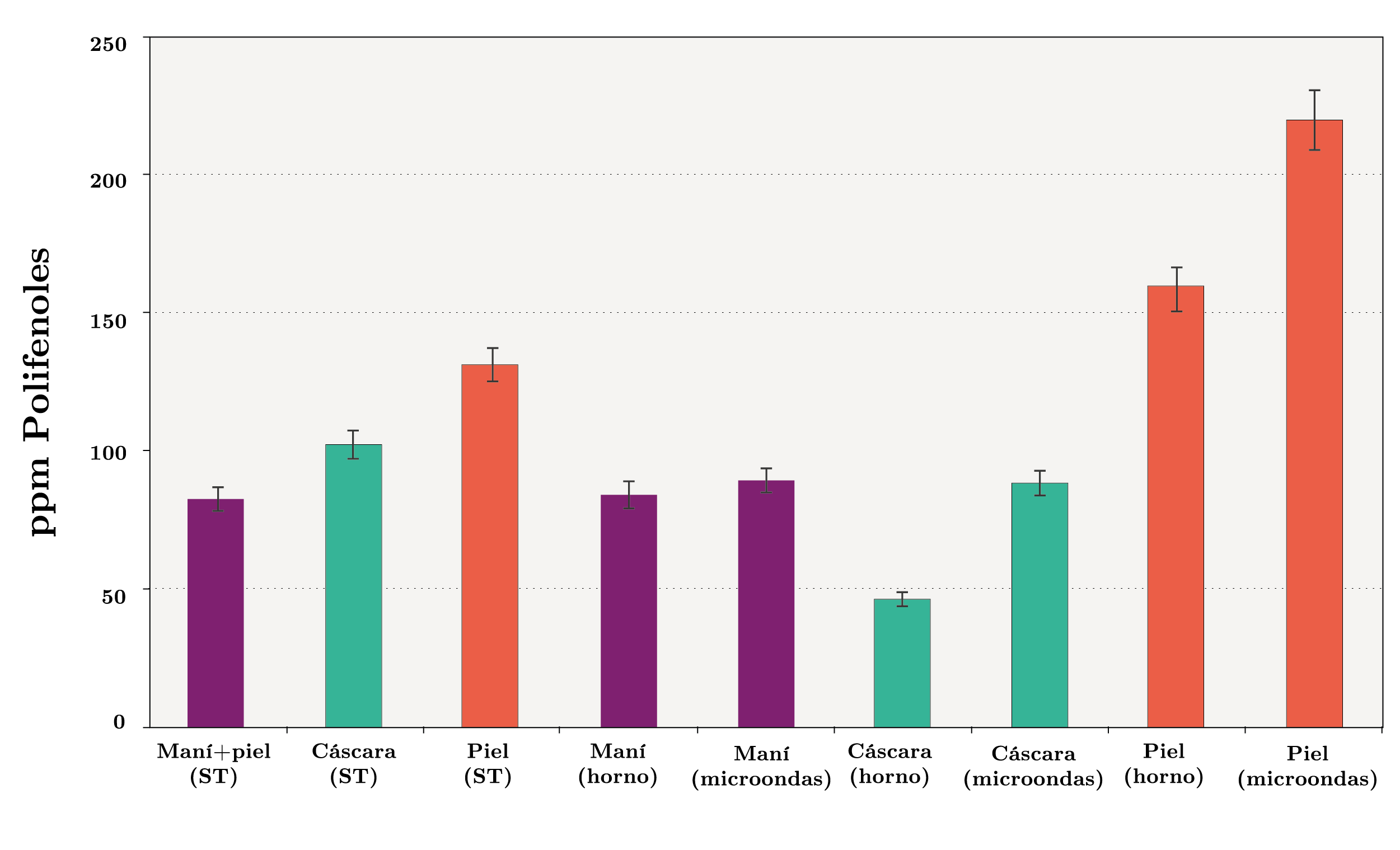
Figura 8. Contenido de polifenoles totales (ppm) en los maníes, en la cáscara de los maníes y en la piel de los maníes, sin tratamiento de cocción (ST), con cocción en horno de convección y con cocción en horno de microondas.
Conclusiones
Los resultados obtenidos demuestran que los frutos secos analizados son una fuente rica de lípidos que contienen ácidos grasos insaturados y antioxidantes naturales. Entre los frutos secos analizados (almendras, avellanas, castañas de cajú, maní, nueces, nueces pecan y pistachos), la nuez pecan fue la que presentó mayor porcentaje de lípidos. Desde el punto de vista nutricional, es interesante identificar los ácidos grasos poliinsaturados debido a sus conocidos efectos sobre el control del colesterol, entre otros. Así, los resultados muestran que en todos los aceites, a excepción del aceite de nuez, el ácido graso predominante es el ácido oleico. Los aceites de nuez pecan y maní contienen cantidades similares de ácido oleico y ácido linoleico, mientras que en las nueces el ácido graso predominante es el linoleico.
Desde el punto de vista de los antioxidantes, se concluye que el extracto de nuez resultó ser el más concentrado en polifenoles totales, seguido del extracto de avellana y nuez pecan. En cuanto a los tocoferoles totales, también el extracto de nuez resultó ser el más concentrado, seguido del de pistachos y almendras. Por lo tanto, entre los frutos secos estudiados el más atractivo es la nuez, dada su composición rica en ácidos grasos poliinsaturados y antioxidantes naturales (polifenoles y tocoferoles). De acuerdo con los resultados presentados en el presente estudio, estos antioxidantes naturales protegerían al fruto de las reacciones de oxidación, aunque sería necesario realizar estudios adicionales que permitieran verificar que su consumo, en dosis establecidas, genera los mismos beneficios en el consumidor tras su ingesta.
El estudio de la estabilidad de los aceites extraídos de los frutos secos almacenados muestra que el índice de peróxidos aumentó durante el tiempo de almacenamiento, y evidencia el avance de la oxidación primaria de los aceites (el aceite de almendras fue el único aceite que mantuvo un índice de peróxidos por debajo de 10 meq O2/kg durante todo el estudio). En cambio, el contenido de tocoferoles disminuyó en general para todos los frutos secos.
El estudio realizado sobre maníes muestra, por un lado, que el contenido de polifenoles y tocoferoles fue superior en la piel que en el fruto y en la cáscara. Aunque la cáscara presentó menor concentración de antioxidantes naturales que el fruto, también actuaría de barrera para los procesos oxidativos gracias a la presencia de estos antioxidantes. Por otra parte, las distintas formas de tostado analizadas en los maníes (horno con convección y horno microondas) determinaron que el contenido de polifenoles y tocoferoles disminuyera en el fruto y en la cáscara con respecto al producto sin cocción; mientras que el contenido en la piel se incrementó luego del procesamiento. Esto podría determinar que si se pretende dar utilidad a la piel de los maníes, los cuales generalmente son comercializados pelados, sería interesante realizar un tratamiento de tostado previo a la extracción de los antioxidantes para aumentar el porcentaje de recuperación. En cambio, si se pretende aumentar el consumo de maní en la dieta por sus propiedades beneficiosas, sería más recomendable ingerirlos con piel debido a una mayor concentración de antioxidantes naturales en la misma.
