Autores
- BADAGIAN BAHARIAN, NATALIA (1); LETAMENDIA, MAITE (2); PIREZ, MACARENA (3); CARNEVIA, DANIEL (2); BRENA, BEATRIZ (1).
-
(1) ÁREA BIOQUÍMICA, DEPARTAMENTO DE BIOCIENCIAS, FACULTAD DE QUÍMICA, UNIVERSIDAD DE LA REPÚBLICA, URUGUAY.
(2) ÁREA ACUICULTURA Y PATOLOGÍA DE ORGANISMOS ACUÁTICOS, FACULTAD DE VETERINARIA, UNIVERSIDAD DE LA REPÚBLICA, URUGUAY.
(3) ÁREA INMUNOLOGÍA, DEPARTAMENTO DE BIOCIENCIAS, FACULTAD DE QUÍMICA, UNIVERSIDAD DE LA REPÚBLICA, URUGUAY.
La alta incidencia de floraciones de cianobacterias productoras de microcistinas en el país y la región representa un riesgo muy elevado para humanos y animales. A fin de estudiar el impacto y la presencia de las microcistinas (MCs) en animales, es importante disponer de métodos simples de bajo costo. Como primera aproximación a estos objetivos en peces, se estudiaron Astraloheros facetus (Castañetas) expuestas a una floración de Microcystis spp (MCs 60 y 600 µgMCs/L) en un bioensayo subcrónico (18 días). Si bien no hubo mortalidad, la histopatología mostró infiltración grasa en el hígado, más relevante en los peces expuestos a la mayor concentración. Para analizar MCs en pescados se optimizaron dos métodos inmunoquímicos sensibles basados en un anticuerpo recombinante de llama (nanobody) de alta especificidad: ELISA y MALDI-TOF cuantitativo, utilizando partículas magnéticas funcionalizadas. Los métodos fueron recientemente desarrollados localmente. La excelente correlación ELISA/MALDI-TOF (rSpearman = 0,988, p< 10-7) resalta el potencial de este ELISA como herramienta simple y costo-efectiva para minimizar las muestras a analizar por métodos de referencia. Las concentraciones de MCs en las Castañetas fueron relevantes, acordes con bioensayos en otras especies y peces de la naturaleza. Esto destaca la importancia de analizar MCs en pescado para consumo.
PALABRAS CLAVES: cianobacterias, cianotoxinas, inmunoensayos.
A alta incidência de florações de cianobactérias produtoras de microcistinas no país e na região representa um risco muito elevado para humanos e animais. Para avaliar o impacto e a presença de microcistinas (MCs) em animais, é importante dispor de métodos simples e de baixo custo. Como primeira aproximação a esses objetivos em peixes, Astraloheros facetus (Castañetas), expostos a uma floração de Microcystis spp, contendo microcistinas (60 e 600 µgMCs/L), foram estudados em um bioensaio subcrônico (18 dias). Embora não houve mortalidade, a histopatologia mostrou alteração tipo infiltração gordurosa no fígado, mais relevante em peixes expostos à maior concentração. Para a análise de microcistinas em tecidos, dois métodos imunoquímicos sensíveis, recentemente desenvolvidos localmente, baseados em um anticorpo de chama recombinante altamente específico (nanobody) foram otimizados: ELISA e MALDI-TOF quantitativo, usando partículas magnéticas funcionalizadas. A excelente correlação ELISA / MALDI-TOF (rSpearman = 0,988, p < 10-7) destaca o potencial desse ELISA como uma ferramenta simples e econômica, para minimizar as amostras a serem analisadas por métodos de referência. As concentrações de MCs no tecido de Castañetas foram relevantes, de acordo com bioensaios em outras espécies e peixes da natureza. Isso destaca a importância da análise de MCs em peixes para consumo.
PALAVRAS CHAVE: cianobatérias, ciantoxinas, imunoensaios.
Introducción
En Uruguay, numerosos ecosistemas acuáticos se encuentran eutrofizados y están afectados por floraciones de cianobacterias tóxicas (Chalar, 2009; Aubriot, et al., 2011; Bonilla, et al., 2015). La frecuencia e intensidad de estas floraciones han aumentado en todo el mundo (Huisman, et al., 2018) y en los últimos años se ha observado un crecimiento notorio en los principales cuerpos de agua del país y la región.
En el verano de 2019, las floraciones de los embalses del Río Negro y del Río Uruguay fueron transportadas aguas abajo por los caudales extremos producidos por las intensas lluvias, de forma que alcanzaron todo el Río de la Plata y llegaron incluso a las costas de Rocha (Kruk, et al., 2019). Esto generó alarma y afectó fuertemente el uso recreativo de las playas durante el verano. Las principales causas de estas floraciones, tales como el aporte de nutrientes a los cursos de agua derivados de la intensificación agrícola y la falta de tratamiento de las aguas residuales domésticas e industriales, no son fácilmente reversibles a pesar de las iniciativas para corregirlas (Uruguay, 2019). Dado que no se pueden esperar mejoras significativas en el corto plazo, es necesario implementar medidas de mitigación y adaptación que permitan proteger a la población de los riesgos asociados a estas floraciones.
Las microcistinas (MCs) son las toxinas de cianobacterias (cianotoxinas) encontradas más frecuentemente, tanto a nivel regional como global (Dörr, et al., 2010, Svirčev, et al., 2019); y son las que ocasionan la mayoría de los casos de intoxicación reportados (Chorus y Bartram, 1999; Meriluoto, et al., 2017; Svirčev, et al., 2017). En los principales cursos de agua y embalses del país, estas toxinas presentan concentraciones altamente variables (González-Piana, et al., 2017; González-Piana, et al., 2018), que pueden ser muy elevadas, especialmente en ambientes litorales y en playas del Río de la Plata. Las acumulaciones de espuma cianobacterianas pueden alcanzar valores máximos de 10.000 µg/L o más en temporada estival (González-Piana, et al., 2011; Pírez-Schirmer, et al., 2013; Bonilla, et al., 2015). Esto representa un riesgo muy alto para humanos y animales, ya sea por contacto directo o por consumo de agua y alimentos contaminados (Chorus, et al., 2000; Zanchett y Oliveira-Filho, 2013; Meriluoto, et al., 2017).
Las MCs son una familia de más de 240 heptapéptidos cíclicos hepatotóxicos (Figura 1) con diferente composición e isomerización de sus aminoácidos (Nieder-meyer, et al., 2014; Qi, et al., 2015; Spoof y Catherine, 2017). La microcistina LR (MC-LR), que presenta Lisina y Arginina en las posiciones 2 y 4 respectivamente, es la variante química más representativa de la familia debido a su alta toxicidad y ocurrencia. En base a un valor de ingesta diaria tolerable de 0,04 µg/kg por día, la Organización Mundial de la Salud (OMS) ha definido un valor guía de 1 µg/L para MC-LR en agua potable (Chorus y Bartram, 1999). Como la mayoría de las variantes son también tóxicas, en muchos países la normativa se refiere a equivalentes de MC-LR (Ibelings, et al., 2014), término que incluye a las diferentes variantes analizadas.
La elevada diversidad estructural de estas cianotoxinas implica la necesidad de utilizar métodos analíticos selectivos de alta performance, como la cromatografía líquida acoplada a espectrometría de masas en tándem (LC-MS/MS), que son de muy alto costo y complejidad (Meriluoto, et al., 2017; Flores, et al., 2018). Adicionalmente para la cuantificación se necesitan estándares de todas estas variantes químicas, de las cuales la mayoría no están disponibles comercialmente. En función de estas dificultades, diversos métodos sencillos alternativos, especialmente los inmunoensayos, han ganado amplia aceptación para el monitoreo en aguas (Zaffiro, et al., 2016). A nivel país, en los últimos años, el uso de inmunoensayos ha permitido un importante avance en cuanto a las posibilidades de monitoreo y a la disponibilidad de datos de cianotoxinas en cursos de agua (UNESCO, 2009; Bonilla, et al., 2015).
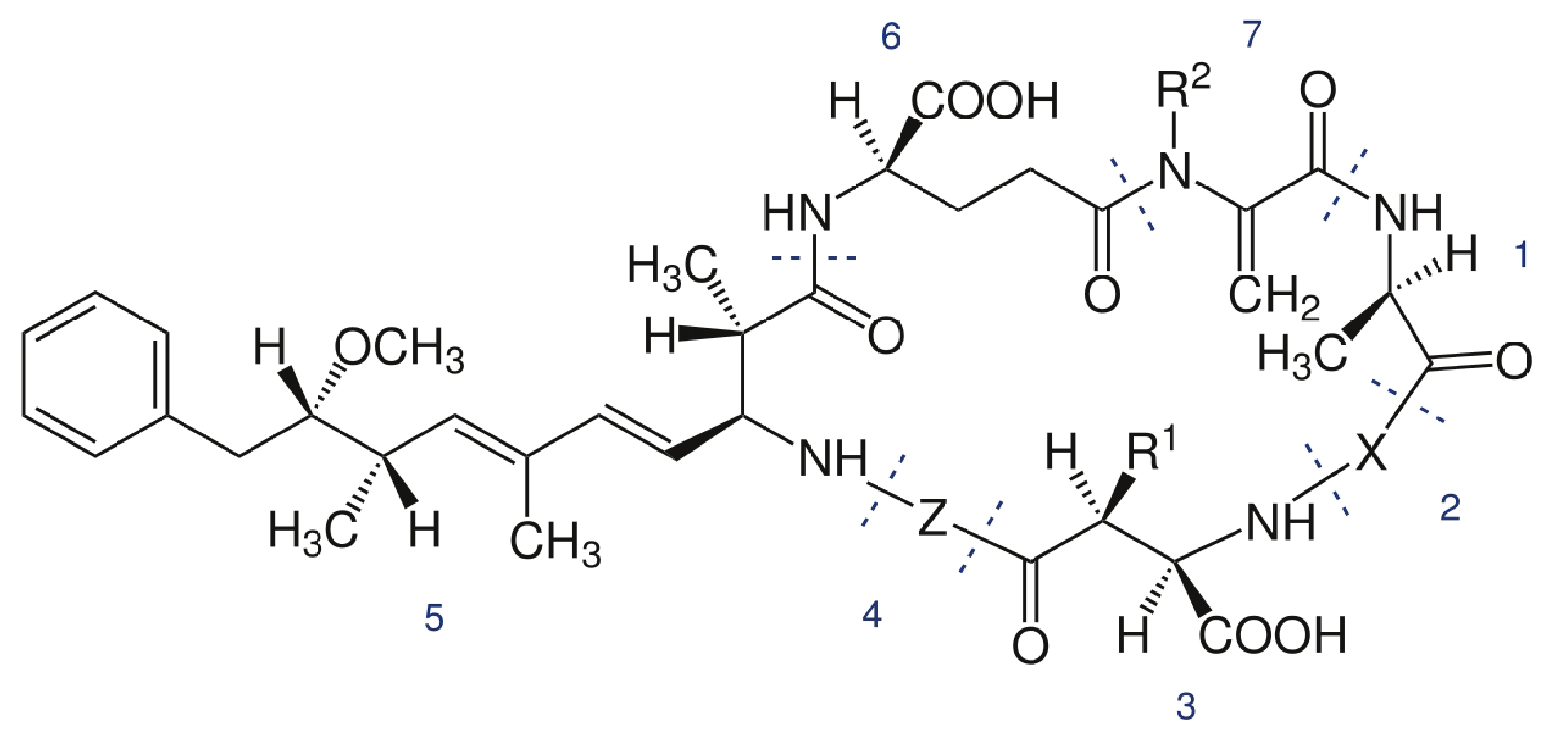
Figura 1. Estructura general de las microcistinas: Ciclo(-D-Ala1-LX2-D-MeAsp3-L-Z4-Adda5-D-Glu6-Mdha7); X y Z son L aminoácidos varios; D-MeAsp: D-eritro- β-ácido metilaspártico; Adda: ácido 3‐ami-no‐9‐metoxi‐2,6,8‐trimetill‐10‐fenildeca‐4,6‐dienoico; Mdha: N-etil-dehi-droalanina. MC-LR: X es Leucina y Z es Arginina.
Por otro lado, numerosos reportes a nivel internacional muestran que la ingesta de MCs a través de los alimentos (principalmente pescado) podría ser superior a la proveniente del consumo de agua potable (Ibelings, et al., 2014; Poste, et al., 2018) y algunos países han definido valores guía en alimentos (Ibelings, et al., 2014). En Uruguay y otros países en desarrollo, las dificultades de acceso a equipamientos de LC-MS/MS requeridos para el análisis en estas matrices (Merilouto, et al., 2017, pp.385-389) limitan las posibilidades de generar información sobre la concentración de estas toxinas en pescado.
Los inmunoensayos del tipo ELISA son sencillos, rápidos, no requieren equipamiento costoso, permiten detectar MC-LR y presentan alta reactividad cruzada con las variantes más frecuentes, por lo que son altamente utilizados como metodologías de monitoreo. Sin embargo, los inmunoensayos brindan una respuesta global sin identificar las variantes químicas presentes y pueden presentar problemas de efecto matriz, especialmente en matrices biológicas complejas (Flores, et al., 2018; Font, 2016). Por estas razones, además de su comparación con métodos analíticos de alta performance se requiere una cuidadosa evaluación de su desempeño en matrices biológicas. En base a la experiencia adquirida previamente en el análisis de aguas, se propone estudiar la aplicabilidad y el desempeño analítico de inmunoensayos que faciliten la determinación de MCs en peces y permitan evaluar el posible impacto en la salud humana y ecosistémica. Como primer paso hacia estos objetivos, en este trabajo se presentan los resultados del análisis de peces provenientes de un bioensayo subcrónico de exposición (18 días) en Astraloheros facetus (nv: Castañetas), utilizando una floración productora de MCs en concentraciones frecuentemente encontradas en nuestros cuerpos de agua en temporada estival. La concentración de MCs en los peces expuestos fue analizada por dos métodos inmunoquímicos, recientemente desarrollados en el país, que involucran la utilización de anticuerpos monoclonales recombinantes de llama (nanobodies): ELISA (Pírez-Schirmer, et al., 2017) y MALDI-TOF cuantitativo con pre-concentración en partículas magnéticas (Pírez-Schirmer, et al., 2019). Además se realizaron cortes histológicos de los peces para el estudio de los daños provocados por la exposición (histopatología).
Materiales y Métodos
Recolección y caracterización de la biomasa de cianobacterias para bioensayo
La biomasa de una floración del Río de la Plata del género Microcystis se concentró utilizando una malla de fitoplancton de 20 µm, y se conservó a -80°C en alícuotas de aproximadamente 60 g hasta su utilización. La identificación taxonómica mediante microscopía mostró la presencia de dos especies: M. aeruginosa y M. novacekii. Como estimación de la biomasa de cianobacterias se determinó Clorofila-a por espectrofotometría (American Public Health Association, American Water Works Association y Water Environment Federation, 2005). Las MCs se analizaron mediante un ELISA basado en anticuerpos policlonales (Pírez-Schirmer, et al., 2013). Las variantes de MCs presentes se identificaron por MALDI-TOF, utilizando espectrómetro de masas Microflex LRF (Bruker Daltonics, Billerica, MS, USA) con láser de nitrógeno a 337 nm, operado en modo positivo con reflector y extracción tardía, optimizado para péptidos en el rango de relación m/z 500Da – 2000 Da. El análisis se realizó con una intensidad del láser de 30%, el cual se disparó 100 veces en 10 posiciones diferentes de cada spot. La calibración del equipo se realizó con estándar para calibración de péptidos (Bruker Daltonics). La identificación de las relaciones m/z obtenidas se realizó comparando con las reportadas en la recopilación de Spoof y Catherine (2017).
Bioensayo Astraloheros facetus (Castañetas)
El diseño experimental del bioensayo tuvo como primer objetivo obtener muestras de un pez nativo expuesto en condiciones controladas, similares a las que pueden ocurrir en el ambiente natural, para la evaluación de nuevas metodologías de análisis de toxinas en sus tejidos. Se propuso a su vez, obtener datos preliminares de los daños histopatológicos y las concentraciones de toxinas que son incorporadas en los peces. Los peces fueron obtenidos de un mismo desove de la especie nativa Astraloheros facetus (nv: Castañetas), mantenida y cultivada en bioterio. El bioensayo se realizó en acuarios de 20 L, con temperatura, pH y oxígeno disuelto promedios de 21,7°C; 7,5 y 12,5 mg/L respectivamente. Los acuarios contaron con aireación, filtro biomecánico de esponja (RS-430K), y se simuló un fotoperiodo natural (12h luz:12h oscuridad). Los peces se alimentaron diariamente con alimento balanceado para peces en pellets (Aqua, Supra). Quince juveniles, de 34,5 - 41,4 mm de largo por acuario (total aproximadamente 17 g de peces), se expusieron durante 18 días a la biomasa caracterizada anteriormente. La exposición se realizó en dos condiciones: 0.75 g de la biomasa/litro de agua (tratamiento 1) y 7.5 g biomasa/litro de agua (tratamiento 2). El contenido de MCs en los tratamientos fue de aproximadamente 60 y 600 μg MCs/L, respectivamente. Las exposiciones se realizaron por duplicado y se incluyeron dos controles sin adicionar floración (6 acuarios en total). El día 10 se adicionó nuevamente biomasa a la misma concentración inicial.
La concentración de toxinas en el agua de cada uno de los acuarios se analizó por triplicado mediante ELISA policlonal, los días 1, 7, 10, 15 y 18. A tiempo final se sacrificaron los peces mediante sobredosis de anestésico (Eugenol) para estudio histopatológico y análisis de MCs. Se utilizaron las técnicas histopatológicas convencionales (inclusión en parafina, obtención de cortes seriados de 5 µm de espesor) con tinción de Hematoxilina y Eosina (H&E), y observación en microscopio óptico Olympus BX50. Se analizaron dos individuos por acuario (N= 4 por tratamiento).
Extracción de microcistinas de peces
Los peces provenientes de cada acuario se dividieron en dos submuestras de 6 peces cada una, se descabezaron y se homogeneizaron con trituradora. Fracciones de 1,7 g (pescado húmedo) de cada submuestra se extrajeron con 10 mL de una mezcla de acetonitrilo y agua (75:25 v/v) con 1% ácido fórmico. Los extractos se desgrasaron mediante partición líquido-líquido con hexano saturado en acetonitrilo (Geis-Asteggiante, et al., 2011), y el solvente se evaporó a 45 °C en un equipo Speedvac concentrator Thermo SPD1010-230. Los extractos se neutralizaron con 1 M Tris-base pH 10, y se completó el volumen hasta 10 mL con agua Milli-Q.
Con el fin de evaluar la recuperación, se realizaron dos fortificaciones de MC-LR en Castañetas blanco, no expuestas en el bioensayo, previas a la extracción de los tejidos y a un nivel de 10 ng MC-LR/g de pescado húmedo, valor guía de acción propuesto en California para MCs en pescado (Butler, et al., 2012, p.4).
Inmunoensayo utilizando anticuerpo monoclonal (nanobody)
Los extractos de Castañetas se analizaron mediante un ELISA, con el anticuerpo monoclonal de llama (nanobody), como se describe en Pírez-Schirmer y otros (2017) (clon A2.3). El nanobody se produjo recombinante en Escherichia coli (E. coli), biotinilado in vivo para facilitar su detección con un conjugado estreptavidina-peroxidasa (Thermo). Se utilizaron placas recubiertas con 100 μL/pocillo de una solución de 60 μg/L de conjugado MC-LR- seroalbúmina bovina (MC-LR-BSA) en buffer fosfato salino (PBS), bloqueadas con gelatina al 0,5% en PBS. El análisis se realizó por triplicado con 50 μL de la muestra o estándares previamente mezclados en placa de dilución, con 11 μL de Tris 1 M, NaCl 0,27 M, EDTA disódico 0,27 M, BSA 1% a pH 7,5 (Buffer interferencia o BI). Las muestras y estándares preincubados se sembraron en la placa de ELISA y se agregó una solución 7 μg/L de nanobody. Luego de la incubación y etapas de lavados, la detección se realizó con estreptavidina-peroxidasa y posteriormente se agregó solución conteniendo sustrato de la enzima peroxidasa H2O2 y 3,3’,5,5’-Tetramethylbenzidine (TMB) en buffer acetato pH 5,5. Las curvas de calibración se realizaron con MC-LR en el rango de concentraciones: 0,1 - 5,0 μg/L en PBS. Se grafica el porcentaje de absorbancia de cada estándar respecto al cero (%A/Ao) versus la concentración de MC-LR, utilizando ajuste sigmoidal 4PL del software GraphPad Prism 7.
Previo a la realización del bioensayo, se evaluó el efecto matriz mediante curvas de adición en extractos de Castañetas blanco (no expuestas en el bioensayo), en todo el rango de trabajo (10 concentraciones de MC-LR entre 0,1 y 5,0 μg/L de extracto). En este caso, los análisis se realizaron por cuatriplicado (cada día) y en cuatro días. Se evaluaron las siguientes cifras de mérito: veracidad (recuperación utilizando curvas de calibración en PBS) y precisión intra e inter-ensayo. Los criterios de desempeño analítico de referencia seleccionados fueron los siguientes: recuperaciones en el rango 70-120% y coeficiente de variación (CV) menor que 20% (Meriluoto, et al., 2017, pp.249-251). El límite de cuantificación (LC) se consideró como la mínima concentración en la cual se cumplen estos criterios. Los parámetros de las curvas del ensayo (A0; IC50) en matriz Castañeta y en PBS se compararon utilizando el test extra sum-of-squares F del software Graph Pad Prism 7.0.
Método cuantitativo mediante MALDI-TOF
Se utilizó un método MALDI-TOF cuantitativo ultrasensible (Pírez-Schirmer, et al., 2019). Las MCs de la muestra o estándares se capturaron y concentraron en partículas magnéticas (MagnaBind Streptavidin Beads, Thermo Fischer), conteniendo el nanobody anti-MC inmovilizado y un estándar interno (IS: MC-YR modificado con β-mercaptoetanol), el cual posibilitó la cuantificación. Un volumen de 1 mL de estándares y muestras de extracto de Castañetas (dilución 1/4 o superior en PBS conteniendo 0.2 % BSA, en caso de muestras fuera del rango del ensayo) se incubaron con 5 µL de las partículas durante 15 minutos, se realizaron 2 lavados con PBS-Tween 0,1% y 2 lavados con Agua-Tween 0,002%. Las partículas se resuspendieron en 10 µL de una solución 50% ACN – 50% (0,1% ácido trifluoroacético en H2O), y luego se adicionó 10 µL de matriz para MALDI (Ácido α-cyano-4-hidroxicinámico, CHCA). En estas condiciones la captura permite, además de la purificación del extracto, un factor de concentración de 12,5 veces. Las partículas magnéticas fueron sembradas directamente en la placa de MALDI por triplicado y se dejó secar a temperatura ambiente. El análisis se realizó en un equipo Microflex LRF MALDI-TOF MS (Bruker Daltonics) operado en modo positivo con reflector y extracción tardía usando un láser de nitrógeno de 337 nm. El instrumento fue optimizado en el rango de relación m/z 500 Da-2000 Da, y el láser (intensidad 50%) se disparó 250 veces en 8 lugares individuales por spot (2000 shots por spot).
Las curvas de calibración (0,025- 1,0 μg MC-LR/L) y las muestras se analizaron por triplicado, graficando el cociente entre la intensidad del ion correspondiente a la relación m/z de cada MC individual encontrada y del IS.
La evaluación del desempeño del método se realizó utilizando los mismos criterios mencionados anteriormente (Meriluoto, et al., 2017, pp.249-251). Se realizaron adiciones de MC-LR en extracto de Castañetas blanco, no expuestas en el bioensayo (dilución 1/4 del extracto), en tres días, a concentraciones de 0,025, 0,05 y 0,5 µg/L.
Resultados
Bioensayo
La concentración de MCs en la biomasa de cianobacterias utilizada, determinada mediante ELISA, fue 67 mg MCs/Kg y la Clorofila-a 49 mg/Kg. Esta relación MCs/clorofila corresponde a una floración de alta toxicidad (Chorus y Bartram, 1999). En el espectro de MALDI-TOF obtenido para la biomasa (Figura 2), se observa un pico de alta intensidad con relación m/z correspondiente a MC-LR y dos de menor intensidad con relaciones m/z que pueden corresponder a [d-Leu1] MC‐LR y MC-RR, entre otras.
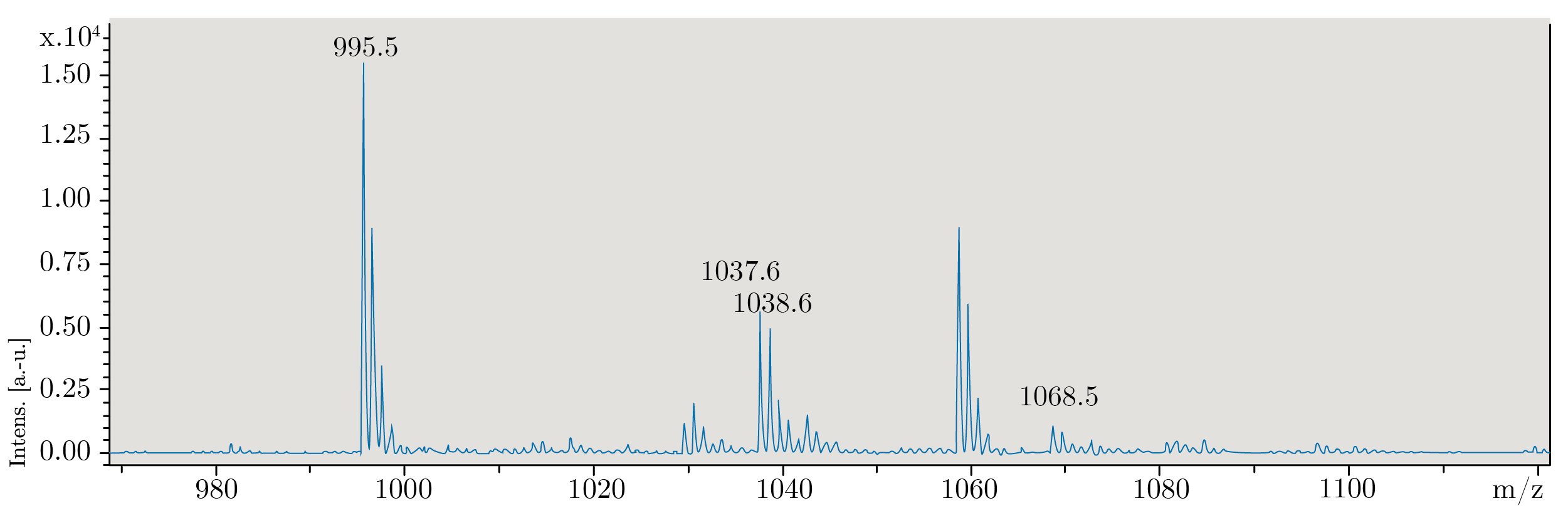
Figura 2. Espectro de MALDI-TOF de la biomasa de cianobacterias utilizada en el bioensayo. (relación m/z según Meriluoto y otros 2017: MC-LR 995,6; [d‐Leu1]MC‐LR 1037,6; MC-RR 1038,6; MC-WR 1068,6).
El análisis de MCs del agua de los acuarios mostró que en el día 7 los valores disminuyeron a menos del 2% de la concentración inicial. Para simular una situación ambiental frecuente de reincidencia de las floraciones, el día 10 se reaplicó nuevamente la biomasa a la misma concentración inicial. La concentración de MCs dispersa en los acuarios volvió a decaer rápidamente, y al final del bioensayo (día 18), la concentración residual fue menor al 1% de la obtenida luego de la reaplicación. Las Castañetas sobrevivieron en el transcurso del bioensayo subcrónico en todas las concentraciones de exposición.
Histopatología
En los controles se observó una estructura normal de los principales órganos estudiados: hígado, riñón y tubo digestivo. Se detectó solamente en branquias la presencia de leve edema en las laminillas branquiales.
En los peces expuestos al tratamiento 1 (0,75 g biomasa/L de agua) se observó una alteración de tipo infiltración grasa en la mayor parte del hígado, con algunas zonas de degeneración grasa macrovesicular. Los hepatocitos aumentaron de tamaño con las vacuolas lipídicas intracitoplasmáticas, adquirieron una forma redondeada y desplazaron el núcleo hacia la periferia, otorgando en su conjunto una coloración más pálida (Figura 3). En los peces expuestos al tratamiento 2 (7,5 g biomasa/ L de agua), se observó que esta alteración a nivel hepático fue más intensa, con predominio de degeneración grasa macrovesicular y zonas con escasos núcleos picnóticos. (Figura 3).
Las alteraciones observadas a nivel hepático, compatibles con degeneración grasa, han sido descriptas por Preeti y otros (2016) y Acuña y otros (2020), como resultado de la exposición a floraciones conteniendo MCs. En tanto numerosos autores tales como Li y Xie, (2009), Prieto y otros (2008), Le Manach y otros (2018), reportan alteración de la estructura de cordones de hepatocitos con aumento del espacio intercelular, degeneración y necrosis coagulativa.
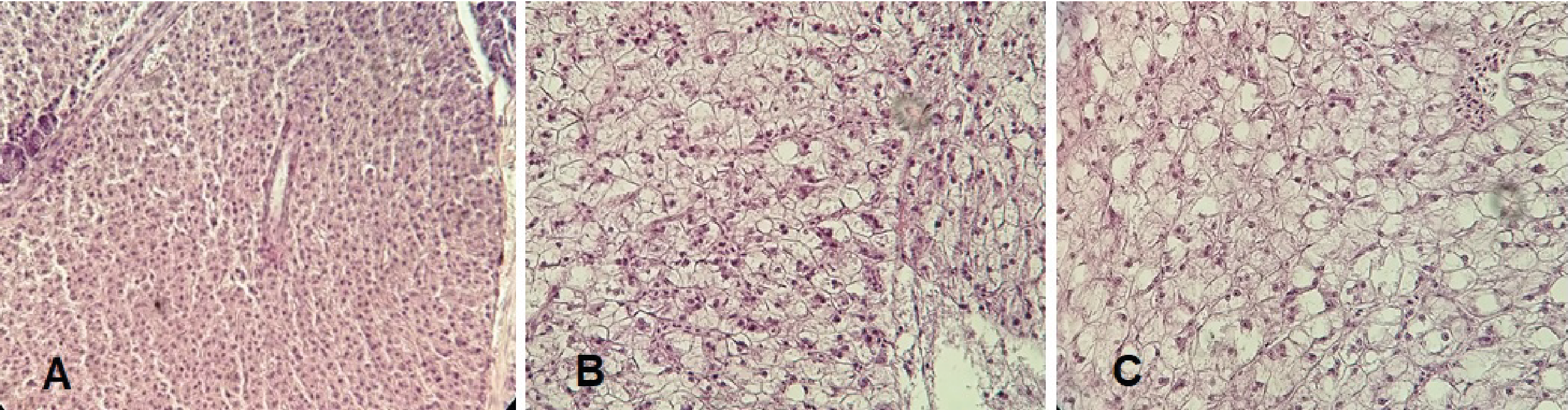
Figura 3. Alteraciones hepáticas en Castañetas expuestas a dos concentracionesde microcistinas. A: Grupo Control, B: Tratamiento 1, C: Tratamiento 2. H&E a 400X. N= 4 por tratamiento.
Evaluación del desempeño analítico de métodos para la determinación de microcistinas en peces
ELISA
En experimentos previos, se observó que el ELISA policlonal presenta un importante efecto matriz en extractos de tejidos de peces (datos no reportados), por lo que en este trabajo se utilizó el ensayo basado en un anticuerpo monoclonal de llama (nanobody). En la Figura 4 se reporta el estudio de efecto matriz en extracto de Castañeta adicionado con MC-LR (0.1-5 µg/L de extracto). Se observa que las curvas de adición del ELISA monoclonal en PBS y matriz de pescado no presentaron diferencias significativas de ajuste (A0 =103 y 94, IC50=0,47 y 0,56 respectivamente; pvalor=0,2146).
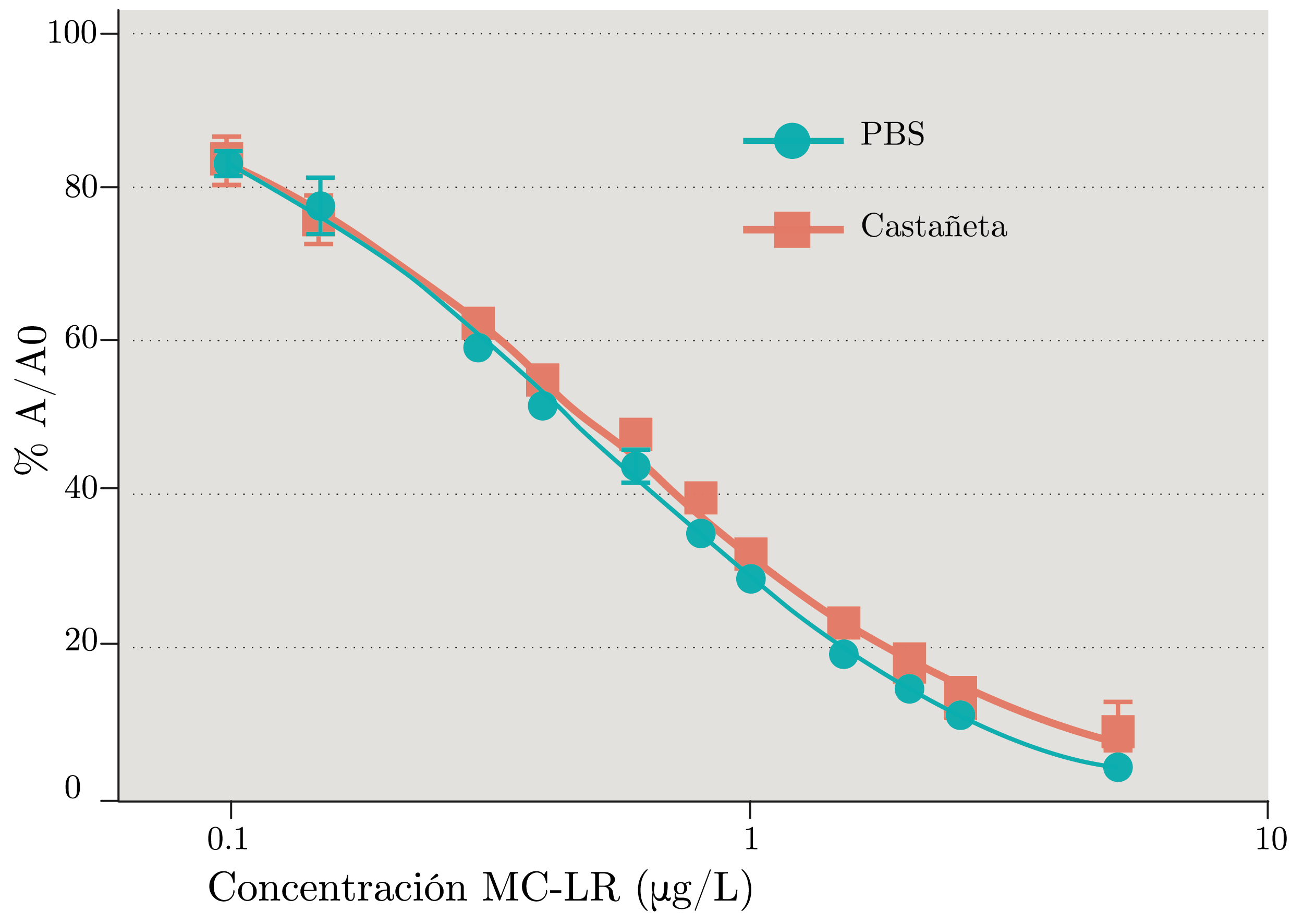
Figura 4. Curvas de adición de MC-LR en matriz extracto de Castañeta y buffer salino PBS, analizados por cuatriplicado.
En la Tabla 1 se presentan los resultados de recuperación y precisión de las adiciones en matriz (extracto de Castañeta blanco), analizadas utilizando la curva de PBS, en todo el rango estudiado, obtenidos en un período de 4 días. En esta matriz, el rango del ensayo que cumple con los criterios analíticos establecidos (recuperación 70-120%, CV < 20%) fue de 0,15 - 5 μg MCs/L. En tanto, el límite de cuantificación del método (LC), fue de 0,15 μg/L (0,9 ng/g pescado húmedo). Los niveles de recuperación de MC-LR en extracto de Castañeta fortificado a un nivel de 10 ng/g pescado húmedo se encontraron en el rango 46%-86%. Estos valores concuerdan con los antecedentes ya reportados (Meriluoto, et al., 2017, pp. 360).
Tabla 1. Recuperación (%) y precisión (CV%) de adiciones en el rango 0,1 - 5 µg MC-LR/L de extracto de Castañeta blanco. Análisis realizados por cuatriplicado cada día, en un período de 4 días.

MALDI-TOF cuantitativo
En la Tabla 2 se presentan los resultados de recuperación y precisión en matriz de extracto de Castañeta blanco (dilución 1/4), analizado por MALDI-TOF cuantitativo, para las tres concentraciones adicionadas dentro del rango de trabajo. La dilución del extracto fue necesaria para lograr la formación de un buen pellets de las partículas. El límite de cuantificación fue 0,025 μg/L de dilución de extracto (0,6 ng/g pescado húmedo).
Tabla 2. Recuperación (%) y precisión (CV%) de adiciones en extractos de Castañeta blanco (dilución 1/4). Análisis realizados en triplicado cada día, en un período de tres días.

Concentración de microcistinas en Australoheros facetus
Las concentraciones de MCs en las Castañetas del bioensayo, analizadas mediante el ELISA monoclonal, se muestran en la Tabla 3. La mediana de los peces expuestos al tratamiento 1 fue de 7,2 ng MCs/g pescado húmedo y al tratamiento 2 fue de 9,2 ng MCs/g pescado húmedo. Se observó una alta variabilidad en los resultados entre muestras de acuarios con las mismas condiciones de exposición.
Tabla 3. Concentración de MCs en Castañetas expuestas en el bioensayo analizadas por ELISA monoclonal. Se presentan los datos de mediana, mínimo y máximo para las cuatro submuestras de cada tratamiento. Se analizaron dos submuestras de cada acuario por triplicado.

Análisis de muestras por MALDI-TOF cuantitativo
En los extractos de los peces se observaron solamente dos picos (Figura 5), que corresponden a las relaciones m/z de los iones [M+H]+: MC-LR (m/z 995,5) y [L-MeLan] MC-LR (conjugado de MC-LR y cisteína, m/z 1116,6). El pico de MC-LR prevaleció ampliamente sobre el conjugado en todas las muestras analizadas.
Este conjugado con cisteína representa un metabolito de detoxificación en animales, de menor toxicidad que la toxina libre (Schmidt, et al., 2014; Li, et al., 2014).
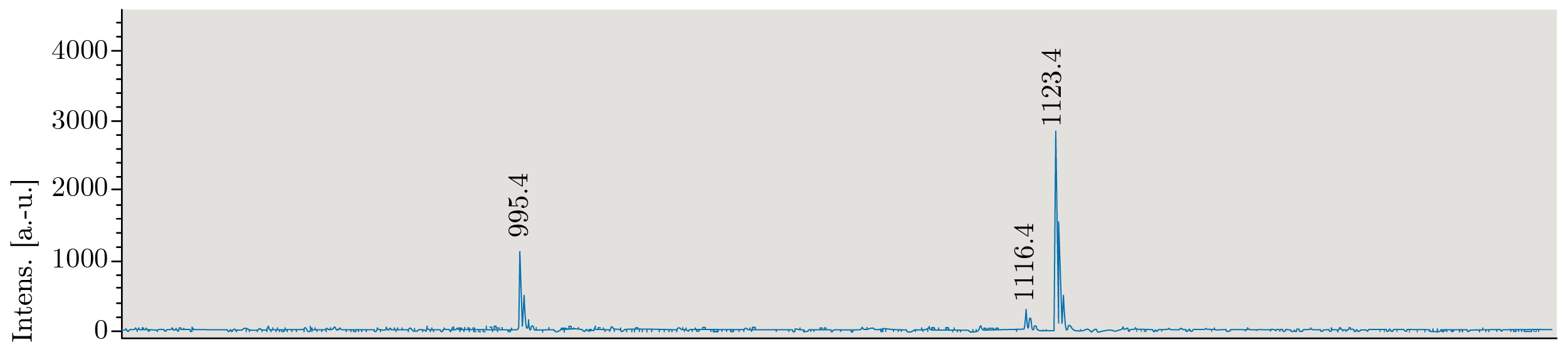
Figura 5. Espectro de MALDI-TOF cuantitativo para Castañetas expuestas altratamiento 1 durante bioensayo de exposición a floración de cianobacterias. La relación m/z de 1123 corresponde al estándar interno. MC-LR: m/z 995.6; [L‐MeLan7]MC‐LR: m/z 1116.6 según Meriluoto y otros (2017).
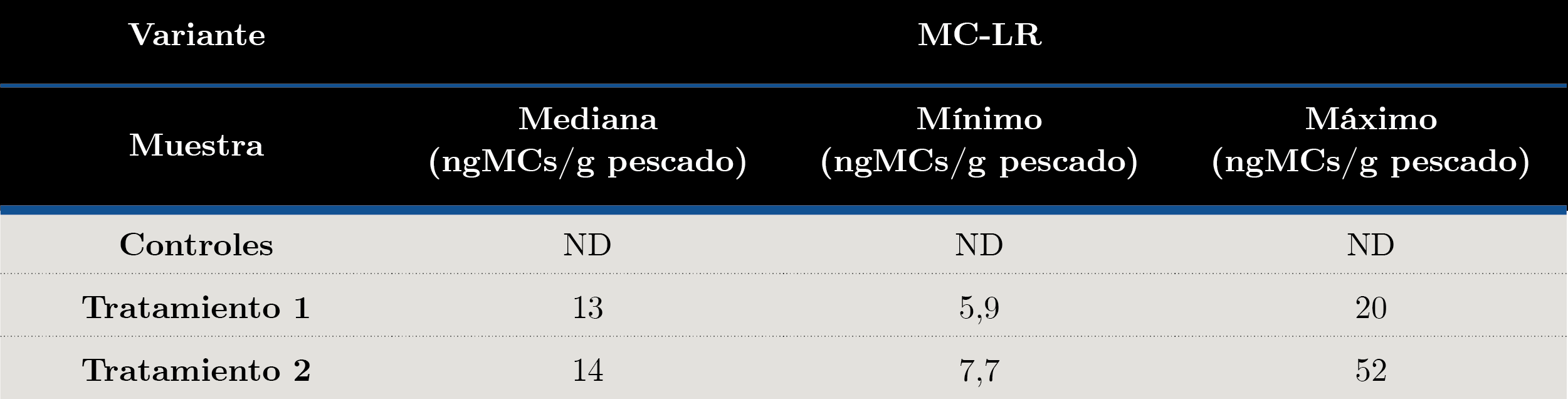
En la Tabla 4 se reportan los resultados de concentración de MC-LR obtenidos por MALDI-TOF cuantitativo. La mediana de los peces expuestos al tratamiento 1 fue de 13 ng MCs/g pescado húmedo y al tratamiento 2 fue de 14 ng MCs/g pescado húmedo. De igual manera que para el ELISA, se observó una alta variabilidad entre muestras con las mismas condiciones de exposición.
En las muestras de Castañetas fortificadas previamente a la extracción, se obtuvieron valores de recuperación en el rango 64-82%, valores que se encuentran de acuerdo a los antecedentes (Meriluoto, et al., 2017, pp.360).
Tabla 4. Concentración de MCs en Castañetas expuestas en el bioensayo, determinadas por MALDI-TOF cuantitativo. Se presentan los datos de mediana, mínimo y máximo para MC-LR para las cuatro submuestras de cada tratamiento. Se analizaron 2 submuestras de cada acuario por triplicado.
Comparación de métodos
En la Figura 6, se muestra la comparación de resultados obtenidos por ambos métodos para los peces del bioensayo (rSpearman = 0,98, pvalor = 7,424e-08, R2Spearman= 0.95, n = 12). Si bien el método requiere una mayor evaluación para el estudio de peces provenientes de la naturaleza, se destaca que la correlación ELISA vs. MALDI-TOF cuantitativo para MC-LR fue excelente, lo que resalta el potencial del ELISA con nanobody como una herramienta de detección para minimizar el número de muestras analizadas por métodos analíticos de alto costo y performance.
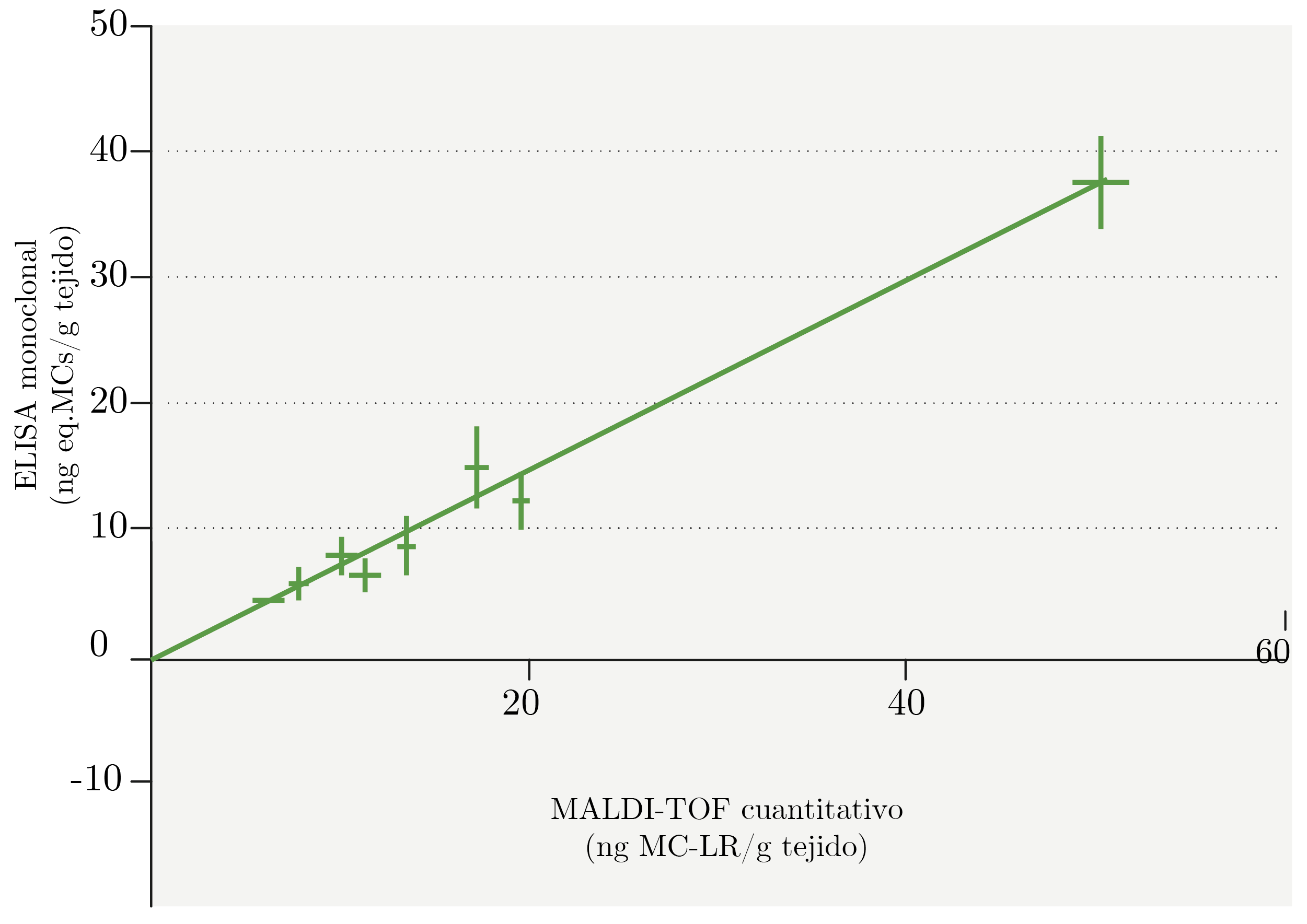
Figura 6. Comparación de resultados de concentración de MCs obtenidos por ambos métodos, en extractos de Castañetasa tiempo final del bioensayo de exposición (R2=0,988).
Discusión
El bioensayo de A. facetus se realizó utilizando floraciones naturales productoras de MCs en condiciones que usualmente pueden encontrarse en cursos de agua eutrofizados, como en los grandes embalses de los ríos Negro y Uruguay, y en el Río de la Plata. Las concentraciones de MCs contenidas en la biomasa, aplicada tanto en el día inicial del bioensayo como en la reaplicación, decayeron rápidamente en los acuarios. Las razones de este rápido decaimiento de las MCs en el agua pueden ser múltiples, pero es claro que sólo una mínima fracción de la cantidad aplicada se detectó en los peces. Es así que, por ejemplo, en el tratamiento 1 se aplicaron 2400 µg de MCs por pecera de 20 litros (dos veces 1200 µg) y sólo se encontraron en los peces, aproximadamente, 0,12 µg MCs (7,2 ng MC-LR/g pescado, en un total de 17 g de peces). Una vez que las MCs se liberan al agua por ruptura celular, su concentración disminuye a tasas muy variables dependiendo de las condiciones, como resultado de procesos tales como adsorción a material particulado, descomposición química, fotólisis y degradación biológica (Schmidt, et al., 2014). Estos procesos limitan la exposición a las MCs, y el impacto en los peces y la biota.
Aún cuando no se encontró mortalidad, a nivel subcrónico se observaron alteraciones hepáticas en los peces expuestos y no así en los peces control. La infiltración grasa y la degeneración grasa macrovesicular observadas en el hígado han sido reportadas en otros peces frente a floraciones productoras de MCs (Preeti, et al., 2016; Acuña, et al., 2020), y sugieren un efecto de toxicidad en principio reversible, pero que puede conducir a una función celular deteriorada e insuficiencia hepática. Además hay que considerar el efecto sinérgico acumulado de las toxinas con otros componentes tóxicos presentes en la biomasa de cianobacterias, tales como lipopolisacáridos, entre otros, que no han sido suficientemente estudiados (Roegner, et al., 2019).
Es posible que en nuestros sistemas hídricos eutrofizados, eventos de mortandades de peces observados en temporada estival estuvieran relacionados con las floraciones productoras de MCs. Los resultados presentados contribuyen al conocimiento de las lesiones histopatológicas de peces expuestos a floraciones de cianobacterias en el país. Para una mejor identificación de las causas de estas mortandades se deberá continuar profundizando estos estudios.
Los peces expuestos en el bioensayo se utilizaron para estudiar la concentración de MCs mediante nuevas metodologías de análisis. Estos métodos podrían facilitar la evaluación del riesgo de consumo de pescado expuesto a floraciones productoras de MCs. Los inmunoensayos del tipo ELISA son, por su sencillez y alta sensibilidad, herramientas con múltiples ventajas para el análisis de MCs, pero su aplicabilidad en tejidos animales presenta mayores desafíos que su uso en agua. En función de su alta especificidad y selectividad reportada para diferentes analitos, en este trabajo se utilizaron inmunoensayos basados en anticuerpos recombinantes monodominio de llama (nanobody) (González-Sapienza, et al., 2017). De todos modos, es necesario estudiar el efecto matriz del ensayo, ya que múltiples componentes de los extractos podrían interferir en el análisis (Ibelings y Chorus, 2007; Hu, et al., 2017). Los resultados en extractos de Castañetas no expuestas, adicionadas con microcistina-LR en un amplio rango de concentración, evidenciaron un muy buen desempeño del ELISA utilizado en este trabajo.
Otra posible limitación de los inmunoensayos se debe a que, además de las variantes de MCs presentes, podrían detectar metabolitos de detoxificación (conjugados MCs con cisteína y glutatión), que presentan mucho menor toxicidad que las correspondientes toxinas libres (Schmidt, et al., 2014; Li, et al., 2014). Para confirmar y cuantificar la presencia de diferentes variantes de MCs y distinguirlas de sus metabolitos, se utilizó un nuevo método ultrasensible de MALDI-TOF cuantitativo, originalmente validado para aguas y sueros de animales (Pírez-Schirmer, et al., 2019).
La altísima correlación encontrada entre la determinación de MCs por ELISA y la microcistina-LR mediante MALDI-TOF cuantitativo permite visualizar que la utilización del ELISA de nanobody tiene muy alto potencial para el estudio de extractos de peces. Sin embargo, debe resaltarse que se requieren experimentos complementarios, incluyendo el análisis de un alto número de peces de diferentes especies expuestos en la naturaleza y la comparación con métodos de referencia como el LC-MS/MS.
Los niveles de toxinas presentes en las Castañetas del bioensayo se encuentran en consonancia con los encontrados en otros bioensayos reportados (Adamovský, et al., 2007; Li, et al., 2004; Dyble, et al., 2011; Cazenave, et al., 2005), e incluso en estudios de la naturaleza (Flores, et al., 2018). Es destacable que esto sucedió a pesar de que las condiciones de los bioensayos antes reportados (especie, tiempo, vía de exposición) fueron diferentes a las del presente trabajo. Otro aspecto relevante es que la tasa de biotransformación de las MCs es muy rápida en peces y depende de la especie, así como del tejido estudiados (Adamovský, et al., 2007; Dyble, et al., 2011). Los valores de vida media de equivalentes de MC-LR (determinados por ELISA) reportados en músculo de Cyprinus carpio y Hypophthalmichthys molitrix son de 2,8 y 0,7 días, y en hígado de 4,0 y 3,5 días, respectivamente (Adamovský, et al., 2007). Esto implica que puede existir una alta variabilidad del contenido de toxinas en diversos tejidos de peces, no solamente en función de la especie sino también del tiempo trascurrido luego de la exposición a la floración. Es muy probable que los peces de este bioensayo estuvieran en una etapa avanzada de detoxificación y eliminación, pero igualmente se encontraron en algunas muestras valores de concentración por encima del valor guía de acción de California para MCs en alimentos de 10 ng/g tejido húmedo (Butler, et al., 2012, p.4). Por lo tanto, considerando estos resultados y la intensidad de las floraciones productoras de MCs en los principales cursos de agua del país, resulta importante estudiar el contenido de toxinas en pescado de consumo y profundizar en la validación de métodos sencillos de análisis como los propuestos en este estudio.
Agradecimientos
Se agradece la colaboración de Graciela Ferrari del LATU por la identificación de las especies presentes en la floración, de Daniel Sienra y la Unidad de Calidad de Agua del SECCA, Intendencia de Montevideo, por la extracción de la muestra de floración.
Se agradece el apoyo financiero de: ANII-FMV-104085, CSIC Grupos 150725, UdelaR y PEDECIBA. Natalia Badagian recibió becas de posgrado de ANII y de la Comisión Académica de Posgrado, UdelaR.
