Autores
- Rey, Fabiana S.(1); López, Victoria(1); Cardozo, Gonzalo(1); Olazábal, Laura(2); De Torres, Elena(3); Escobar, Daniela(1).
- LATiTUD - Fundación LATU. Montevideo, Uruguay
- LATU. Montevideo, Uruguay.
- Campo experimental Nº2, Facultad de Veterinaria, UdelaR. San josé, Uruguay.
Los antibióticos son utilizados en los tambos para el tratamiento y prevención de enfermedades en ganado bovino lechero, como la mastitis, cojeras, infecciones respiratorias y diarrea. Los residuos de antibióticos en leche pueden generar problemas en la población en forma de alergias y resistencia antimicrobiana, así como en la industria y el medio ambiente. Existen reglamentaciones nacionales e internacionales que prohíben el procesamiento de leche con antibióticos, por lo que es de importancia el estudio de alternativas para su disposición. El objetivo de este trabajo fue estudiar el efecto del tratamiento con β-lactamasa (BL) en la degradación de penicilina G (PG) en leche. Los ensayos se realizaron en leche en polvo descremada contaminada con tres concentraciones de antibiótico: 6, 12 y 30 ppb. Se probaron tres concentraciones de BL (0,1, 0,5 y 1,0 mU / mL). Se extrajeron muestras a las 3, 6, y 9 horas para la detección y cuantificación de antibióticos. Los resultados obtenidos indican que en 3 horas se degradó la PG utilizando 0,5 mU / mL de β-lactamasa y en 6 horas con una concentración menor de enzima (0,1 mU / mL) en todas las concentraciones de antibiótico evaluadas. Las enzimas estudiadas presentan un alto potencial para degradar antibióticos en leche en tambos antes de su disposición final.
Palabras clave: degradación de antibióticos, enzimas microbianas, leche.
Os antibióticos são utilizados nas explorações leiteiras para o tratamento e prevenção de doenças do gado leiteiro, como a mastite, a claudicação, as infecções respiratórias e a diarreia. Os resíduos de antibióticos no leite podem gerar problemas na população sob a forma de alergias e resistência antimicrobiana, bem como na indústria e no ambiente. Existem regulamentações nacionais e internacionais que proíbem o processamento de leite com antibióticos, por isso é importante estudar alternativas para a sua eliminação. O objetivo deste trabalho foi estudar o efeito do tratamento com β - lactamase (BL) na degradação da penicilina G (PG) no leite. Os ensaios foram realizados com leite em pó desnatado contaminado com três concentrações de antibióticos: 6, 12 e 30 ppb. Três concentrações de BL (0,1, 0,5 e 1,0 mU / mL) foram testadas. As amostras foram colhidas em 3, 6 e 9 horas para detecção e quantificação de antibióticos. Os resultados obtidos indicam que em três horas o PG foi degradado com 0,5 mU / mL de β-lactamase e em seis horas com menor concentração de enzima (0,1 mU / mL) em todas as concentrações de antibióticos analisadas. A β - lactamase estudada tem um alto potencial para degradar a penicilina no leite em fazendas leiteiras antes da disposição final.
Palavras-chave: degradação antibiótica, enzimas microbianas, leite.
Introducción
Los antibióticos son agentes terapéuticos, naturales o sintéticos, que actúan inhibiendo el crecimiento o eliminando microorganismos sensibles. Según su modo de acción, se clasifican en los siguientes grupos: betalactámicos, sulfonamidas, carbepenems, aminoglicósidos, glicopéptidos, lincomicinas, macrólidos, polipéptidos, polienos, rifamicina, tetraciclinas, cloranfenicol, quinolonas y fluoroquinolonas (Gothwal y Shashidhar, 2014). Su uso está ampliamente extendido, tanto en humanos como en animales. En medicina veterinaria son usados como terapéuticos para tratar enfermedades clínicas, en tratamientos de corta duración para tratar animales enfermos y evitar el contagio, como profilácticos y como promotores de crecimiento (Mathew, et al., 2007; Landers, et al., 2012). Según un estudio realizado por USDA, en los tambos de Estados Unidos la mayor parte de los antibióticos son usados para tratar mastitis (16,4% de los animales), cojera (7,1%), enfermedades respiratorias (2,8%), diarreas y otros problemas digestivos (1,9%) (USDA - APHIS, 2008). Cerca del 90% de los tambos usan antibióticos para la prevención de enfermedades, como por ejemplo la terapia de secado al terminar la lactancia. La cefalosporina y los beta-lactámicos son los más utilizados para el tratamiento de la mastitis en el mundo (Mathew, et al., 2007). Asimismo, para la terapia de secado los de preferencia son la penicilina G y la cefapirina (Oliver, et al., 2011). En Uruguay, los beta-lactámicos (penicilina, amoxicilina, cloxacilina, etcétera) son uno de los grupos de agentes antimicrobianos más utilizados y recomendados como droga en primera línea, por su bajo costo, toxicidad y riesgo de desarrollo de resistencia antimicrobiana (Gianneechini, et al., 2005). El uso excesivo de antibióticos y la presencia de residuos de estos en la cadena alimentaria han provocado una gran preocupación a nivel mundial tanto por sus efectos en la salud humana y animal como en los procesos industriales. Desde el punto de vista sanitario, en humanos pueden generar reacciones alérgicas, toxicidad, efectos sobre la flora intestinal y la emergencia de bacterias resistentes en animales con la posible transferencia de genes de resistencia a patógenos humanos (Mitchell, et al., 1998; Van Boeckel, et al., 2015). Desde el punto de vista tecnológico, los antimicrobianos pueden generar enlentecimiento o inhibición de los procesos de acidificación, cuajado y maduración, deteriorando las propiedades organolépticas e incluso inhibiendo por completo la fermentación en la elaboración de quesos y yogures (Grunwald y Petz, 2003; Berruga, et al., 2016).
Existen reglamentaciones a nivel nacional e internacional que prohíben el procesamiento de leche con antibióticos. La leche es analizada antes de su entrada a la planta industrializadora y es desechada si no cumple con el límite máximo de residuos (LMR) establecido en las reglamentaciones (Uruguay, 2016; Codex Alimentarius, 2018). El descarte de esta leche tiene un impacto negativo en los sistemas de tratamiento de efluentes de tambos e industrias y puede producir acumulación y persistencia de estas moléculas en el suelo y potencialmente en los cursos de agua, lo que afectaría los ecosistemas acuáticos y terrestres (Kemper, 2008; Correa, et al., 2016).
Existen distintos métodos para detección de antibióticos: los utilizados para cribado, los de inhibición microbiológica y los métodos enzimáticos, inmunoenzimáticos y de unión a receptores, que permiten detectar, de una forma más específica y rápida, la presencia de residuos de antibióticos (Kantiani, et al., 2009). Los kits “rápidos” son capaces de identificar familias de antimicrobianos e incluso grupos combinados. La prueba Charm, que detecta los betalactámicos y las tetraciclinas (Charm MRL BLTET; Charm Sciences Inc. Massachusetts, USA), es un ensayo inmunorreceptor que utiliza la tecnología de flujo lateral de ensayo rápido de un paso (ROSA) para la detección en leche cruda y su límite de detección (presencia / ausencia) es el límite máximo de residuos (LMR) que surge de las recomendaciones dadas por el Codex Alimentarius para cada tipo de antibiótico (Codex Alimentarius, 2018). Para controles confirmatorios son utilizados los métodos cuantitativos instrumentales, como la cromatografía líquida masa-masa (HPLC-MS / MS) (Holstege, et al., 2002; Tian, et al., 2016).
En este contexto se ha tornado de gran importancia la posibilidad de degradar y / o remover los residuos de antibióticos de la leche previo a su descarte, con el fin de mitigar el daño a la salud y al ambiente. Se han reportado estudios en los que se emplearon distintas metodologías para la remoción y / o degradación de antibióticos, fundamentalmente en medio acuoso, entre las que se destacan: filtración por membranas, luz ultravioleta, ozono, métodos electroquímicos, adsorción con carbón activado y la utilización de microorganismos y/o las enzimas que estos producen (Koyuncu, et al., 2008; Homem y Santos, 2011; Gómez-Pacheco, et al., 2011; Karigar y Rao, 2011; Kitazono, et al., 2012).
Los procesos enzimáticos son una alternativa muy prometedora para la degradación de residuos de antibióticos y otros agentes terapéuticos en medios acuosos y otras matrices como la leche. Se han reportado numerosos estudios en los que queda demostrado que tanto las enzimas oxidativas como las hidrolíticas catalizan la degradación de estas moléculas (Karam y Nicell, 1997; Park y Choung, 2007; Wen, et al., 2010; de Cazes, et al., 2016; Ding, et al., 2016; Copete-Pertuz, et al., 2018).
Como fue expuesto anteriormente, los antibióticos betalactámicos se encuentran entre los más usados en veterinaria en Uruguay. Son de origen natural o semisintético y tienen la característica de poseer un anillo betalactámico en su estructura. Actúan inhibiendo la síntesis de la pared celular bacteriana y su espectro de acción incluye bacterias gram positivas, gram negativas y espiroquetas. Las penicilinas contienen un anillo betalactámico unido a un anillo tiazolidínico y difieren entre ellas por la sustitución en la posición 6 del anillo betalactámico (Seija y Vignoli, 2006).
La beta-lactamasa (EC 3.5.2.6) es una enzima producida por ciertas bacterias, lo que confiere resistencia a la penicilina a estos microorganismos. Su modo de acción se basa en la hidrólisis del anillo betalactámico, dando lugar a la formación de ácido peniciloico (Desphande, et al., 2004).
El objetivo de este trabajo fue estudiar el efecto del tratamiento con β-lactamasa de leche contaminada con penicilina G en la degradación del antibiótico. Para ello se estudiaron tres variables: concentración de antibiótico, concentración de enzima y tiempo de reacción. Se utilizó una metodología que permitiera evaluar el porcentaje de degradación del antibiótico mediante su detección cualitativa, aplicando un método rápido de unión a receptores proteicos, y confirmar los resultados obtenidos mediante HPLC-MS / MS.
Materiales y métodos
Materiales y reactivos
Para las pruebas de degradación se utilizó leche en polvo descremada Conaprole reconstituida en agua destilada, según instrucciones del fabricante. La enzima β - lactamasa de Enterobacter cloaceae (tipo III, EC 3.5.2.6, polvo liofilizado, 6 - 18 unidades / mg de proteína usando bencilpenicilina) y el antibiótico Penicilina G sal sódica (PENNA, ~1650 U / mg) fueron adquiridos de Sigma - Aldrich.
Todos los reactivos utilizados fueron de calidad pura para análisis y HPLC. Las soluciones stock de antibiótico fueron preparadas con agua ultrapura (resistividad ≥ 18,2 MΩ cm) y conservadas a -20 ℃. Las soluciones stock de enzima fueron preparadas en buffer PBS pH 7 y conservadas a 4 ℃. La solución de nitrocefina (Thermo Scientific - Oxoid) fue preparada reconstituyendo la nitrocefina liofilizada en el líquido de rehidratación provisto por el fabricante (buffer fosfato pH 7 y dimetilsulfóxido).
Ensayo de actividad β-lactamasa
Se preparó una solución stock de enzima (3,3, mg / mL) disolviendo la enzima liofilizada en buffer PBS pH 7, y se realizó una dilución 1:1000. El sustrato utilizado fue nitrocefina (Oxoid) en concentración 1 mM (ε = 20.500 M-1cm-1). Se incubó a 25 ℃ y se midió absorbancia a 486 nm cada 1 minuto durante un intervalo de 10 minutos. Se definió una unidad de β - lactamasa como la cantidad necesaria para hidrolizar 1 µmol de nitrocefina en 1 minuto a pH 7 y 25 ℃.
Ensayo de degradación de penicilina G con β-lactamasa
Para la degradación de penicilina G, se estudió el efecto de tres concentraciones de enzima β - lactamasa (0,1; 0,5; y 1,0 mU / mL) en el tiempo (3, 6 y 9 horas) sobre leche descremada contaminada con tres concentraciones de antibiótico (6, 12 y 30 ppb).
Los ensayos de degradación del antibiótico fueron realizados en batch en tubos de 15 mL. Se utilizó leche en polvo descremada reconstituida al 9% (p / v) con agua destilada a la que se le adicionó Penicilina G en las cantidades necesarias para obtener las concentraciones 6, 12 y 30 ppb en la mezcla de reacción. Se vortexeó para homogeneizar el antibiótico en la leche y se realizaron alícuotas de 5 mL en distintos tubos. Para cada concentración de antibiótico se agregó la cantidad de enzima correspondiente para obtener las tres concentraciones de trabajo: 0,1; 0,5 y 1,0 mU / mL. Las reacciones se incubaron en baño de agua a 23,0 ± 0,5 ℃ y 50 rpm. Se tomaron muestras de cada condición a las 3, 6 y 9 horas. Como blancos se utilizó leche en polvo descremada reconstituida, leche en polvo descremada reconstituida contaminada con las tres concentraciones de antibiótico, y leche en polvo descremada reconstituida con las tres concentraciones de enzima. Todos los ensayos fueron hechos por duplicado para la determinación por el método de cribado y por triplicado para la cuantificación por HPLC-MS / MS.
Detección de antibióticos mediante prueba de cribado inmunoensayo/receptor
Para la detección de penicilina G en las muestras de leche contaminadas con antibiótico y tratadas con β - lactamasa, se utilizó la prueba Charm DIP MRL Beta-lactamas y Tetraciclinas para leche cruda mezclada (Charm Sciences, Inc. Massachusetts, USA), siguiendo las instrucciones del fabricante. Se trata de un inmunoensayo rápido que utiliza la tecnología de flujo lateral. Se realiza una toma de 300 µL de la mezcla de reacción, se coloca en un tubo de plástico de 1,5 mL y se sumerge la tira. Se incuba a 56 ℃ durante 10 minutos. Los residuos de antibióticos betalactámicos y tetraciclinas interactúan con las esferas coloreadas en la tira y la intensidad del color en las zonas de prueba y control se lee visualmente y con ello se interpreta un resultado positivo o negativo (Figura 1). Todas las pruebas se realizaron por duplicado.
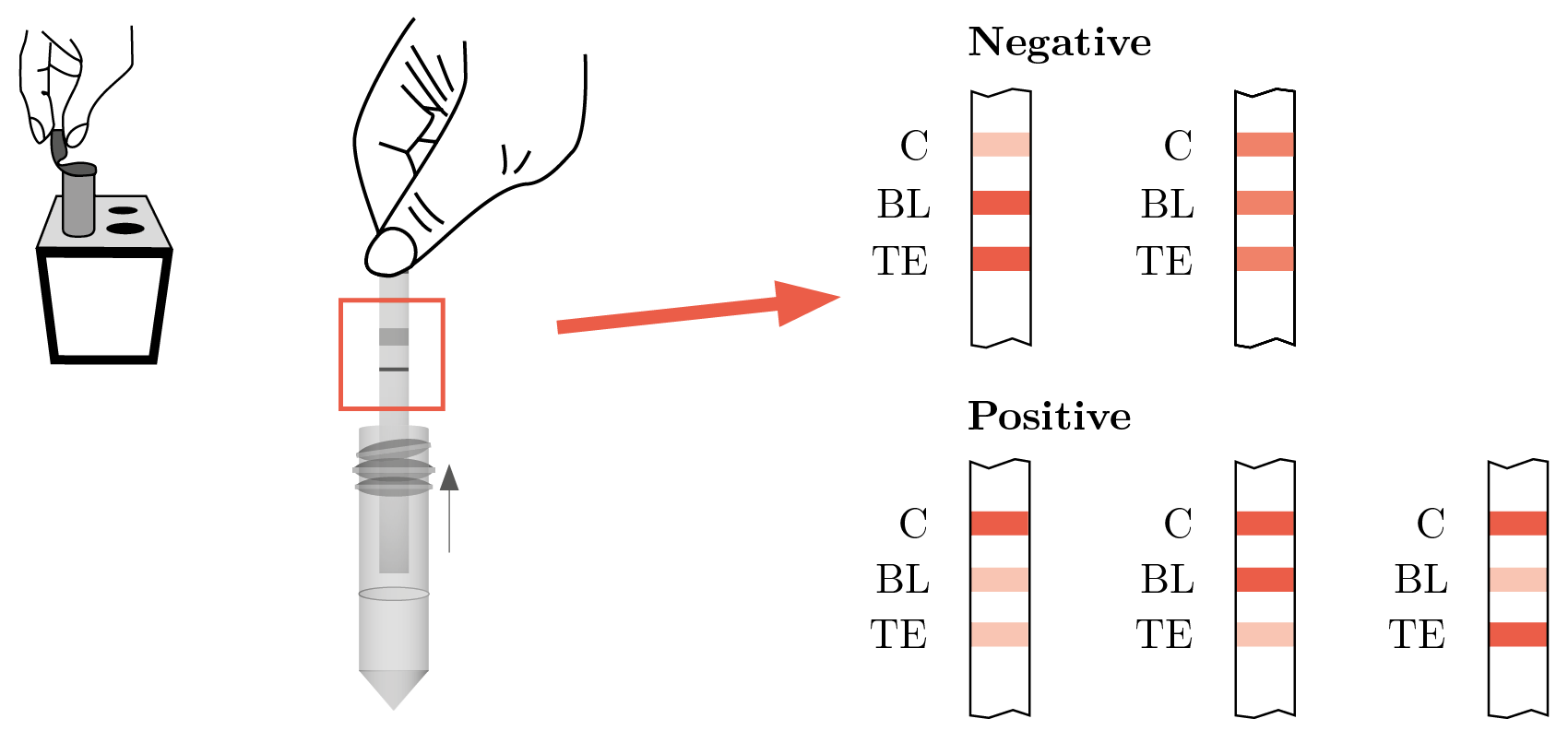
Figura 1. Prueba Charm DIP MRLBLT para leche cruda mezclada. Procedimiento e interpretación de resultados (Charm Sciences, 2016).
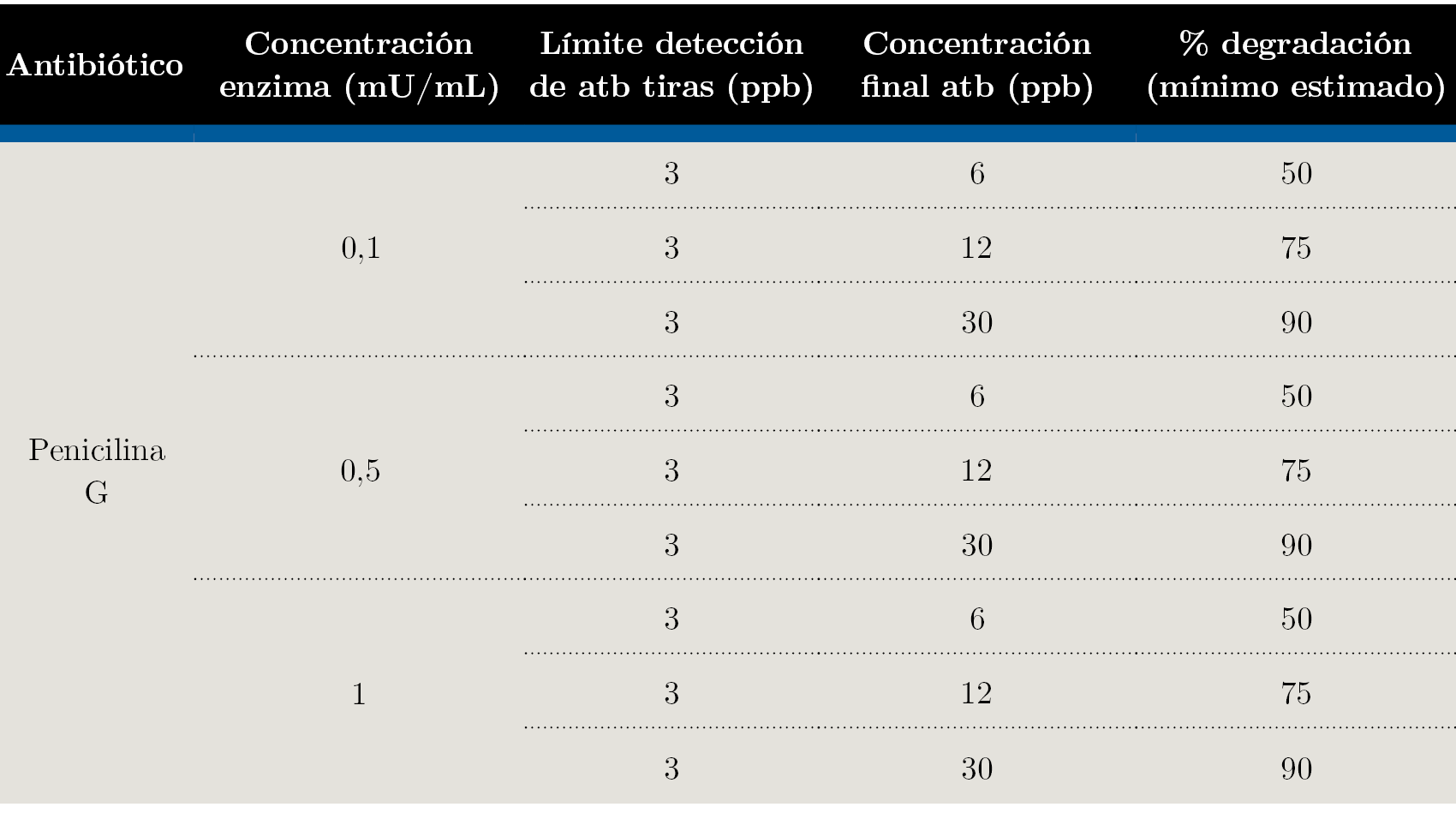
El límite de detección (LD) de esta prueba es de 3 ppb para Penicilina G (Charm Sciences, 2016), base sobre la que se calculó la concentración de penicilina G con la que debía contaminarse la muestra, con el objetivo de lograr por lo menos un 50, 75 y 90% de degradación por parte de la β-lactamasa. Utilizando 6, 12, y 30 ppb de antibiótico podrían asumirse esos porcentajes de degradación (mínimos estimados) si se obtenía un resultado negativo con la tira reactiva (Tabla 1).
Tabla 1. Diseño del experimento y cálculo de la concentración inicial de antibiótico y el porcentaje de degradación mínimo estimado según el LD de las tiras.
El cálculo del porcentaje de degradación se realizó según la siguiente fórmula:
Degradación (%) = [(Concentración PG inicial – Límite detección PG tiras) / Concentración PG inicial] * 100
Identificación y cuantificación de antibióticos por HPLC-MS/MS
A los efectos de detener la reacción enzimática, se tomó 1 mL de muestra y se le agregó 1 mL de acetonitrilo calidad UPLC. Se agitó en vortex durante 5 minutos, en multi rotator 5 minutos y con agitador mecánico 5 minutos. Se centrifugó a 8500 g, a temperatura de 4 ℃ durante 15 minutos. Se separó el sobrenadante y se filtró con filtro de 0,22 µm en viales uniprep.
El HPLC-MS / MS utilizado (Agilent UPLC 1290) está equipado con un detector de masa Triple Quad LC / MS (Agilent 6430) y se usó una columna Poroshell 120 EC - C18 2.1 x 100 mm 2.7 - Micron (Agilent Technologies). La fase móvil fue acetonitrilo / agua, ambas con 5 mM de formiato de amonio y 0,1% de ácido fórmico. El programa de gradiente usado para la concentración de acetonitrilo fue el siguiente: se inició 5% de acetonitrilo en la fase móvil y a los 10 minutos hay 50% de la fase orgánica. Se mantuvo la concentración de acetonitrilo en 50% hasta los 13 minutos, y a partir del minuto 16 la fase orgánica fue de 5% hasta los 22 minutos. El flujo de la fase móvil fue de 0,25 mL / min.
Se trabajó en modo MRM y las condiciones de operación del espectrómetro de masas fueron las siguientes: fuente de ionización ESI en modo positivo, temperatura de la fuente de ionización 300 ℃, flujo del gas nitrógeno (gas de nebulización) 10 L / min, presión del nebulizador 50 psi, voltaje del capilar 4000 V.
El rango de linealidad estudiado fue entre 4 - 200 ppb.
Análisis estadístico
Se utilizó Análisis de Varianza (ANOVA) en el estudio de porcentaje de degradación, se determinó diferencia significativa entre muestras por test de Tukey (α ≤ 0,05). Los análisis se realizaron usando InfoStatStatistical Software versión 2011.
Resultados y discusión
Evaluación de la degradación mediante prueba de cribado inmunoensayo/receptor
En la Tabla 2 se pueden observar los resultados obtenidos luego de la acción de la β - lactamasa sobre la penicilina G, determinados con la prueba Charm DIP MRLBLT.
Tabla 2. Degradación de penicilina G en leche, detectada con tiras reactivas (prueba Charm DIP MRLBLT) en función de la concentración de β - lactamasa (0,1; 0,5 y 1 mU / mL) a distintos tiempos de reacción (3, 6 y 9 horas).
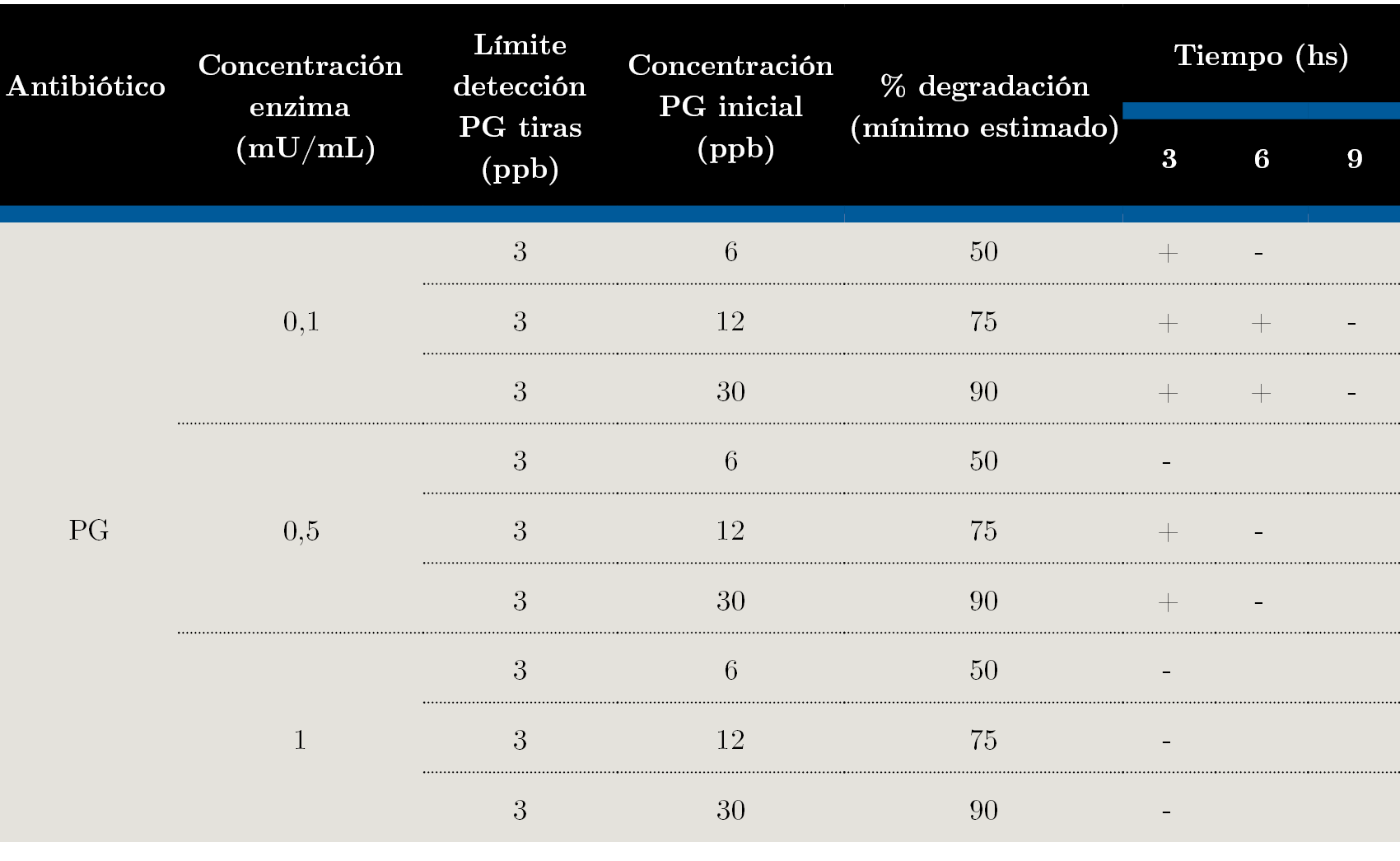
La prueba Charm es un ensayo cualitativo para detectar la presencia de antibióticos en leche, que arroja un resultado positivo (presencia) o negativo (ausencia), según la respectiva concentración de antibiótico por encima o por debajo del límite de detección de las tiras. Como se desprende de la Tabla 2, en tres horas 1,0 mU / mL de β -lactamasa degradó por lo menos un 90% de los 30 ppb de penicilina G presente en la leche. Con 0,1 mU / mL de enzima, a las 6 hs se degradó por lo menos el 50% de la penicilina G inicial en la muestra contaminada con 6 ppb, y a las 9 hs el 90% de los 30 ppb. Con 0,5 mU / mL de enzima a las 3 hs se degradó por lo menos el 50% del antibiótico inicial en la muestra con 6 ppb y a las 6 hs el 90% de los 30 ppb.
Algunos autores han reportado que la penicilina es una molécula que contiene un enlace amida β-lactámico inestable y reactivo, por lo que su degradación puede darse en varias condiciones: ácidas, básicas, en presencia de β-lactamasa o por tratamiento con iones metálicos (Desphande, et al., 2004). Es importante destacar que prácticamente no se encontraron en la bibliografía estudios de degradación de antibióticos en leche mediante el uso de la enzima β-lactamasa. Korycka-Dahl y colaboradores (1985) reportaron un estudio realizado en leche para la degradación de penicilina G en leche usando una β-lactamasa de Bacillus cereus. En ese estudio obtuvieron degradación de la penicilina, pero recién a las 18 hs, usando 1,0 mU / mL de enzima y trabajando a 4 ℃ (Korycka-Dahl, et al., 1985).
En este trabajo se obtuvieron resultados muy prometedores con respecto al uso de la β-lactamasa para degradar penicilina en condiciones perfectamente escalables a un tambo o a la industria.
Evaluación de la degradación mediante cuantificación de penicilina por HPLC - MS / MS
A los efectos de verificar los resultados obtenidos con la prueba rápida de cribado se realizó el mismo experimento de degradación, y la concentración de antibiótico en las muestras fue cuantificada por HPLC - MS / MS, según metodología puesta a punto y validada en el laboratorio de Desarrollo de Métodos Analíticos del Laboratorio Tecnológico del Uruguay (LATU). La validación de la técnica se realizó bajo los requerimientos de la Directiva 2002 / 657 / CE “Funcionamiento de los métodos analíticos y la interpretación de los resultados” (Unión Europea, 2002).
Los resultados de degradación obtenidos se presentan en la Tabla 3. Se observa que con 0,1 mU / mL de β - lactamasa, a las 3 horas se degradó un 39,8%, 60,4%y 61,9% de la penicilina G en concentraciones iniciales de 6, 12 y 30 ppb, respectivamente. Fueron necesarias seis horas para obtener degradaciones mayores a 94,2% de penicilina G y no se observó efecto de la concentración de antibiótico en las muestras contaminadas con 12 y 30 ppb con respecto al porcentaje de degradación obtenido. Sin embargo, con 6 ppb sí se notaron diferencias, debido a que esta concentración se encuentra cerca del límite de detección de la técnica. Los resultados obtenidos a las tres horas con 0,1 mU / mL de enzima medidos con las tiras reactivas Charm son verificados por los resultados de HPLC - MS / MS.
En las muestras de leche contaminada con 6 ppb de penicilina G tratadas con 0,1 y 0,5 mU / mL de β - lactamasa se reportaron porcentajes de degradación de 74,0%. Este valor es el máximo que se puede informar con esta técnica si se considera que la concentración de antibiótico inicial fue de 6 ppb y que el límite de detección de 2 ppb no permite evaluar si la degradación fue mayor a 74%. A pesar de este efecto, se corrobora el resultado obtenido con las tiras reactivas de la prueba Charm para estas dos condiciones de estudio. Del mismo modo, con la concentración de enzima de 0,5 mU / mL y concentración inicial de antibiótico de 12 y 30 ppb, a las 6 horas se verifica el resultado obtenido con las tiras reactivas por el método cromatográfico.
Las muestras obtenidas a las 9 horas de tratamiento con 1,0 mU / mL de β -lactamasa que contenían 6 ppb de penicilina inicial no fueron analizadas por HPLC - MS / MS, ya que en el ensayo con tiras reactivas se había observado la degradación de por lo menos 90% del antibiótico, con lo cual no iba a ser detectable el antibiótico remanente.
En el análisis por HPLC - MS / MS se observó una degradación mayor al 92,7% cuando la concentración de β - lactamasa fue de 1,0mU / mL a partir de las tres horas de reacción, en las muestras con 12 y 30 ppb de penicilina G, resultado que confirma los obtenidos con la prueba Charm (Tabla 2).
Tabla 3. Degradación de penicilina G con β-lactamasa en leche en distintas condiciones cuantificado por HPLC - MS / MS. Sd: sin datos (no se analizaron por HPLC - MS / MS porque dieron negativo con la prueba rápida). *: valor informado considerando el límite de detección de 2 ppb de la técnica, por lo cual el porcentaje de degradación podría ser aún mayor que el valor reportado ya que no se detectó presencia de antibiótico.
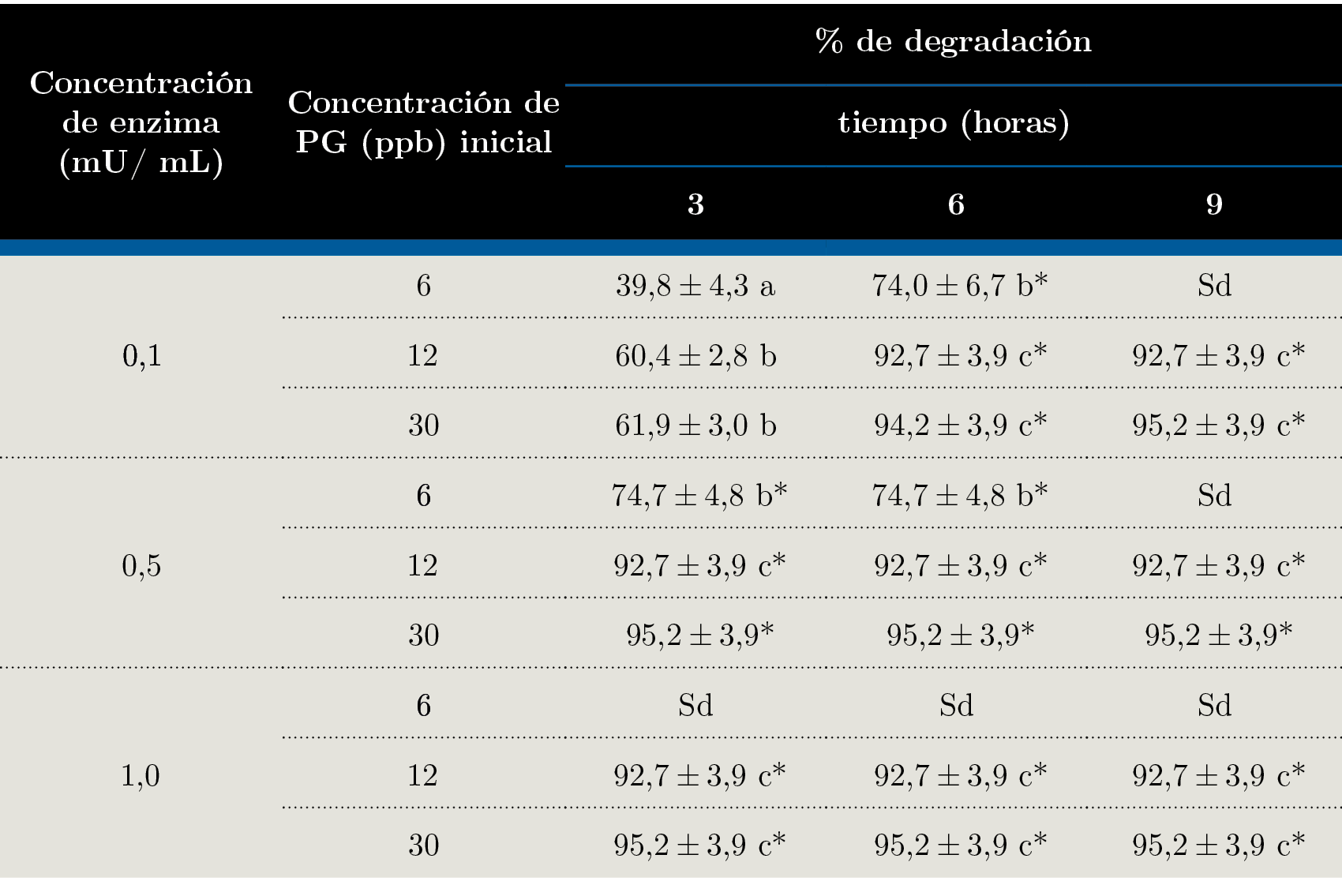
En las muestras que contenían 12 y 30 ppb de penicilina tratadas con 0,1 mU / mL de enzima se observó a las 6 horas una degradación del 92,7 y 94,2%, respectivamente, mientras que en el ensayo con tiras reactivas se reportó una degradación de menos del 75% (lo que marca presencia de antibiótico). Lo mismo ocurre con las muestras con 12 y 30 ppb de antibiótico tratadas con 0,5 mU / mL de enzima. Este hecho indica un resultado falso positivo de las tiras reactivas.
Conclusiones
La β-lactamasade Enterobacter cloaceae presenta un gran potencial para degradar penicilina G en leche mantenida a 23 ℃ durante tres horas con una concentración de enzima de 0,5 mU / mL, condiciones razonables para su aplicación en el tambo. Esto podría ser parte de una solución a un problema que tienen los establecimientos lecheros con respecto al destino de la leche de descarte con residuos de antibióticos, que no puede ser usada para alimentación animal ni vertida en el sistema de tratamiento de efluentes.
Con respecto a los productos de degradación de los antibióticos generados con esta estrategia es necesario realizar estudios cromatográficos y toxicológicos para determinar cuáles son y qué impacto tendrían.
En este trabajo se desarrolló una metodología que permite estimar porcentajes de degradación de penicilina G mediante el uso de un ensayo rápido de cribado.
Todos los resultados en los que no se detectó antibiótico (negativo) en la prueba Charm DIP MRLBLT fueron confirmados con los resultados obtenidos por HPLC - MS / MS. Por lo que las tiras reactivas podrían ser utilizadas como método rápido para evaluar degradación de penicilina G en leche con la metodología desarrollada en este trabajo, pero es necesario tener presente que se pueden obtener resultados falsos positivos.
Reconocimientos
La investigación que da origen a los resultados presentados en esta publicación recibió fondos de la Agencia Nacional de Investigación e Innovación bajo el código FSA_I_2017_1_138926.
Referencias
En: Facultad de Medicina. Temas de bacteriología y virología médica. [En línea]. 2da ed. Montevideo: Oficina del Libro FEFMUR. pp.631- 647. [Consulta: 20 de setiembre de 2019]. Disponible en: http://www.higiene.edu.uy/cefa/2008/TapadeTemasdeBacteriologiayVirologiamedicaed2006.pdf
