Autores
- Tissot, Florencia (1); Pereira Mónica (1); Pistón, Mariela (1); ibáñez, Facundo (2); Dini, Sebastián (2).
- Grupo de Análisis de Elementos traza y desarrollo de estrategias simples para preparación de muestras (GATPREM). Área Química Analítica, Departamento Estrella Campos, Facultad de Química, Universidad de la República, Montevideo, Uruguay.
- Agroalimentos iNiA, Estación Experimental Las Brujas, instituto Nacional de investigación Agropecuaria, Canelones, Uruguay.
Las frutas y hortalizas pueden contener contaminantes que llegan al producto en cualquier punto de la cadena productiva. En este sentido, se debe controlar la acumulación de elementos potencialmente tóxicos como arsénico (As), cadmio (Cd) y plomo (Pb) para asegurar y controlar la inocuidad de estos alimentos.
Con el objetivo de monitorear los contaminantes inorgánicos, de forma rápida, confiable y con métodos analíticos en acuerdo con los principios de la química verde, se desarrolló y validó una metodología para la extracción simultánea de estos elementos asistida con microondas, en un solo paso y utilizando ácido diluido.
Se aplicó el método validado a cuatro productos: zanahoria, lechuga, manzana y tomate. Los parámetros de desempeño de esta metodología indicaron que resultó adecuada para monitorear estos alimentos tomando como referencia la reglamentación vigente y que todas las muestras analizadas cumplieron con los criterios establecidos. Esta metodología validada puede ser considerada como alternativa a los métodos estándar de análisis de As, Cd y Pb en este tipo de alimentos. El desarrollo de estas herramientas analíticas es de relevancia y deja disponible una plataforma analítica al servicio del sector productivo y de organismos de contralor nacional.
Palabras clave: inocuidad alimentaria, vegetales, plomo, cadmio, arsénico.
Frutas e legumes podem conter contaminantes que atingem o produto em qualquer ponto da cadeia de produção. Nesse sentido, o acúmulo de elementos potencialmente tóxicos como arsênico (As), cádmio (Cd) e chumbo (Pb) deve ser controlado para garantir e controlar a segurança desses alimentos.
Para monitorar poluentes inorgânicos de arsênico, cádmio e chumbo, de forma rápida, confiável e com métodos analíticos de acordo com os princípios da química verde, foi desenvolvida e validada uma metodologia para a determinação simultânea desses elementos assistida por microondas, em uma única etapa e usando ácido diluído.
O método validado foi aplicado em quatro produtos: cenoura, alface, maçã e tomate. Os parâmetros de desempenho dessa metodologia indicaram que o método era adequado para monitorar esses alimentos tomando como referência as normas vigentes. O método analítico desenvolvido pode ser considerado uma alternativa aos métodos padrão de análise para a determinação de As, Cd y Pb nesses alimentos. Todas as amostras analisadas atenderam aos critérios regulatórios. Essa metodologia validada e aplicada a estudos de segurança é relevante e disponibiliza uma plataforma analítica ao serviço do setor produtivo e das agências nacionais de controle.
Palavras-chave: : segurança alimentar, vegetais, chumbo, cádmio, arsênico.
Introducción
El concepto de inocuidad de los alimentos comprende diferentes acciones para garantizar seguridad al consumirlos, un aspecto fundamental para la salud pública y un factor muy relevante en la comercialización. Las políticas y actividades a implementar deben abarcar toda la cadena alimenticia, desde la producción hasta el consumidor final.
Las frutas y hortalizas podrían contener contaminantes inorgánicos que ingresan al producto en cualquier punto, desde su cultivo a su cosecha y hasta en la cadena de procesamiento que las lleva al consumidor final.
En particular, la acumulación de metales y semimetales potencialmente tóxicos en alimentos es crucial para definir el concepto de calidad de los mismos (Islam, et al., 2016; Rehman, et al., 2016; Rehman, et al., 2017). Debido a esto las determinaciones analíticas de elementos como arsénico (As), cadmio (Cd) y plomo (Pb) en diversas matrices alimentarias han tomado vital importancia para asegurar y monitorear la inocuidad de los alimentos.
Entre las principales fuentes de contaminación inorgánica se encuentran el agua de riego, el suelo, el aire y el uso de fertilizantes (Allende y Monaghan, 2015).
En Uruguay algunos estudios demuestran que las aguas de determinados acuíferos presentan niveles de As superiores a los admitidos por la Organización Mundial de la Salud (10 µg L-1) y que no se cuenta con información reportada respecto a los suelos (Mañay, et al., 2013; World Health Organization, 2018; Mañay, et al., 2019).
El Cd llega a los suelos y aguas principalmente debido al uso indiscriminado de fertilizantes fosfatados, que contienen Cd como un producto secundario en su obtención y se acumula en los suelos pudiendo ser absorbido por los vegetales y, por lo tanto, incorporado en los alimentos de consumo humano (Nziguheba y Smolders, 2008).
El Pb se encuentra en el ambiente en forma natural, sin embargo, los altos niveles de este elemento en el ambiente son de origen antropogénico.
Las plantas han desarrollado mecanismos específicos para absorber, traslocar y acumular nutrientes, pero esos mismos mecanismos pueden también incorporar elementos no esenciales debido a su comportamiento electroquímico, similar al de los esenciales (Lasat, et al., 2000).
El Reglamento Técnico Mercosur establece límites máximos de concentración de contaminantes inorgánicos en alimentos. Indica que para el Cd el máximo admitido es de 0,2 mg kg-1 para hortalizas de hoja y 0,1 mg kg-1 para frutas y demás hortalizas; para Pb es 0,3 mg kg-1 para hortalizas de hoja y 0,1 mg kg-1 para frutas y hortalizas, y para As es 0,3 mg kg-1 para frutas y hortalizas (MERCOSUR, 2011). En todos los casos se refiere a base fresca. La determinación de estos elementos se debe realizar en laboratorios analíticos que cuenten con metodologías validadas y de forma rápida y confiable, para cumplir con los requerimientos y así liberar los productos al mercado o para su exportación.
Para la determinación analítica de As, Cd y Pb en muestras de tejido vegetal se requiere un pretratamiento de extracción de los analitos de la matriz y posterior medición en una disolución. Este proceso puede ser más o menos complejo según la matriz y el elemento en cuestión. Generalmente se utilizan protocolos o métodos estándar que requieren digestiones ácidas por vía húmeda o seca. En particular, el método oficial para análisis de metales y otros elementos traza en alimentos de la AOAC Internacional (AOAC 986.15) utiliza ácido nítrico concentrado para la digestión de las muestras (AOAC International, 2016).
Buscando el desarrollo de métodos analíticos más alineados a los principios de la química verde se propone la utilización de una digestión asistida por microondas con ácido diluido como procedimiento alternativo de extracción de los elementos de las matrices vegetales (Nobrega, et al., 2002).
Una vez que las muestras son tratadas mediante procedimientos para obtener una disolución adecuada para la realización de las mediciones analíticas, los elementos As, Cd y Pb pueden determinarse mediante diversas técnicas de espectrometría atómica. En el caso de Cd y Pb habitualmente se utilizan las técnicas de absorción atómica con atomización electrotérmica (ETAAS) y de emisión atómica con plasma de acoplamiento inductivo (ICP OES) y acoplado a masas (ICP MS) (Welz y Sperling, 1999). Para determinación de As, se utiliza en los métodos oficiales la técnica de absorción atómica de llama acoplada a hidruros (HG-AAS), esta técnica requiere el uso de un gas inflamable como el acetileno (Welz y Sperling, 1999). Una técnica aún poco extendida en los laboratorios analíticos es la de emisión atómica con plasma inducido por microondas (MIP OES), que permite el acople de una cámara para generación de hidruros. Esta técnica cuenta con múltiples ventajas respecto a otras, entre ellas el hecho de que el plasma es sostenido por nitrógeno que se obtiene a partir de un generador alimentado con aire comprimido (Williams, et al., 2019). Los costos tanto de inversión como de mantenimiento de este instrumento son considerablemente menores a cualquier otra técnica atómica y elimina el uso de acetileno en los laboratorios.
Para este trabajo se seleccionaron frutas y hortalizas de consumo masivo que presentan mayor riesgo de contener elevados niveles de estos elementos, ya sea por su contacto directo con el suelo o por su capacidad concentradora (Burlo, et al., 1999; Mengel, et al., 2001). Se desarrolló y validó una metodología para la determinación de contaminantes inorgánicos en lechuga, manzana, tomate y zanahoria utilizando ácido diluido e introduciendo el uso de la técnica novedosa (HG-MIP OES) para la determinación de As. Esta plataforma analítica, amigable con el ambiente, aporta una herramienta práctica al sector productivo y organismos de contralor para el monitoreo de la inocuidad de alimentos en Uruguay.
Materiales y Métodos
Reactivos
Para las determinaciones de los analitos se utilizaron disoluciones estándar para absorción atómica de 1000 mg L-1 de As, Cd y Pb (Merck, Alemania). Las curvas de calibración fueron preparadas mediante diluciones apropiadas a partir de las disoluciones comerciales concentradas, utilizando agua ultrapura de resistividad 18,2 MΩcm (ASTM Tipo I), obtenida mediante un purificador Millipore Direct-Q 3 UV. Todo el material utilizado se descontaminó previamente durante 12 horas con ácido nítrico 10% v/v preparado a partir de HNO3 concentrado (67% v/v, Merck, Alemania).
Todos los reactivos utilizados fueron de calidad analítica o superior. Para las determinaciones de As se utilizó NaBH4 2% m/v (Sigma Aldrich, USA) en hidróxido de sodio 0,5% m/v preparado a partir de NaOH (Mallinckrodt, México). Para el proceso de prerreducción se utilizó HCl 12 mol L-1 (Merck, Alemania) y KI 20% m/v (Carlo Erba, Francia). Como modificadores de matriz para las determinaciones de Cd y Pb se utilizaron disoluciones de Pd (NO3)2 (Merck, Alemania) 10000 mgL-1 y NH4H2PO4 5000 mgL-1 (Sigma Aldrich, USA).
Muestras
Las muestras de frutas y hortalizas frescas fueron tomadas del Mercado Modelo de Montevideo, entidad que comercializa más del 60% de los vegetales frescos en Uruguay. Se siguió un protocolo estandarizado de selección al azar de los operadores del Mercado, donde cada muestra es representativa del total del volumen a la venta del día. Los muestreos fueron realizados durante las primeras horas de operación y, simultáneamente, se realizó una encuesta complementaria según la Metodología de Evaluación de Cadenas Agroalimentarias (MECA) (La Gra, et al., 2016). En el caso de lechuga se seleccionaron aleatoriamente cinco unidades de distintos cajones, y para manzana, tomate y zanahoria se tomaron muestras de al menos 1 kg, siguiendo el mismo criterio de aleatoriedad. Las muestras fueron envasadas en bolsas de polietileno virgen, precintadas, codificadas y llevadas al laboratorio donde se procedió al cuarteo y submuestreo (100-200 g) en el mismo día. Luego fueron cortadas con cuchillo de cerámica sobre superficie plástica y secadas en estufa de circulación forzada Modelo DN93 (Yamato, Tokio, Japón) a 70 ℃ por 96 horas. Una vez secas fueron procesadas en un molino de martillos Willey Model 4 (Thomas Scientific, NJ, USA), tamizadas en malla de tamaño de partícula de 1 mm, acondicionadas en tubos plásticos y mantenidas en condiciones de baja humedad hasta el momento del análisis.
Para la optimización y la evaluación de la veracidad y precisión de las metodologías analíticas se utilizaron dos materiales de referencia certificados: hojas de espinaca (NIST 1570a) y hojas de tomate (NIST 1573a).
Digestión de muestras
Se realizó una digestión asistida por microondas utilizando un digestor CEM (Mars 6, EUA). El procedimiento consistió en pesar 0,5 g de muestra (seca y tamizada) en vasos de reacción EasyPrep Plus® y luego se agregaron 10,00 mL de ácido diluido (HNO3 4,8 mol L-1). La programación de temperatura fue la siguiente: potencia 400-1800 W, rampa de temperatura: 15 min hasta alcanzar 200 ℃, 10 min a 200 ℃, presión 500 psi. Se realizaron blancos de reactivos simultáneamente con las muestras.
Una vez finalizada la digestión se trasvasó cuantitativamente y se completó a un volumen final de 20,00 mL con agua ultrapura. Sobre esta disolución se realizaron las determinaciones analíticas de los As, Cd y Pb. El procedimiento fue el mismo para las cuatro matrices analizadas.
Determinaciones analíticas
La determinación de As puede realizarse mediante la medida de su hidruro volátil que es generado luego de una reducción con tetrahidroborato de sodio (NaBH4) en medio ácido. Antes se requiere de un proceso de digestión para destruir los compuestos orgánicos de arsénico, y debido a que se utiliza ácido nítrico en el proceso este es oxidado a la especie As(V). Para la determinación de As total en una matriz es necesario que todo el elemento se encuentre en un mismo estado de oxidación. Dado que la formación de los hidruros es más favorable para los estados de oxidación más bajos, es necesario realizar una prerreducción de As (V) a As (III) fuera de línea con ioduro de potasio (KI) o cloruro de estaño (SnCl2) y luego una nueva reducción en línea con NaBH4 para la generación de hidruros (Welz y Sperling, 1999).
La prerreducción fue llevada a cabo con HCl 12 mol L-1 y KI 20% (m/v) en relación: muestra/estándar (10): HCl (1): KI (1). En primer lugar, se agregó HCl y se llevó a ebullición hasta una reducción de volumen del 50%, aproximadamente. A continuación, se reconstituyó el volumen original con agua ultrapura y se procedió al agregado del KI. Se dejó reaccionar una hora a temperatura ambiente antes de la realización de las medidas (Tanabe, et al., 2016; Mikheev, et al., 2017).
Las mediciones de As se realizaron mediante la técnica HG-MIP OES a 193,695 nm en un espectrómetro de emisión atómica inducido por microondas (MIP OES, Agilent 4210) con generador de nitrógeno (Agilent 4107) alimentado con un compresor de aire (DurrTechnik, Alemania). El equipo cuenta con una antorcha estándar y una cámara de nebulización multimodo (MSIS, Agilent) para la generación de hidruros. Esta cámara tiene dos canales, uno para la muestra y otro para el agente reductor. Las condiciones operativas utilizadas fueron: flujo de N2 0,7 L min- 1, velocidad de la bomba 30 rpm, posición de lectura 10 y tiempo de lectura 10 s.
Todas las muestras y blancos fueron analizados por triplicado.
En el caso de Cd y Pb las determinaciones se realizaron en un espectrómetro de absorción atómica con atomización electrotérmica (ETAAS) Thermo Scientific iCE 3500 (Cambridge, Reino Unido), equipado con módulo atomizador de horno de grafito calefaccionado transversalmente (GFS35Z), un módulo automuestreador (GFS33) y con aplicación de corrección de fondo basada en efecto Zeeman. Las longitudes de onda de medida utilizadas fueron 228,8 nm (Cd) y 283,3 nm (Pb). La cuantificación fue realizada utilizando como señal la absorbancia integrada (área de pico). En todos los casos se utilizaron tubos de grafito con recubrimiento pirolítico (Thermo Scientific) y gas argón 99,998% (Praxair, Uruguay).
En la Tabla 1 se muestran los programas de temperatura optimizados para ambos elementos.
Tabla 1. Programas de temperatura para las determinaciones de Cd y Pb.
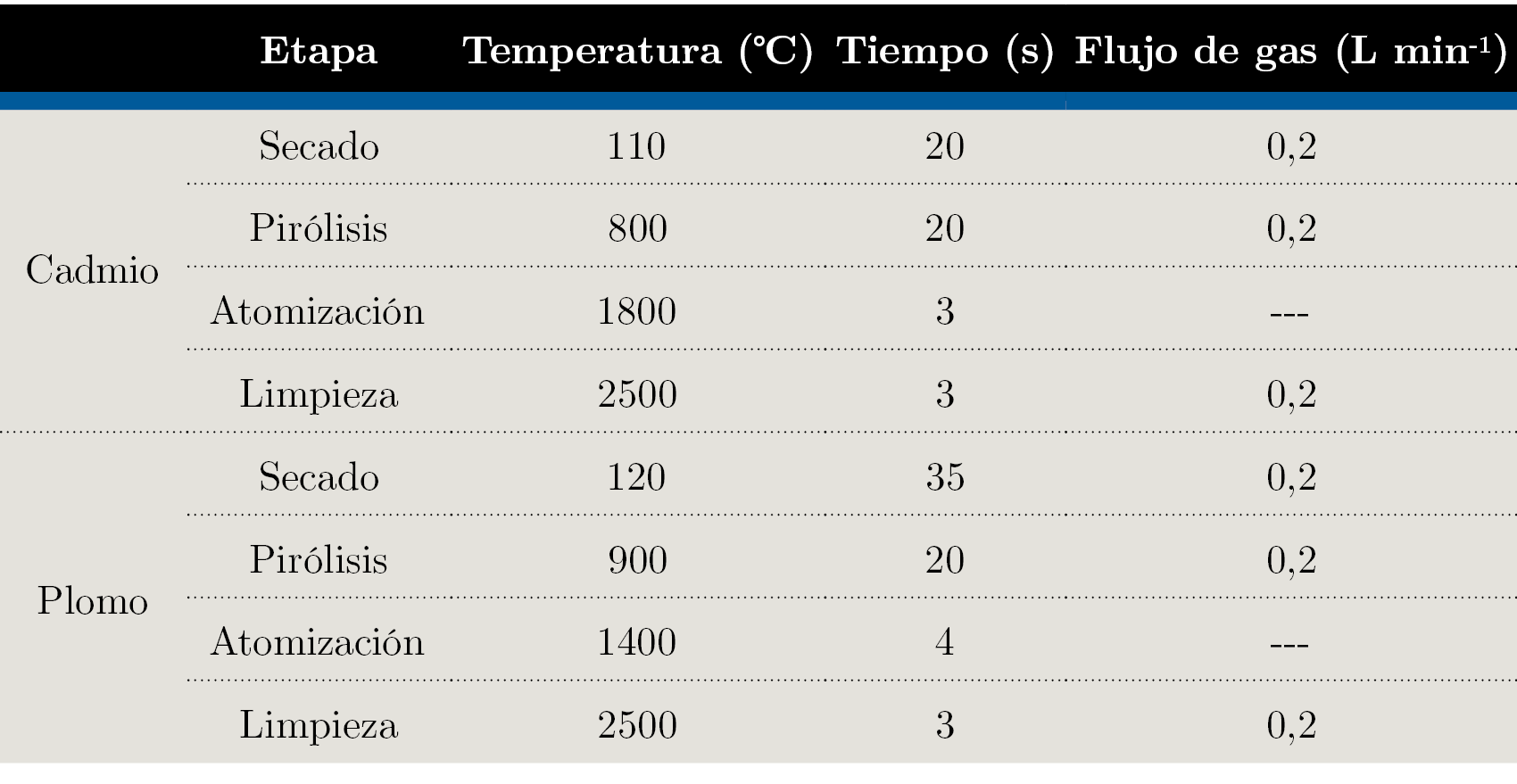
Los volúmenes de inyección fueron de 20 μL. Para la determinación de Cd, como modificador de matriz se utilizaron 10 μL de una disolución con un contenido de 5 μg de Pd(NO3)2. En el caso del Pb, se utilizó como modificador 10 μL de una mezcla de Pd(NO3)2 y NH4H2PO4 con 2,5 μg de Pd(NO3)2 y 25 μg de NH4H2PO4 .
Resultados
Para la caracterización y evaluación de la metodología desarrollada se determinaron los principales parámetros de desempeño o cifras de mérito (linealidad, límites de detección y cuantificación, precisión y veracidad) siguiendo las recomendaciones de la Guía Europea de validación Eurachem (Magnusson, et al., 2014). En todos los casos se mantuvieron las condiciones experimentales descriptas para cada uno de los analitos en la sección Materiales y Métodos.
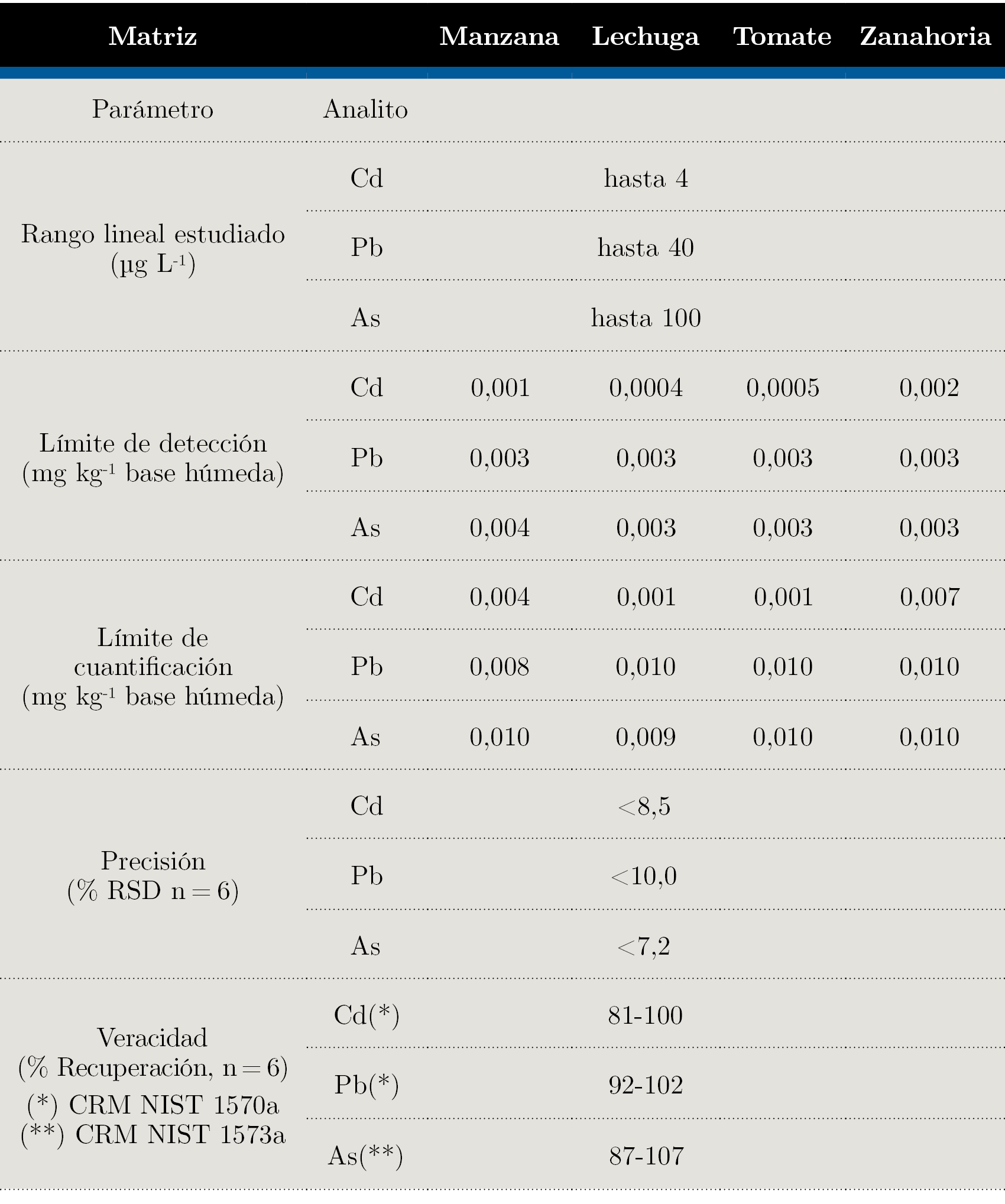
La linealidad fue determinada mediante inspección visual de las curvas de calibración, valor del coeficiente de determinación (R2) y el estudio de aleatoriedad de los residuales. Los coeficientes de determinación obtenidos para las regresiones lineales fueron mayores a 0,99 para todos los analitos en estudio en los rangos que se presentan en la Tabla 2.
Los límites de detección (LD) y cuantificación (LC) fueron expresados como el contenido del analito correspondiente a 3,3 y 10 veces la desviación estándar del blanco, respectivamente (Magnusson, et al., 2014). La precisión expresada como RSD (%) (desviación estándar relativa porcentual) fue estudiada utilizando los materiales de referencia certificados y las muestras, y se obtuvieron valores menores al 10% para todos los analitos en estudio.
La veracidad y la precisión fueron evaluadas analizando materiales de referencia certificados. Los métodos desarrollados fueron luego aplicados para el análisis de muestras de lechuga, manzana, tomate y zanahoria.
Se realizó la prueba t de Student para los resultados obtenidos a partir de las determinaciones de As, Cd y Pb en los materiales de referencia certificados, todos los valores experimentales de t se encontraron por debajo del valor teórico t (0,05, 5) = 2,57. Por lo tanto, a un nivel de significancia del 95%, las concentraciones obtenidas utilizando los métodos desarrollados no difieren significativamente de los respectivos valores certificados, con lo cual se garantiza la veracidad de los métodos.
La Tabla 2 resume los parámetros de validación obtenidos.
Tabla 2. Parámetros de desempeño de los métodos analíticos.
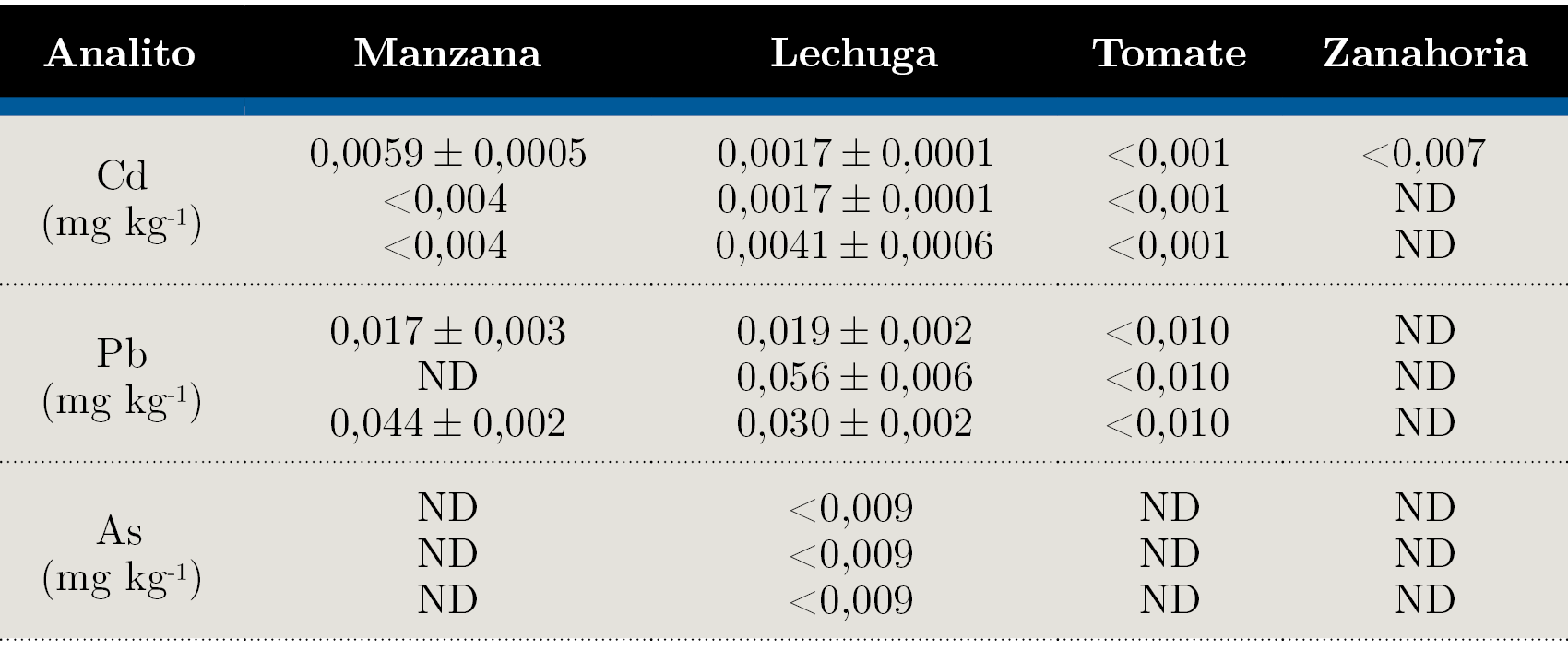
Se realizaron las determinaciones analíticas de As, Cd y Pb en las matrices en estudio utilizando la metodología desarrollada y validada. En todos los casos, como se muestra en la Tabla 3, los resultados de los analitos que pudieron ser cuantificados fueron menores a los límites máximos permitidos.
Tabla 3. Resultados promedio de muestras analizadas por triplicado en base húmeda. Incertidumbre expresada como desviación estándar. ND: no detectado.
Discusión
Teniendo en cuenta los valores máximos de concentración permitidos para los elementos en estudio (Cd 0,2 mg kg-1 para hortalizas de hoja y 0,1 mg kg-1 para frutas y demás hortalizas; Pb 0,3 mg kg-1 para hortalizas de hoja, y 0,1 mg kg-1 para frutas y demás hortalizas y As 0,3 mg kg-1 para frutas y hortalizas; MERCOSUR, 2011), es de destacar que los límites de detección y cuantificación obtenidos se encuentran entre uno y dos órdenes por debajo, por lo que la detectabilidad es más que suficiente para el objetivo propuesto.
El valor objetivo para la desviación estándar de un análisis determinado varía con la concentración de analito a medir y para estimarlo se puede establecer una relación funcional entre la concentración y la desviación estándar relativa (RSD). Esta ecuación conduce a una curva que se puede utilizar para estimar valores objetivo de desviación estándar relativa para los análisis (Rivera y Rodríguez, 2010). Para los niveles de concentraciones de trabajo según la distribución de Horwitz se esperarían resultados de precisión (RSD) de hasta 20%. Los RSD obtenidos para el método desarrollado fueron menores al 10% para todos los elementos, lo cual se considera muy bueno y, sumado a los resultados del estudio de veracidad, avala la aplicación del método para determinar la concentración de As, Cd y Pb en las matrices seleccionadas con fines de control sanitario.
La AOAC establece que las metodologías estándar para análisis de metales pesados en alimentos en una concentración hasta 100 mg kg-1 deben presentar un límite de cuantificación menor o igual a 10 mg kg-1, la veracidad evaluada como recuperación (ya sea de materiales de referencia o de muestras fortificadas) debe ser entre 60 y 115% y la precisión como %RSD debe ser menor a 15%. Para el caso de As, para valores de concentración hasta 100 mg kg-1 los requerimientos para límite de cuantificación y veracidad son los mismos que para metales pesados y la precisión como %RSD debe ser menor a 20% (AOAC International, 2016). En lo que respecta al tratamiento de la muestra, este método utiliza solamente ácido nítrico diluido (concentrado diluido tres veces) como reactivo. No utiliza ácidos concentrados ni reactivos auxiliares para la digestión como los métodos estándar, lo que disminuye los costos y la generación de residuos peligrosos. Un ejemplo que ilustra este aspecto es que para la determinación de As mediante el método oficial para la preparación de la muestra se requiere una calcinación en mufla a 450 ℃ con Mg(NO3) por 30 minutos como mínimo y luego de enfriar las cenizas se retoman en ácido clorhídrico concentrado. En la misma línea, para Cd y Pb las digestiones por el método oficial se realizan con ácido nítrico concentrado en sistemas cerrados durante 2 horas a 150 ℃ (AOAC 986.15, AOAC International, 2016).
Si bien cada vez se está extendiendo más el uso de tratamientos asistidos con microondas, se ha demostrado que puede realizarse utilizando un solo ácido diluido y que el mismo procedimiento es aplicable a diferentes matrices complejas. A partir de un mismo proceso de digestión se pueden realizar las medidas de todos los elementos, lo que ahorra tiempo de análisis, ya que la digestión de microondas se completa en 25 minutos y con los métodos oficiales los tiempos de digestión pueden llegar a ser de dos horas dependiendo del elemento en estudio (AOAC 986.15, AOAC International, 2016).
La técnica analítica utilizada para la determinación de As, HG-MIP OES, se aplicó exitosamente. Es una tecnología económica debido a que no utiliza argón como gas que genera y sostiene el plasma (como en las técnicas de ICP-OES o ICP MS), sino nitrógeno obtenido mediante un generador que lo produce a partir de aire suministrado por un compresor. Acoplar la generación de hidruros a la emisión atómica también resultó un desafío, debido a que tradicionalmente el acople se realiza con técnicas de absorción atómica (HG-AAS) que brinda límites de detección y cuantificación más bajos, sin embargo, los límites obtenidos son adecuados para el fin propuesto.
En base a lo expuesto anteriormente, los parámetros de desempeño obtenidos indican que los métodos analíticos desarrollados son adecuados para los fines propuestos. Su aplicación no solamente permite emitir resultados confiables y que aseguren la inocuidad del alimento desde el punto de vista del contenido de contaminantes inorgánicos, también es posible postular esta metodología como una alternativa más económica y simple en comparación con los métodos estándar ampliamente utilizados en los laboratorios.
Conclusiones
Se logró desarrollar una metodología analítica que permite la determinación de As, Cd y Pb en diferentes matrices vegetales mediante un tratamiento de muestra único y más amigable con el ambiente comparado con los métodos oficiales. El tratamiento cumple con todas las especificaciones de desempeño requeridas para ser una alternativa viable de análisis de contaminantes inorgánicos en vegetales, en lo relativo a detectabilidad, precisión y veracidad.
Todas las muestras analizadas cumplieron con los criterios establecidos en la reglamentación vigente (MERCOSUR, 2011).
Esta metodología pone a disposición una plataforma analítica fundamental para el sector productivo y para organismos de contralor, que hace posible detectar y cuantificar concentraciones muy por debajo de los límites máximos permitidos. De esta forma, no solamente se puede monitorear la inocuidad mediante la verificación del cumplimiento de la normativa, sino que también es posible conocer el contenido de estos contaminantes en los alimentos seleccionados y controlar los niveles de estos elementos.
Reconocimientos
Se agradece a la Agencia Nacional de Investigación e Innovación (ANII), Proyecto INNOVAGRO FSA_I_2017_1_140199.
Al Mercado Modelo por proveer las muestras.
A la Comisión Sectorial de Investigación Científica (CSIC) y a PEDECIBA.
