Autores
- Rodríguez Arzuaga, Mariana (1,2); Añón, María Cristina (2); Abraham, Analía Graciela (2).
- Latitud, Fundación LATU, Montevideo, Uruguay.
- Centro de investigación y Desarrollo en Criotecnología de Alimentos (CiDCA), La Plata, Buenos Aires, Argentina.
Las proteínas del lactosuero son sometidas a calor durante la producción de fórmulas infantiles. Su desnaturalización y agregación puede reducir la solubilidad, lo que tiene connotaciones funcionales, tecnológicas y nutricionales en el producto final. En este trabajo se estudió el efecto del tratamiento térmico y la presencia de caseína, lactosa e inulina –en las proporciones utilizadas en fórmulas infantiles– en la solubilidad de las proteínas. Dispersiones acuosas de aislado de proteínas del lactosuero (WPI), con o sin caseinato de calcio (CAS), inulina (INUL) y lactosa (LAC) se analizaron antes (STT) y luego del tratamiento térmico (TT) a 66 ℃, 75 ℃ y 85 ℃ durante 30 o 60 min. Los sistemas STT con mayor solubilidad fueron WP (89,3 ± 2,0% m/m) y WP - INUL (89,6 ± 1,8% m/m). La solubilidad de WP disminuyó con TT a partir de 75 ℃ -30 min y alcanzó una solubilidad mínima de 41,7 ± 1,2% m/m luego de 85 ℃ -60 min. WP - INUL mostró la misma tendencia. WP - LAC redujo su solubilidad con TT, aunque la caída en la solubilidad luego de 75 ℃ -60 min fue menor que en el sistema sin lactosa. CAS impidió la pérdida de solubilidad, que aumentó con TT hasta 75 ℃ -60 min (alcanzando 100% m/m en WP - CAS). Este estudio provee información relevante sobre el rol de los principales ingredientes no grasos de fórmulas infantiles en la pérdida de solubilidad de las proteínas del lactosuero.
Palabras clave: desnaturalización, agregación, fórmulas infantiles, proteínas, leche.
As proteínas do soro de leite são submetidas ao calor durante a produção de fórmulas para bebês. Sua desnaturação e agregação podem reduzir a solubilidade, que possui conotações funcionais, tecnológicas e nutricionais no produto final. Neste trabalho estudamos o efeito do tratamento térmico e a presença de caseína, lactose e inulina, nas proporções utilizadas nas fórmulas infantis, na solubilidade das proteínas. Dispersões aquosas de isolado de proteínas do soro de leite (WPI) foram preparadas, com ou sem caseinato de cálcio (CAS), inulina (INUL) e lactose (LAC). As dispersões foram analisadas antes (STT) e após tratamento térmico (TT) a 66 ℃, 75 ℃ e 85 ℃ por 30 ou 60 min. Os sistemas STT com maior solubilidade foram WP (89,3 ± 2,0% m/m) e WP - INUL (89,6 ± 1,8 % m/m). A solubilidade do WP diminuiu gradualmente com o TT de 75 ℃ -30 min, atingindo uma solubilidade mínima de 41,7 ± 1,2 % m/m após 85 ℃ -60 min. WP - INUL mostrou a mesma tendência. O WP - LAC reduziu sua solubilidade com TT, embora a queda na solubilidade após TT 75 ℃ -60 min foi menor do que no sistema sem lactose. A presença de CAS impediu a perda de solubilidade da proteína, que aumentou com o TT até 75 ℃ -60 min (atingindo 100% m/m no sistema WP - CAS). Este estudo fornece informações relevantes sobre o papel dos principais ingredientes não gordurosos das fórmulas infantis na perda de solubilidade das proteínas do soro de leite.
Palavras-chave: desnaturação, agregação, fórmulas infantis, proteína, leite.
Introducción
La leche humana es considerada el mejor alimento para los recién nacidos. Sin embargo, hay algunas situaciones en las que debe sustituirse o complementarse con fórmulas infantiles (Sabater, et al., 2016). Las fórmulas infantiles de inicio, destinadas a niños de hasta seis meses, están normalmente formuladas en base a leche bovina descremada adicionada de proteínas del lactosuero, lactosa, aceites vegetales, oligosacáridos, vitaminas y minerales, en concentraciones diseñadas para imitar el perfil nutricional de la leche materna. Las importantes diferencias composicionales entre las leches bovina y materna hacen necesaria la suplementación de la primera para la obtención de fórmulas infantiles con el perfil nutricional adecuado. La leche de vaca contiene una concentración de proteína total mayor que la leche humana, por lo que suele agregarse lactosa, pero también presenta una menor relación proteínas del lactosuero/caseínas que hace necesaria la fortificación con proteínas del lactosuero. Otra importante diferencia composicional es la presencia de oligosacáridos, que en la leche humana representan el tercer componente mayoritario, mientras que en la leche bovina se encuentra a nivel de trazas (Kunz y Rudloff, 2008; Fenelon, et al., 2019). Los oligosacáridos permitidos en la normativa europea vigente sobre fórmulas infantiles son los galacto - oligosacáridos (GOS) y los fructo - oligosacáridos (FOS) de cadena larga, o inulina con un grado de polimerización superior a 10 (Boehm, 2013; Unión Europea, 2016).
Durante la producción de fórmulas infantiles, la aplicación de tratamientos térmicos es una práctica común para asegurar la calidad microbiológica y prolongar la vida útil del producto. La intensidad de los tratamientos es variable, pero los más severos pueden derivar en desnaturalización de las proteínas del lactosuero, agregación y, finalmente, pérdida de solubilidad. La estabilidad térmica reviste gran importancia cuando concentrados lácteos o fórmulas infantiles son calentados antes del secado spray (Huppertz, 2016).
Las proteínas del lactosuero se caracterizan por su solubilidad, propiedades tecno - funcionales (emulsionantes, espumantes, gelificantes, capacidad de retención de agua) y su excelente valor nutricional debido a una combinación balanceada de aminoácidos esenciales y un alto score de digestibilidad (de Wit, 1998; Bouaouina, et al., 2006). Sin embargo, las proteínas deben ser solubles, de lo contrario sus propiedades funcionales se ven negativamente afectadas y su digestibilidad y biodisponibilidad reducidas (Anandharamakrishnan, et al., 2008; Pellegrino, et al., 2013). La pérdida de solubilidad durante el calentamiento depende de las condiciones del tratamiento térmico (temperatura, tiempo y tipo de calentamiento) pero también del pH, fuerza iónica, concentración proteica, presencia de otros componentes, entre otros (Packard y Morris, 1984; de Wit y Klarenbeek, 1984; Anandharamakrishnan, et al., 2008).
Dado que durante la producción de fórmulas infantiles están presentes componentes ausentes naturalmente en la leche bovina, y que la concentración relativa de proteínas del lactosuero/caseína y proteína total/lactosa está alterada, resulta de interés estudiar el efecto individual de cada uno de estos componentes en la pérdida de solubilidad de las proteínas del lactosuero durante su calentamiento. Por lo tanto, se propone como objetivo determinar los efectos de la composición y el tratamiento térmico en la pérdida de solubilidad proteica de sistemas modelo con WPI, caseína, lactosa y/o inulina.
Materiales y Métodos
Materiales
Para la preparación de los sistemas modelo se utilizaron como ingredientes: aislado de proteínas del lactosuero (WPI, Provon® 292, Glanbia Nutritionals Inc, Flitchburg, USA), caseinato de calcio (Lactoprot, Kaltenkirchen, Alemania), lactosa (Variolac® 850, Arla, Viby J, Dinamarca) e inulina con polimerización promedio ≥ 10 (Orafiti® GR, Beneo, Tienen, Bélgica). El contenido de proteína bruta (Nitrógeno total x 6,38), determinado por el método de Kjeldahl (International Organization for Standarization, 2014), fue 86,99% (m/m) en el WPI, 88,39% (m/m) en el caseinato de calcio y 2,03% (m/m) en la lactosa.
Para la preparación del reactivo de Bradford se utilizó Coomassie Azul Brillante G250 (Merck, Burlington, Massachusetts, USA). Para la preparación de soluciones estándar se utilizó seroalbúmina bovina (BSA; Merck, Burlington, Massachusetts, USA) y el WPI y caseinato de calcio con los que fueron preparados los sistemas modelo.
Preparación de los sistemas modelo
Se prepararon dispersiones acuosas que contenían WPI solo y con el agregado de caseinato de calcio, lactosa o inulina y todas sus combinaciones. Los cálculos de las concentraciones de los componentes individuales se realizaron de manera de obtener 25% (m/v) de sólidos totales en una mezcla húmeda con la formulación completa (proteínas del lactosuero, caseínas, lactosa, inulina y aceite). El aceite fue excluido de este estudio. La concentración de los componentes individuales se calculó en base al Reglamento Delegado (UE) 2016/127 (Unión Europea, 2016). En todos los sistemas modelo se mantuvieron fijas las relaciones másicas 1:5 de proteína total:lactosa y 60:40 de proteínas del lactosuero:caseína. La concentración de inulina utilizada corresponde al máximo nivel permitido de oligosacáridos totales en la normativa europea (Unión Europea, 2016).
Considerando el nivel de proteína total de cada componente, los insumos previamente pesados (Tabla 1) se agregaron lentamente a aproximadamente 300 mL de agua destilada a temperatura ambiente (aprox. 25 ℃) en agitación magnética. El orden de agregado de los componentes fue el siguiente: WPI - Caseinato de calcio - Lactosa - Inulina. Una vez incorporados los componentes, se agregó agua hasta un volumen final de 500 mL y se continuó agitando durante 30 min.
Tabla 1. Composición de los sistemas modelo para ensayos de solubilidad proteica.
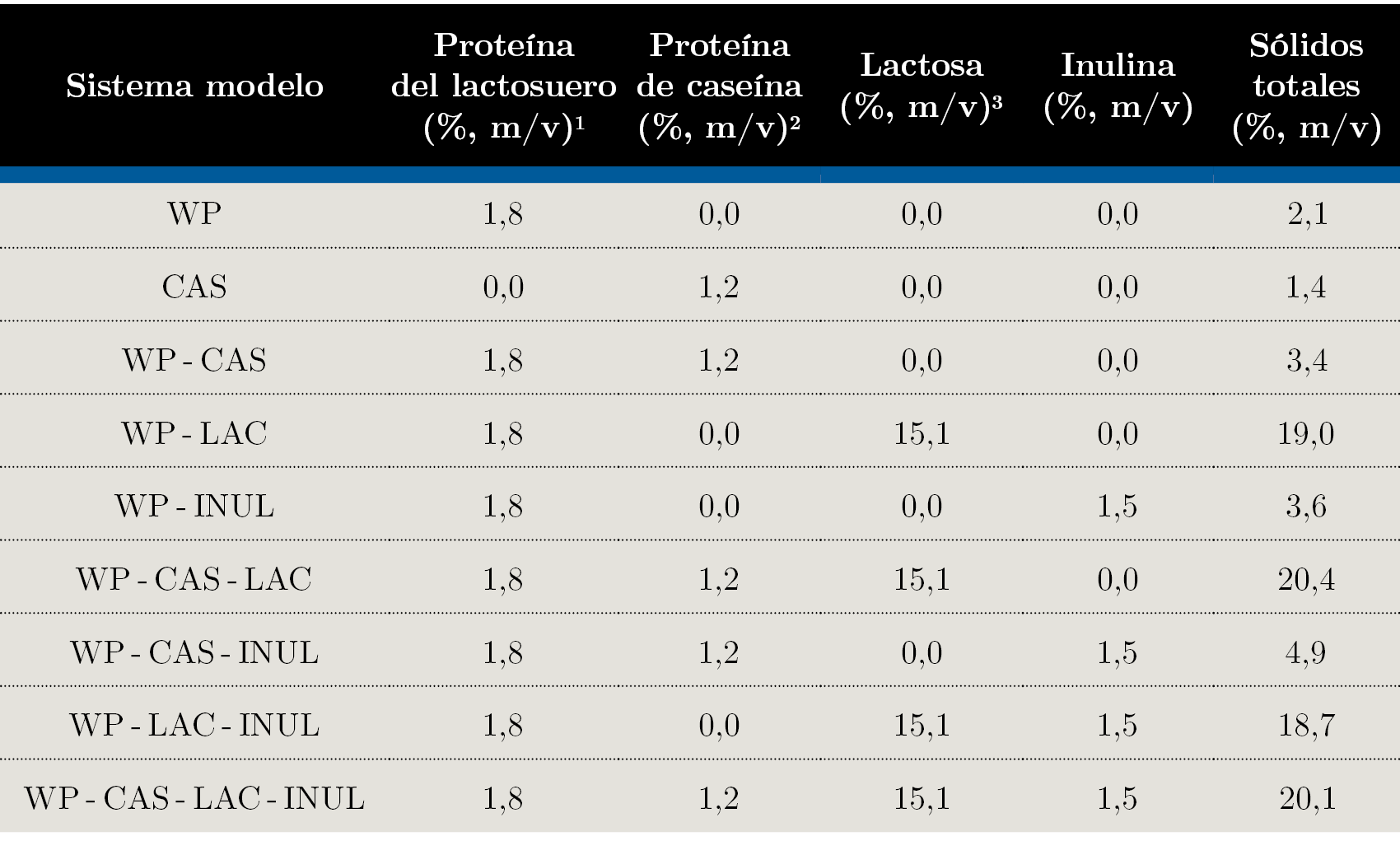
1Corresponde al contenido de proteína en el ingrediente WPI agregado.
2Corresponde al contenido de proteína en el ingrediente caseinato de calcio agregado.
3Corresponde al contenido de la lactosa en el ingrediente lactosa agregado.
Tratamientos térmicos
Las muestras se dividieron en submuestras de 40 mL en tubos Falcon de 50 mL de capacidad. Cada una de las submuestras se sometió a los siguientes tratamientos: 66 ℃ -30 min, 66 ℃ -60 min, 75 ℃ -30 min, 75 ℃ -60 min, 85 ℃ -30 min, 85 ℃ -60 min y sin tratamiento térmico (STT). El mínimo tratamiento térmico (66 ℃ -30 min) se seleccionó por corresponder a la pasteurización en batch para productos lácteos con un nivel de sólidos totales superior a 18% (Food and Drug Administration, 2017). Los tratamientos térmicos se realizaron en baño de agua con agitación (JP Selecta, Barcelona, España). Una vez cumplido el tiempo de calentamiento, las muestras se enfriaron rápidamente en baño de hielo y se llevaron a cámara de refrigeración (2 ℃) por 16 h.
Solubilidad proteica
La solubilidad proteica en los sistemas modelo se determinó de acuerdo a la Ecuación 1.
$$Solubilidad\thinspace proteica (\%, m/m) = {Contenido\thinspace de\thinspace proteína\thinspace soluble \over Contenido\thinspace de\thinspace proteína\thinspace total}\times100$$ (1)
Donde: el contenido de proteína total se calculó como la suma del contenido de proteína total (determinada por Kjeldahl) de cada uno de los ingredientes presentes en el sistema y el contenido de proteína soluble se determinó por el método de Bradford (1976).
Cuantificación de proteína soluble
Para la cuantificación de proteína soluble, cada sistema modelo se centrifugó durante 20 min a 10.000 x g a temperatura ambiente (aprox. 25 ℃) y se midió el contenido de proteína en el sobrenadante por el método de Bradford (1976).
Preparación de reactivo de Bradford
100 mg de Coomassie Azul Brillante G250 se diluyeron en 50 mL de etanol 95% (v/v) y 100 mL de ácido fosfórico 85% (m/m), antes de llevar a un volumen final de 1000 mL con agua destilada. El reactivo se conservó al resguardo de la luz.
Procedimiento analítico
100 μL de una dilución correspondiente del sobrenadante y 1000 μL de reactivo de Bradford, previamente filtrado a través de papel Whatman Nº1, se mezclaron en un tubo Eppendorf y a los 10 min se midió la absorbancia a 595 nm (espectrofotómetro Shimadzu UV - 2550, Tokio, Japón). Para el cálculo de la concentración de proteína soluble se utilizaron distintas curvas de calibración según la composición proteica del sistema modelo.
Curvas de calibración
Se prepararon soluciones estándar de BSA (0,35 μg μL-1), WPI (0,36 μg μL-1), caseinato de calcio (0,31 μg μL-1) y WPI : caseinato de calcio en relación 60:40 (0,15 μg WPI μL-1 y 0,096 μg caseinato de calcio μL-1), en agua destilada.
En tubos Eppendorf se agregaron volúmenes de solución patrón de entre 0 y 100 μL y el volumen de agua destilada correspondiente para completar 100 μL. En cada tubo se agregó 1000 μL de reactivo de Bradford, se agitó y se midió la absorbancia a 595 nm luego de 10 min de reposo. Cada punto de las curvas se determinó por triplicado. Se obtuvieron las cuatro curvas de calibración (A595 nm en función de la masa de proteína expresada en μg), que se utilizaron para el cálculo del contenido de proteína soluble. Las curvas de calibración se obtuvieron por análisis de regresión lineal por mínimos cuadrados utilizando el software Microsoft® Excel® 2013.
Análisis estadístico
Se realizaron análisis de varianza (ANOVA) para comparar los resultados entre los distintos sistemas o tratamientos. Se aplicó el test de Tukey (P < 0,05) para detectar diferencias significativas entre sistemas o tratamientos. Los análisis de datos se realizaron en el software Statgraphics Centurion XV (Addinsoft, New York, USA).
Resultados y Discusión
Adaptación del método de Bradford
El método de Bradford es una técnica rápida, sencilla, con alta sensibilidad y con muy pocas interferencias para la cuantificación de proteínas (Kamizake, et al., 2003), hecho por el cual se seleccionó para este estudio.
La seroalbúmina bovina (BSA) es comúnmente utilizada como estándar para la construcción de las curvas de calibración debido a que está disponible en su forma pura y su precio es accesible. Además, el hecho de ser ampliamente utilizada facilita la comparación con resultados con estudios previos. Sin embargo, la utilización de BSA como estándar puede subestimar el contenido proteico debido a que presenta una tinción inusualmente alta en el ensayo de Bradford. Por otro lado, la respuesta del método a las distintas proteínas es muy variable (Kruger, 1994). Por lo tanto, teniendo en cuenta que en este estudio la composición proteica difiere entre los distintos sistemas modelo, se decidió cuantificar la proteína soluble en cada sistema utilizando una curva construida con una solución de igual composición proteica que el sistema en cuestión. En la Figura 1 se presentan las curvas de calibración obtenidas para cada solución patrón. La curva de calibración obtenida con la solución patrón de BSA obtuvo la mayor pendiente, mientras que para una concentración dada de proteína total la curva de WPI presentó una absorbancia mucho menor. Por lo tanto, la utilización de una curva de BSA para todos los sistemas modelo redundaría en una subestimación del contenido de proteína.

Figura 1. Curvas de calibración para el método de Bradford obtenidas con soluciones patrón de seroalbúmina bovina (BSA), aislado de proteínas del lactosuero (WPI), caseinato de calcio y WPI:caseinato en relación 1,5:1.
Efecto de la composición en la pérdida de solubilidad de los sistemas modelo
Los sistemas sin tratar térmicamente (STT) con mayor solubilidad proteica fueron WP (89,3 ± 2,0% m/m) y WP - INUL (89,6 ± 1,8% m/m). Tanto el agregado de caseinato como de lactosa provocaron una reducción significativa de la solubilidad (Figura 2). La lactosa se encuentra en una proporción muy alta en los distintos sistemas (Tabla 1). Por lo tanto, la pérdida de solubilidad puede explicarse por una menor proporción de agua disponible para solubilizar las proteínas. El sistema CAS presentó una solubilidad de 102,0 ± 9,3% m/m. Este resultado indica que la reducción de solubilidad obtenida en los sistemas que contenían caseína no se debe a una menor solubilidad del caseinato. Posiblemente las caseínas interaccionen con las proteínas presentes en el WP y formen agregados insolubles.
El sistema WP - CAS - LAC - INUL presentó la menor solubilidad (63,2 ± 2,3% m/m). Este sistema contiene los cuatro componentes y, por lo tanto, tiene el mayor nivel de sólidos totales y la menor cantidad de agua disponible para la solubilización proteica.
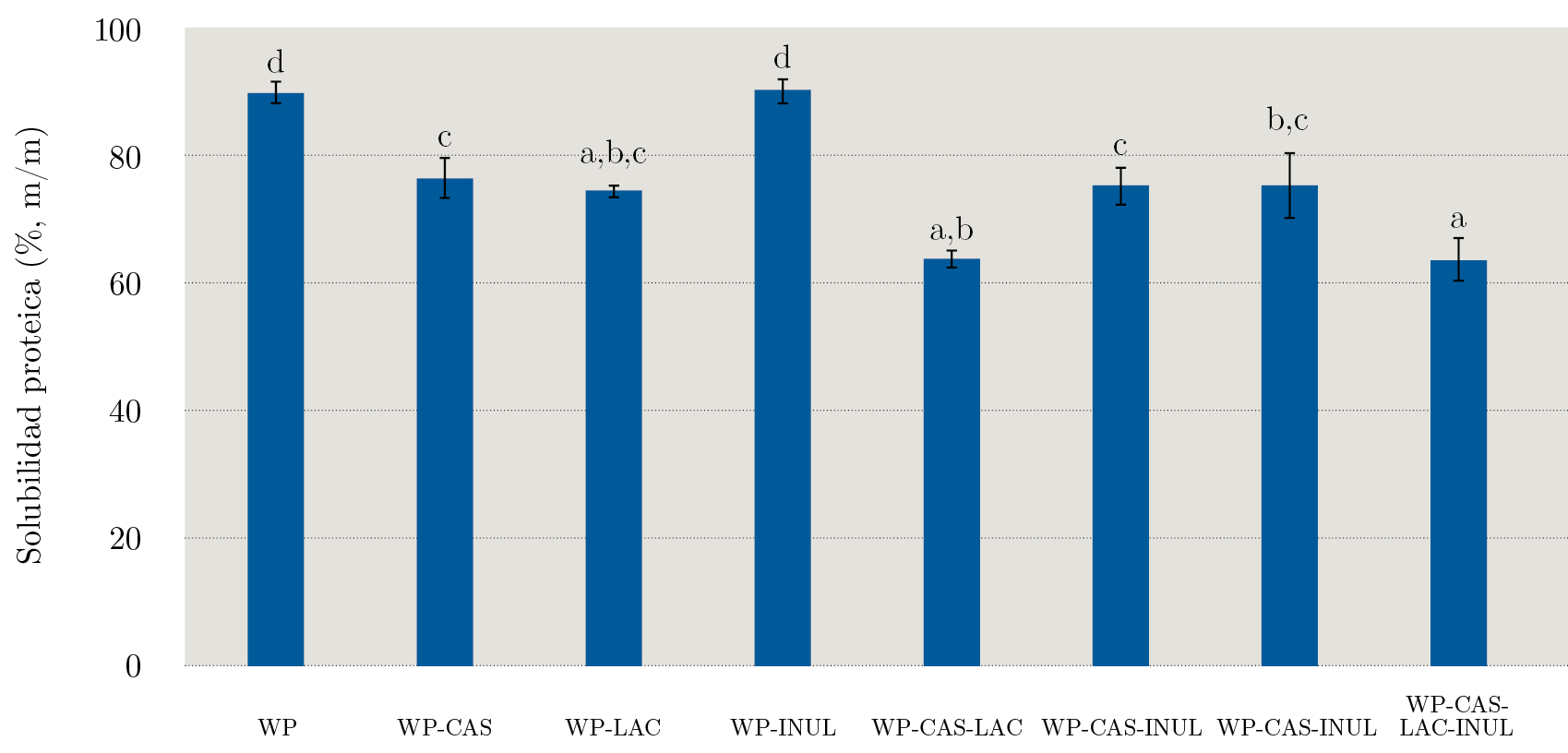
Figura 2. Solubilidad proteica de los sistemas modelo sin tratar térmicamente.
Letras distintas indican diferencias significativas (P < 0,05) entre sistemas.
Efecto del tratamiento térmico en la pérdida de solubilidad de los sistemas modelo
La solubilidad del sistema WP aumentó al tratarlo térmicamente a 66 ℃. El tratamiento a 75 ℃ -30 min redujo la solubilidad en un 39%, luego se observó una disminución paulatina con el incremento de la intensidad del tratamiento térmico (Figura 3a). Las proteínas del lactosuero son proteínas globulares con altos niveles de estructura secundaria y terciaria y son, por lo tanto, susceptibles a desnaturalización. El mecanismo de desnaturalización de la β - lactoglobulina (proteína del lactosuero mayoritaria) ha sido ampliamente estudiado. A temperaturas de aproximadamente 65 ℃ la β - lactoglobulina sufre desnaturalización reversible, pero a temperaturas mayores a 70 ℃ comienza una serie de reacciones de agregación que conducen a una desnaturalización irreversible. Inicialmente las reacciones de agregación involucran la formación de enlaces disulfuro intermoleculares, mientras que en una segunda etapa también intervienen interacciones no covalentes, incluyendo enlaces hidrofóbicos e interacciones electrostáticas (Fox, et al., 2015).
El sistema WP - LAC presentó una pérdida de solubilidad mucho menor que WP hasta el tratamiento a 75 ℃ -60 min (12% respecto a la solubilidad inicial) y el descenso drástico se observó luego del tratamiento a 85 ℃. Comparando el comportamiento de los sistemas WP y WP - LAC se observa que, si bien la solubilidad inicial del sistema WP - LAC es menor (debido al mayor contenido de sólidos), la presencia de lactosa reduce la pérdida de solubilidad de las proteínas del lactosuero (Figura 3a). De hecho, luego de un tratamiento térmico a 75 ℃ por 60 min el sistema WP presentó una solubilidad de 54,8% m/m mientras que la correspondiente al sistema WP - LAC fue 61,9% m/m. Este resultado es coincidente con reportes previos. Anema et al. (2006) determinaron que al aumentar la concentración de lactosa, la velocidad de desnaturalización irreversible, tanto de la β - lactoglobulina como de la α - lactalbúmina, disminuye. Los autores explicaron este efecto por la teoría de la hidratación preferencial, de acuerdo a la cual la presencia de azúcares en niveles altos favorece la autoasociación de las proteínas. Esta autoasociación reduce el área superficial total y la energía libre del sistema. La disociación del dímero de β - lactoglobulina es el primer paso en la desnaturalización irreversible, por lo tanto, estos autores indican que el efecto estabilizador de la lactosa se debe a un cambio del equilibrio monómero - dímero, lo que favorece la presencia de estos últimos. Dissanayake et al. (2013) también observaron que la adición de lactosa aumenta la resistencia de las proteínas del lactosuero a la desnaturalización durante la aplicación de altas presiones hidrostáticas. Los autores concluyeron que la lactosa favorece las interacciones intramoleculares dentro de la estructura globular compacta de las moléculas proteicas, que de esta forma presentan menor reactividad en ambientes acuosos. Por otro lado, luego de calentamientos prolongados de proteínas y azúcares reductores, tales como la lactosa, si las condiciones de pH y actividad acuosa para la reacción de Maillard están dadas, los conjugados formados entre el grupo amino libre de la proteína y el extremo reductor del azúcar pueden inducir la formación de agregados insolubles (Cardoso, et al., 2019). Sin embargo, en este estudio no se observaron cambios de color durante el calentamiento de los sistemas modelo que contenían lactosa, lo que indicaría presencia de compuestos formados en etapas avanzadas de la reacción de Maillard. Probablemente esto se deba a que la actividad acuosa no era lo suficientemente baja como para propiciar la reacción.
Por otro lado, la presencia de inulina no redujo la pérdida de solubilidad de las proteínas del lactosuero. La solubilidad del sistema WP - INUL se mantuvo estable hasta el tratamiento 75 ℃ -30 min que produjo una reducción del 24,4%. A su vez, el sistema WP - LAC - INUL presentó un comportamiento similar al de WP - LAC, por lo que se puede concluir que el efecto protector de la lactosa se mantiene en presencia de inulina (Figura 3a).
Para estudiar el efecto del agregado del caseinato fue necesario estudiar la solubilidad y resistencia térmica de un sistema compuesto únicamente por caseinato de calcio (CAS). Como se observa en la Figura 4, este sistema mantuvo una solubilidad cercana al 100% m/m que no varió significativamente al aplicar los distintos tratamientos térmicos. Este resultado se explica por la alta resistencia térmica de las caseínas, las cuales no son susceptibles a desnaturalización térmica. Se ha reportado que el caseinato de sodio puede ser sometido a temperaturas superiores a 140 ℃ por más de 1 h sin que se observe ningún cambio fisicoquímico (Fox, et al., 2015). Sin embargo, el agregado de CAS produjo cambios en la resistencia térmica de las proteínas del lactosuero (Figura 3b). En los sistemas WP - CAS y WP - CAS - INUL se observó un incremento de la solubilidad proteica al aumentar la intensidad del tratamiento. Al comparar los resultados de WP - CAS y WP - CAS - INUL con sistemas similares sin caseinato (WP y WP - INUL), se observa claramente que en presencia de caseinato no hay una pérdida drástica de la solubilidad luego del tratamiento 75 ℃ -30 min. Incluso luego de un tratamiento muy severo, como el de 85 ℃ -60 min, el sistema WP - CAS presentó una solubilidad del 93,2% m/m (52% más alta que la de WP luego del mismo tratamiento) y WP - CAS - INUL una solubilidad del 95,2% m/m (53% más alta que la de WP - INUL luego del mismo tratamiento). Cuando la β - lactoglobulina se desnaturaliza, su grupo reactivo sulfihidrilo se expone y puede participar de reacciones de intercambio sulfihidrilo - disulfuro con otras proteínas del lactosuero desnaturalizadas y con la κ - caseína y/ la αs2 - caseína, debido a que estas caseínas contienen residuos de cistina (Wijayanti, et al., 2019). Por lo tanto, los resultados obtenidos en este estudio sugieren la existencia de una asociación preferencial entre las proteínas del lactosuero y las caseínas, lo que evitaría la formación de grandes agregados entre proteínas del lactosuero e impide su pérdida de solubilidad. Similarmente, otros autores han reportado que los agregados formados en presencia de caseínas y proteínas del lactosuero son de menor tamaño que aquellos formados por proteínas del lactosuero en ausencia de caseínas (Mounsey y O’Kennedy, 2009; Kehoe y Foegeding, 2011; Gaspard, et al., 2017).
Por último, en los sistemas con caseinato y lactosa (WP - CAS - LAC y WP - CAS - LAC - INUL) la solubilidad se mantuvo constante (P > 0,05) hasta luego del tratamiento 75 ℃ -60 min y presentó una reducción al tratarlos a 85 ℃ (Figura 3b).
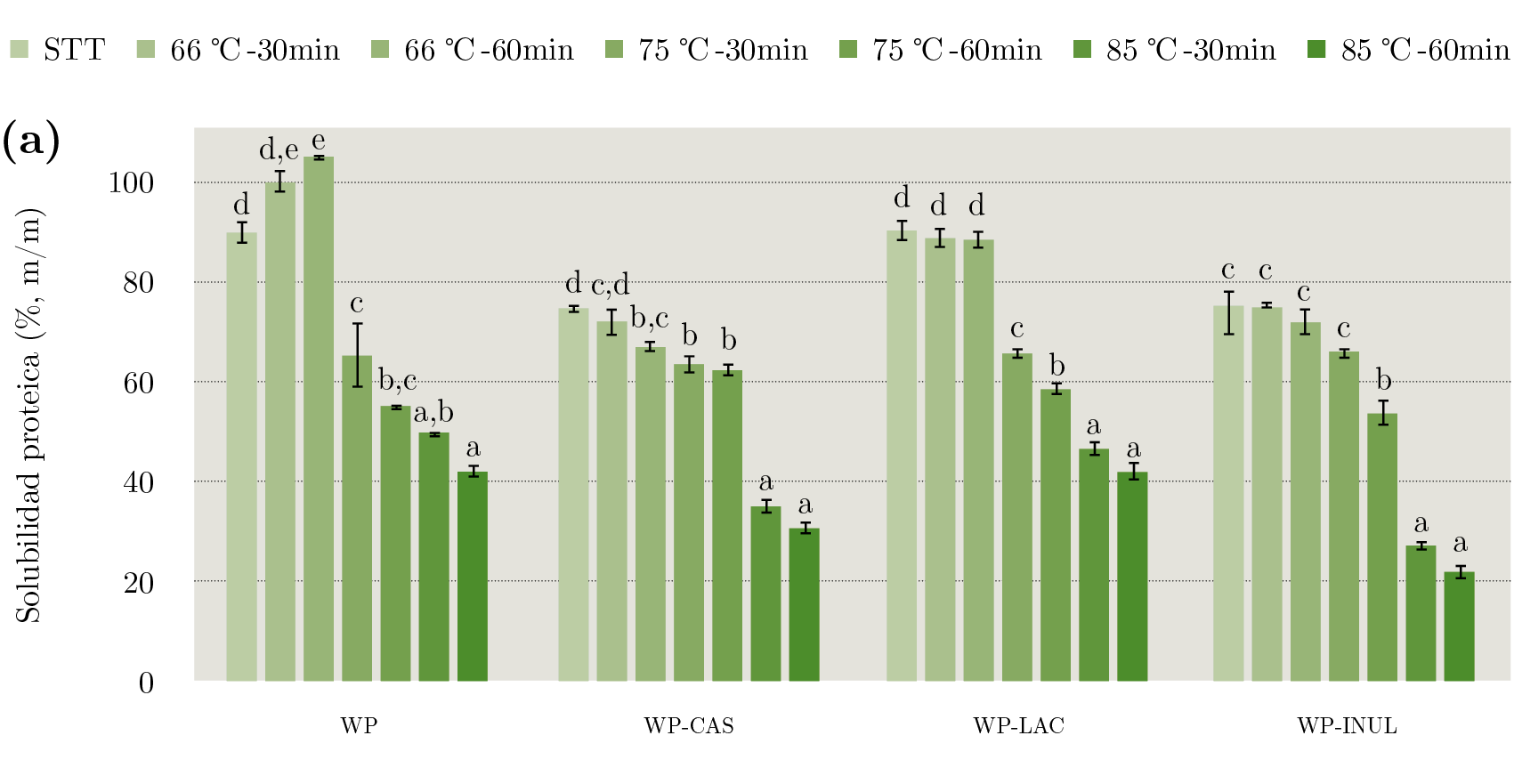
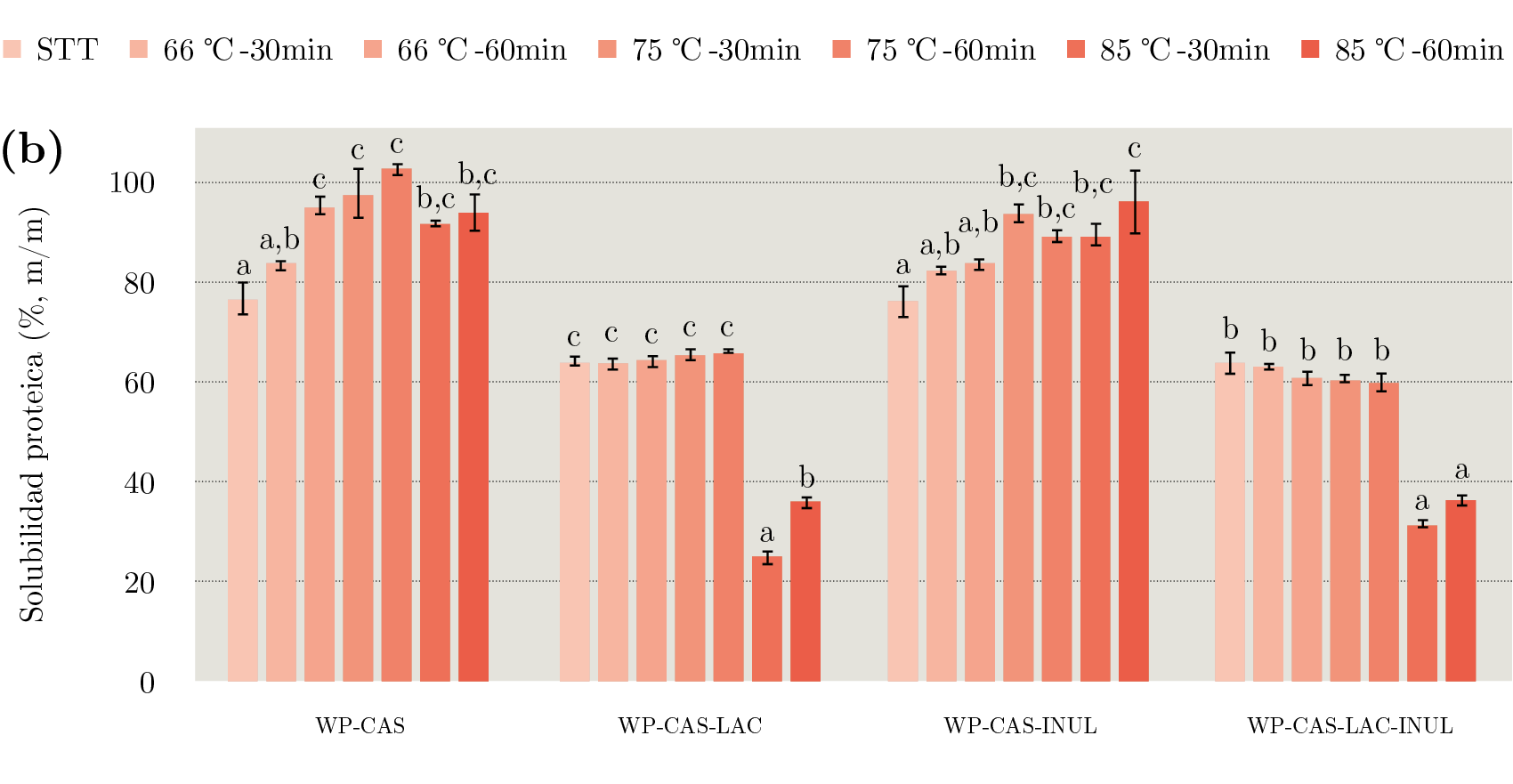
Figura 3. Solubilidad proteica de los sistemas modelo con WP (a) y WP - CAS (b) sin tratar térmicamente y tratados a 66, 75 y 85 ℃ por 30 y 60 min.
Letras distintas dentro de un mismo sistema indican diferencia significativa (P < 0,05) entre tratamientos.
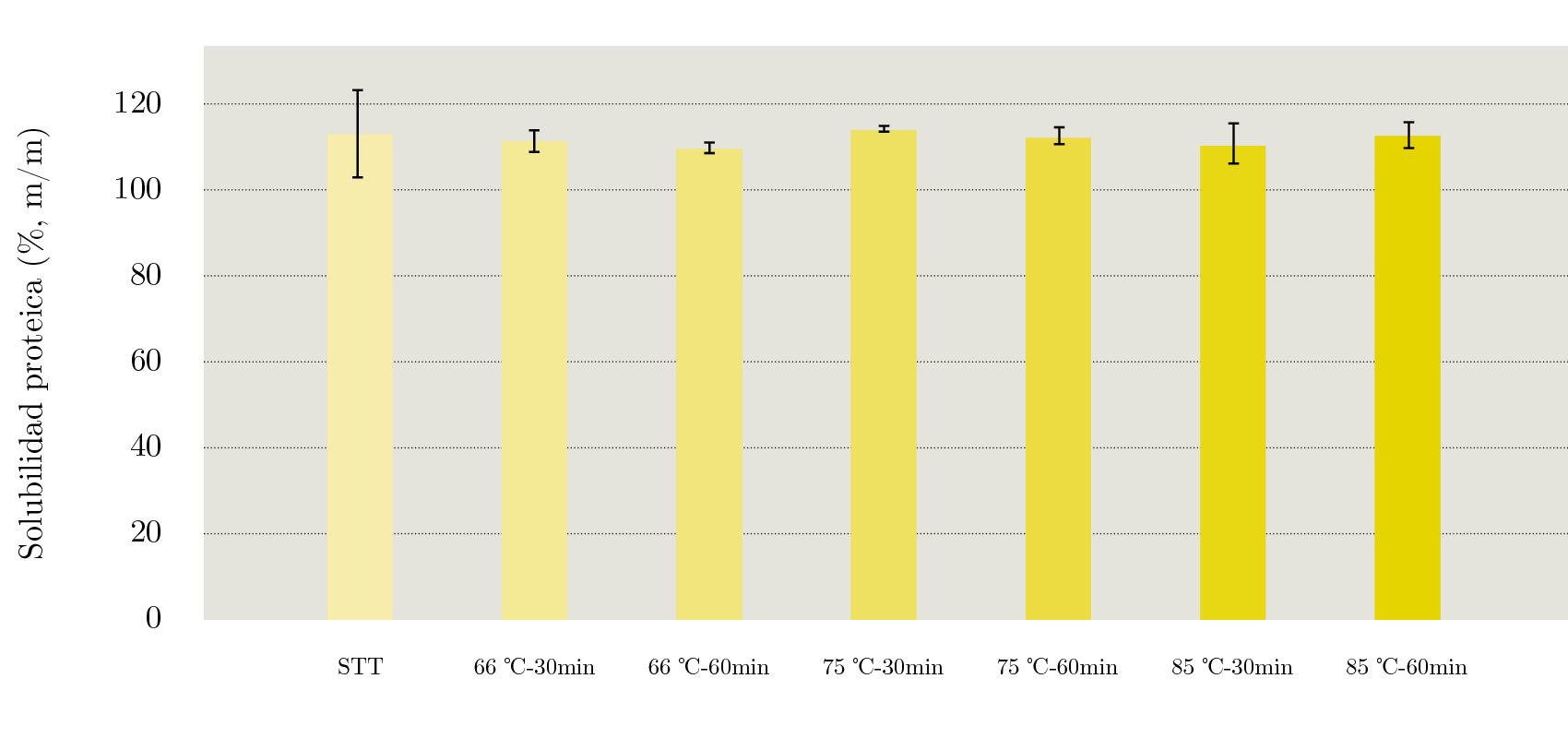
Figura 4. Solubilidad proteica del sistema CAS sin tratar térmicamente y tratado a 66, 75 y 85 ℃ por 30 y 60 min.
Conclusiones
Los resultados obtenidos en este trabajo mostraron que las proteínas del lactosuero presentan alta solubilidad en agua en sistemas sin tratar térmicamente y tratados a 66 ℃ durante al menos 60 min. Sin embargo, esta solubilidad cae abruptamente cuando el sistema es calentado a 75 ℃ por 30 min. La presencia de lactosa, a pesar de disminuir la solubilidad inicial del sistema, redujo la pérdida de solubilidad obtenida a 75 ℃. A su vez, la presencia de caseína, en la proporción encontrada en fórmulas infantiles, impidió la pérdida de solubilidad, y se obtuvo un 100% m/m de solubilidad en el sistema WP - CAS, incluso luego de un tratamiento a 75 ℃ por 60 min (47% mayor que en el sistema sin caseína). Finalmente, la presencia de inulina no afectó la solubilidad proteica en las condiciones estudiadas. Este estudio provee información relevante sobre el rol de los principales ingredientes no grasos de fórmulas infantiles y de las condiciones del tratamiento térmico en la pérdida de solubilidad de las proteínas del lactosuero. Futuros trabajos deberían centrarse en investigar los cambios conformacionales que ocurren durante el tratamiento térmico de los distintos sistemas modelo y que explican su pérdida de solubilidad.
Reconocimientos
Agradecemos a L&G S.A. (Montevideo, Uruguay) por la donación de la inulina utilizada en este estudio.
Este trabajo fue financiado por Latitud, Fundación LATU.
