Autores
- Torres, Ángela (1); Lebed, Melina (1); Arcia, Patricia (2); Curutchet, Ana (1); Cozzano, Sonia (1).
- Grupo de Ciencia y Tecnología de Alimentos, Departamento de ingeniería, Universidad Católica del Uruguay, Montevideo, Uruguay.
- Latitud – Fundación LATU, Montevideo, Uruguay.
Durante la elaboración industrial de jugo de granada se genera como subproducto su cáscara. Se plantea como objetivo revalorizar estas cáscaras por métodos de extracción verde utilizando antioxidantes solubles para recuperación de la fibra insoluble. La cáscara, secada y molida, fue sometida a un proceso de extracción con agua (65 ℃ por 30 min) y se obtuvieron dos fracciones: una soluble y otra insoluble. La fracción insoluble presentó un alto contenido de fibra (52,28 ± 2,99 g/100 g) y la fracción soluble un alto contenido de polifenoles totales de 1049,98 ± 3,98 mg ác. gálico/100 g, y una capacidad antioxidante contra los radicales ABTS de 1486,57 ± 0,05 μmol Trolox/g. Con la fracción soluble se formularon gelatinas y una bebida, con la fracción insoluble, galletas y muffins. Todas las formulaciones se desarrollaron sin azúcar, y las galletas y muffins se formularon para que cumplieran con el claim “fuente de fibra”. La aceptabilidad fue evaluada por consumidores (n = 100), de lo que resultó que las galletas y muffins fueron los más aceptados (7,0 y 6,3, respectivamente). Las cáscaras de granada fueron revalorizadas de forma que se obtuvieron nuevos ingredientes funcionales, lo que representa una oportunidad para la industria.
Palabras clave: granada, subproductos, fibra antioxidante, desarrollo de productos, aceptabilidad sensorial.
Durante a produção industrial de suco de romã, sua casca é gerada como um subproduto. Tem como objetivo reavaliar essas cascas por extração verde de antioxidantes solúveis e recuperação de fibras insolúveis. A casca, seca e moída, foi submetida a um processo de extração com água (65 ℃ por 30 min), obtendo duas frações: uma solúvel e uma insolúvel. A fração insolúvel apresentou elevado teor de fibras (52,28 ± 2,99 g/100g) e a fração solúvel apresentou alto teor de polifenóis totais de 1049,98 ± 3,98 mg de ácido gálico/100g e capacidade antioxidante Radicais ABTS de 1486,57 ± 0,05 μmol Trolox/g. Geléia e uma bebida foram formuladas com a fração solúvel, enquanto que os biscoitos e muffins com a fração insolúvel. Todos os productos foram formulados sem açúcar e bolachas e muffins para que cumpram com a alegação “fonte de fibra”. A aceitabilidade foi avaliada pelos consumidores (n = 100), sendo os biscoitos e muffins os mais aceitos (7,0 e 6,3, respectivamente). As cascas de romã foram avaliadas de forma sustentável e a baixo custo, obtendo novos ingredientes funcionais, representando uma oportunidade para a indústria.
Palavras-chave: romã, subprodutos, fibra antioxidante, desenvolvimento de produtos, aceitabilidade sensorial.
Introducción
En la producción industrial de jugo de granada una tonelada de fruta fresca genera 669 kg de subproducto que contiene 78% de cáscara y 22% de semillas (Qu, et al., 2009). En consecuencia, la cáscara de granada constituye hasta el 50% de la fruta entera y podría transformarse en una valiosa materia prima para la elaboración de alimentos funcionales.
La cáscara de granada contiene un alto contenido de polifenoles en comparación con su concentración en cualquier otra parte de la fruta, principalmente taninos hidrolizables (punicalina, punicalagina, ácido gálico y elágico) y flavonoides (antocianinas, catequinas y otras sustancias complejas) (Akhtar, et al., 2014). Estos compuestos ejercen efectos beneficiosos para la salud a través de su captación de radicales libres y su potencial antioxidante (Fischer, et al., 2010).
Además, la cáscara de granada es muy rica en fibra, especialmente insoluble. Actualmente, la fibra dietética (FD) se considera un nutriente (Bingham, et al., 2003). Debido a sus propiedades tecnofuncionales, fundamentalmente su capacidad de retención de agua, desempeña un papel importante en el proceso de digestión, lo que ayuda al movimiento de nutrientes en el intestino y reduce la incidencia de cáncer de colon (Bingham, et al., 2003).
Por otra parte, la gestión de residuos es uno de los principales desafíos que enfrentan la mayoría de las plantas de procesamiento de alimentos. La cáscara de granada, como subproducto industrial, no solo ocupa mucho volumen, sino que también libera olores y gases durante su descomposición, todo lo cual ha llevado al sector de la tecnología alimentaria a buscar soluciones (Castillo, 2010). Para lograr recuperar y utilizar los compuestos de interés presentes en las cáscaras, las tendencias van en la línea de generar tecnologías verdes y limpias para la protección del medio ambiente y dar a estos residuos un valor agregado (Castillo, 2010). La extracción verde se basa en el diseño de procedimientos rentables que reducen el consumo de energía, utilizan agua o solventes y productos naturales renovables, y garantizan un producto seguro y de alta calidad (Chemat, et al., 2012).
La recuperación y utilización de subproductos tiene tres objetivos claros: desarrollar productos naturales innovadores, obtener un beneficio económico irrefutable y lograr un impacto ambiental directo y positivo. El costo de oportunidad parecería evidente (Montgomery, 2004).
Desafortunadamente, la granada todavía está poco explotada en los sistemas alimentarios: la astringencia es el factor limitante clave. No obstante, sus innumerables beneficios incitan a llevar adelante mayor investigación para resolver este problema y a lograr su aprovechamiento (Akhtar, et al., 2014). Al momento de crear un producto el primer paso es conocer las expectativas del mercado. Está claro que el consumidor actual busca nuevas opciones saludables, pero no se puede ignorar que las características sensoriales son fundamentales para que las acepte. Por ende, el desarrollo de un nuevo alimento funcional enriquecido con compuestos activos presentes en la cáscara de granada requiere, por un lado, atributos de sabor aceptables y, por otro lado, que se lo presente acompañado de información nutricional visible con el fin de comunicar su valor nutricional y funcional.
Con estos antecedentes, el objetivo de este trabajo fue revalorizar el residuo de la producción de jugo de granada mediante la obtención de extractos ricos en antioxidantes y fibra, y de un proceso de extracción “verde” y simple. En paralelo, se desarrollaron formulaciones de alimentos funcionales incorporando estos extractos.
Materiales y Métodos
Obtención de harina de cáscara de granada
Las cáscaras de granadas frescas se obtuvieron como un subproducto de la producción de jugo. Se utilizaron las variedades Acco y Wonder, proporcionadas por la empresa uruguaya Granadas del Sol. Las cáscaras de dos lotes se secaron en un horno de convección a 50,0 ± 2,0 ℃ por 8 hs y luego se molieron en un molino de rotor de laboratorio de alta velocidad (Retsch ZM 200) para obtener un tamaño de partícula de menos de 1 mm.
Obtención de extractos
La harina de cáscara de granada fue sometida a un proceso de extracción acuosa del cual se obtuvieron dos fracciones: una soluble y otra insoluble en agua. La harina se mezcló con agua destilada (1:4, m/v) y la mezcla se colocó en un baño de agua a 65 ℃ por 30 minutos, de acuerdo a Gutiérrez et al. (2019). Luego, se centrifugó a 9500 rpm por 10 minutos a temperatura ambiente. Una vez llegado este punto, los sobrenadantes fueron separados de los sedimentos. La fracción soluble formada por los sobrenadantes fue liofilizada (Biobase Bioindustry Shandong Co. Model BKFD) y los sedimentos pasaron a formar la fracción insoluble, la cual se secó en estufa de convección durante 4 horas a 50 ℃.
Caracterización fisicoquímica
La harina de cáscara de granada, la fracción insoluble y la soluble fueron caracterizadas fisicoquímicamente. El contenido de humedad fue determinado por análisis gravimétrico en un horno de convección a 105 ℃ hasta peso constante. El contenido de proteína se determinó por el método de Kjeldahl (AOAC International, 2012a) y la fibra dietética total mediante el método AOAC 985.29 (AOAC International, 2012b). Para estimar la cantidad de grasa total se siguió el procedimiento ISO 6492:1999 (International Organization for Standarization, 1999). El análisis de cenizas se realizó en un horno de mufla siguiendo ISO 5984:2002 (International Organization for Standarization, 2002). Los carbohidratos totales fueron obtenidos por diferencia entre el peso total y la suma de los gramos de proteína, grasa, fibra, humedad y cenizas contenidos en 100 gramos de muestra.
Determinación de polifenoles totales y capacidad antioxidante
Se realizó la determinación del contenido total de polifenoles y la capacidad antioxidante de las tres partes (harina, fracción soluble y fracción insoluble).
Previo a los análisis se realizaron extracciones con etanol, para lo cual se colocaron 5 g de cada matriz (harina de cáscara de granada, extracto soluble e insoluble) en tubos de centrífuga cubiertos con papel de aluminio. Luego se agregaron 25 mL de etanol al 96% con posterior homogeneización en Ultraturrax (5 min). Las soluciones se centrifugaron a 9500 rpm durante 20 min a 4 ℃, y a continuación se realizó una filtración a matraces volumétricos de 100 mL. Sobre el precipitado en el tubo de centrífuga se repitió la adición de etanol al 96%, homogeneización, centrifugación y filtración, mezclando los sobrenadantes y completando hasta 100 mL con etanol al 96% cada matraz volumétrico. Este procedimiento se realizó por triplicado para cada matriz.
Contenido total de polifenoles
El contenido total de polifenoles se determinó utilizando el método de Folin-Ciocalteu. Se añadieron 0,5 mL de reactivo de Folin-Ciocalteu a tubos de ensayo, 6 mL de agua destilada y 1 mL de la muestra resultante de la extracción con etanol 96%, agitando cada vez. Luego se agregó 1 mL de carbonato de sodio (al 20%) y finalmente 1,5 mL más de agua destilada. Las mezclas se agitaron en Ultraturrax y se dejaron durante 90 minutos en la oscuridad. Para la curva de calibración se prepararon soluciones a partir de solución estándar de ácido gálico de 10 a 120 mg/l. Se midió la absorbancia a 765 nm. Los resultados se expresaron en mg ácido gálico/100g de muestra en base seca.
Capacidad antioxidante
La capacidad antioxidante se determinó a través de dos métodos diferentes: el ensayo del catión radical (ABTS+) y el análisis de la capacidad para la reducción férrica del plasma (FRAP). El primero consistió en un ensayo de decoloración de cationes radicales ABTS, según lo propuesto por Re et al. (1999) con modificaciones. Una solución acuosa 7 mM de ABTS (5 mL) se mezcló con 88 μL de solución acuosa 140 mM de persulfato de potasio y se dejó reposar en la oscuridad durante 16 horas para completar la formación del catión radical ABTS. La mezcla se diluyó en etanol/agua (50:50, v/v) hasta que la absorbancia a 734 nm fue de 0,7 ± 0,02 unidades en el espectrofotómetro (Shimadzu 1800 UV – Visible). Para la curva de calibración se prepararon soluciones de Trolox mezclando solución madre de Trolox en buffer fosfato sódico (2,5 mM) con etanol:agua (50:50, v/v), y se obtuvieron concentraciones que variaron de 0,0 a 2,0 mM. Tanto para las soluciones estándar de Trolox como para las muestras (extractos solubles etanólicos al 96% de harina, fracción soluble e insoluble), 30 μL de cada una se combinaron en tubos de ensayo con 3 mL de la solución de ABTS diluido, y se dejaron reposar durante 30 minutos en la oscuridad después de una correcta agitación en equipo Ultraturrax. La absorbancia se leyó a 734 nm en el espectrofotómetro. Los resultados se expresaron en μmol de Trolox por gramo de muestra en base seca.
El procedimiento FRAP se realizó basándose en el método descrito por Pulido et al. (2000). Para la preparación del reactivo FRAP, se utilizó una solución 10 mM de TPTZ [complejo férrico tripiridil triazina (Fe (III)] en HCl 40 mM, una solución 20 mM de FeCl3.6H2O y otra de tampón de acetato sódico anhidro 0.3 M, pH 3,6, las tres mezcladas en volúmenes iguales (1:1:1), generando un color ámbar. La solución se almacenó en oscuridad a 37 ℃ en un baño de agua hasta que fue utilizada. Para la curva de calibración, se prepararon soluciones acuosas de Trolox en concentraciones de 50 a 750 μM. Luego se mezclaron en tubos de ensayo alícuotas de 30 μl de agua destilada con 30 μl de muestra o solución estándar de Trolox y 900 μl de reactivo FRAP. Después de 30 minutos de descanso en la oscuridad a 37 ℃, se midió la absorbancia a 595 nm (Shimadzu 1800 UV-Visible). Los resultados fueron expresados en μmol de trolox por gramo de muestra en base seca.
Formulación de productos
Se desarrollaron cuatro alimentos funcionales. La fracción soluble se utilizó como ingrediente en la producción de gelatinas y de una bebida, mientras que la insoluble se incorporó a galletas saladas y muffins. Todos los productos fueron formulados sin azúcar. Las galletas y muffins se formularon para que cumplieran con el claim “fuente de fibra”, según lo establecido en el MERCOSUR (2012).
En ensayos preliminares se probaron diferentes combinaciones de ingredientes y en las galletas se evaluaron diferentes grosores y temperaturas de horneado. El resultado son las formulaciones finales que se presentan en las Tablas 1, 2, 3 y 4.
Tabla 1. Formulación de galletas.
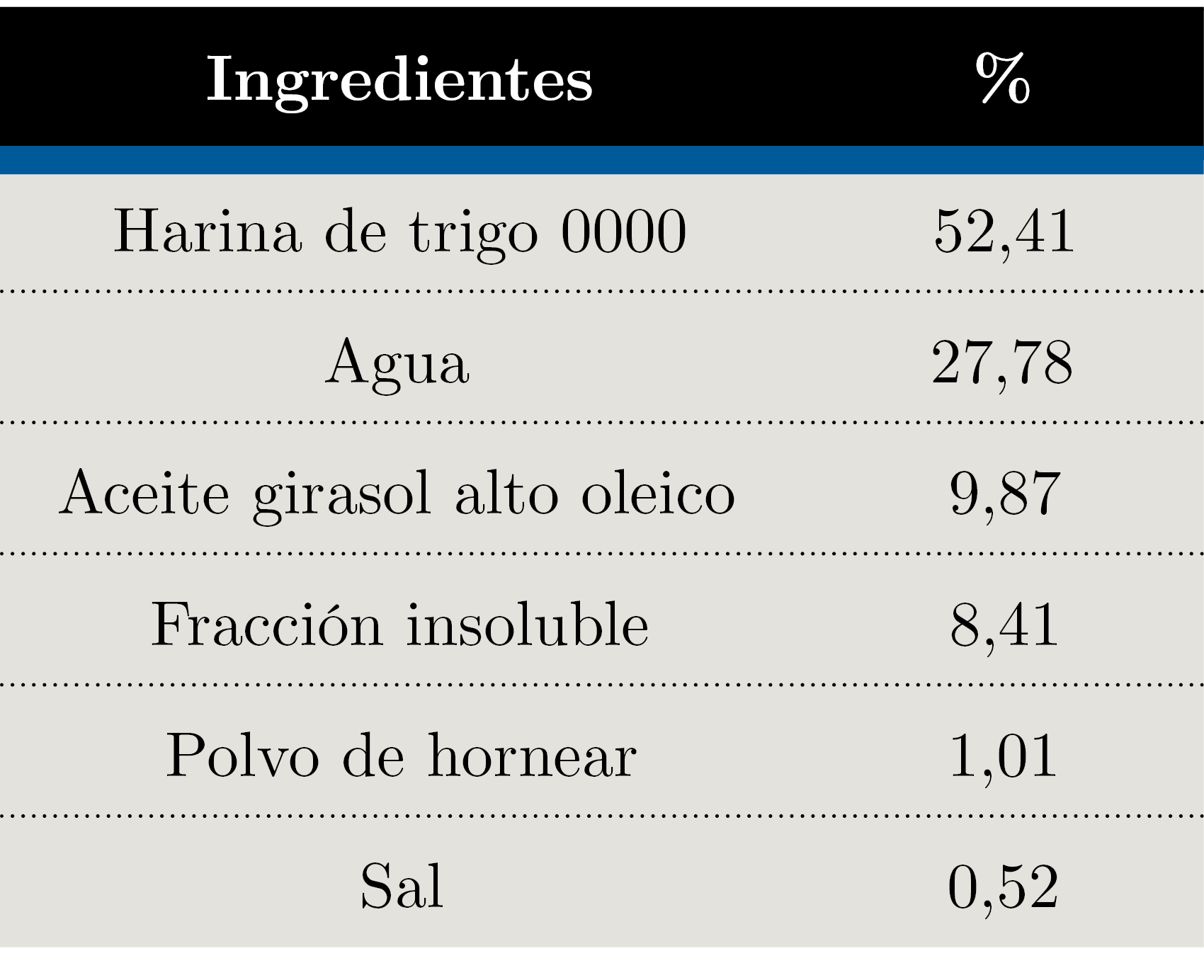
Tabla 2. Formulación de muffins.
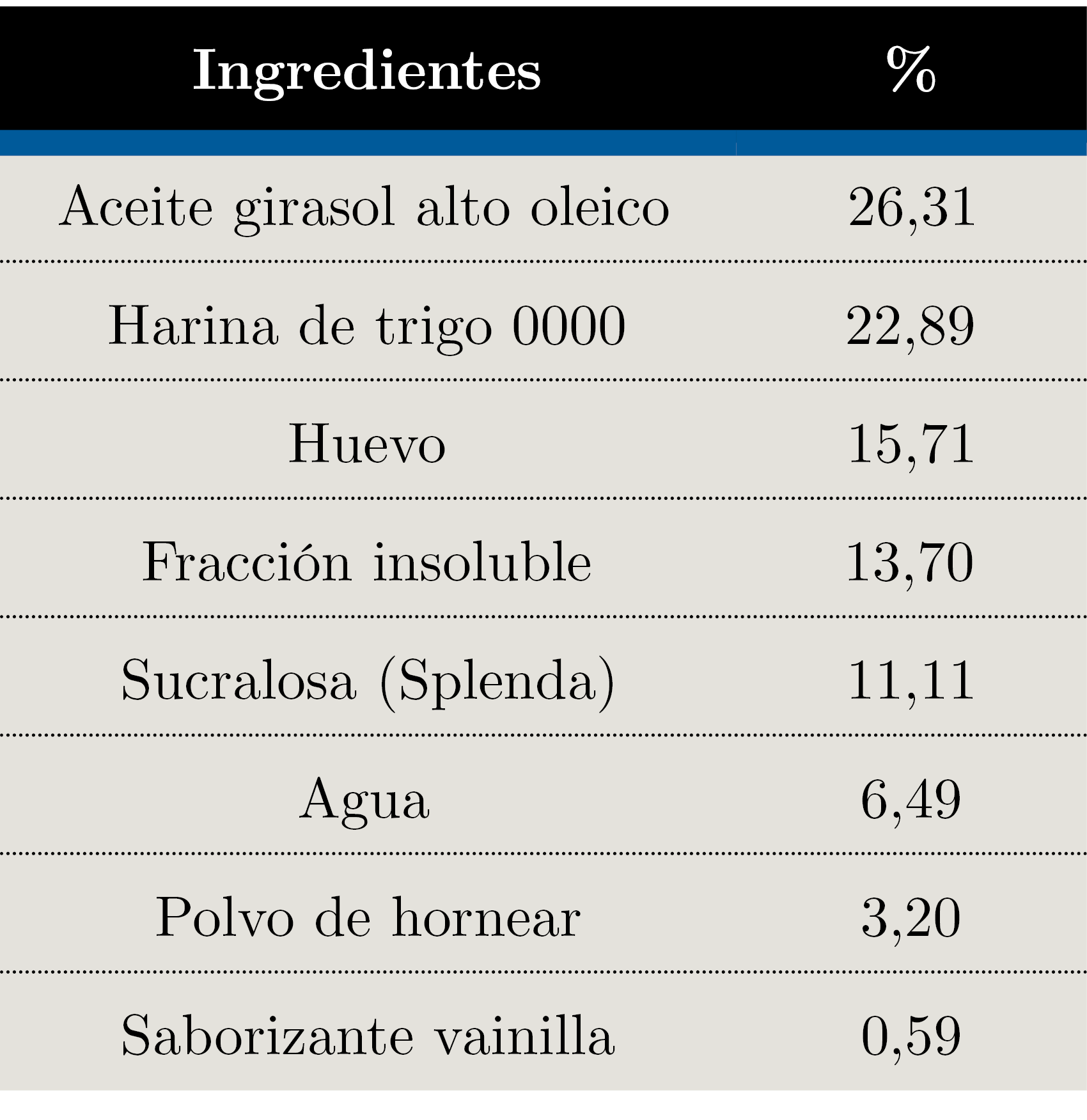
Tabla 3. Formulación de gelatinas.
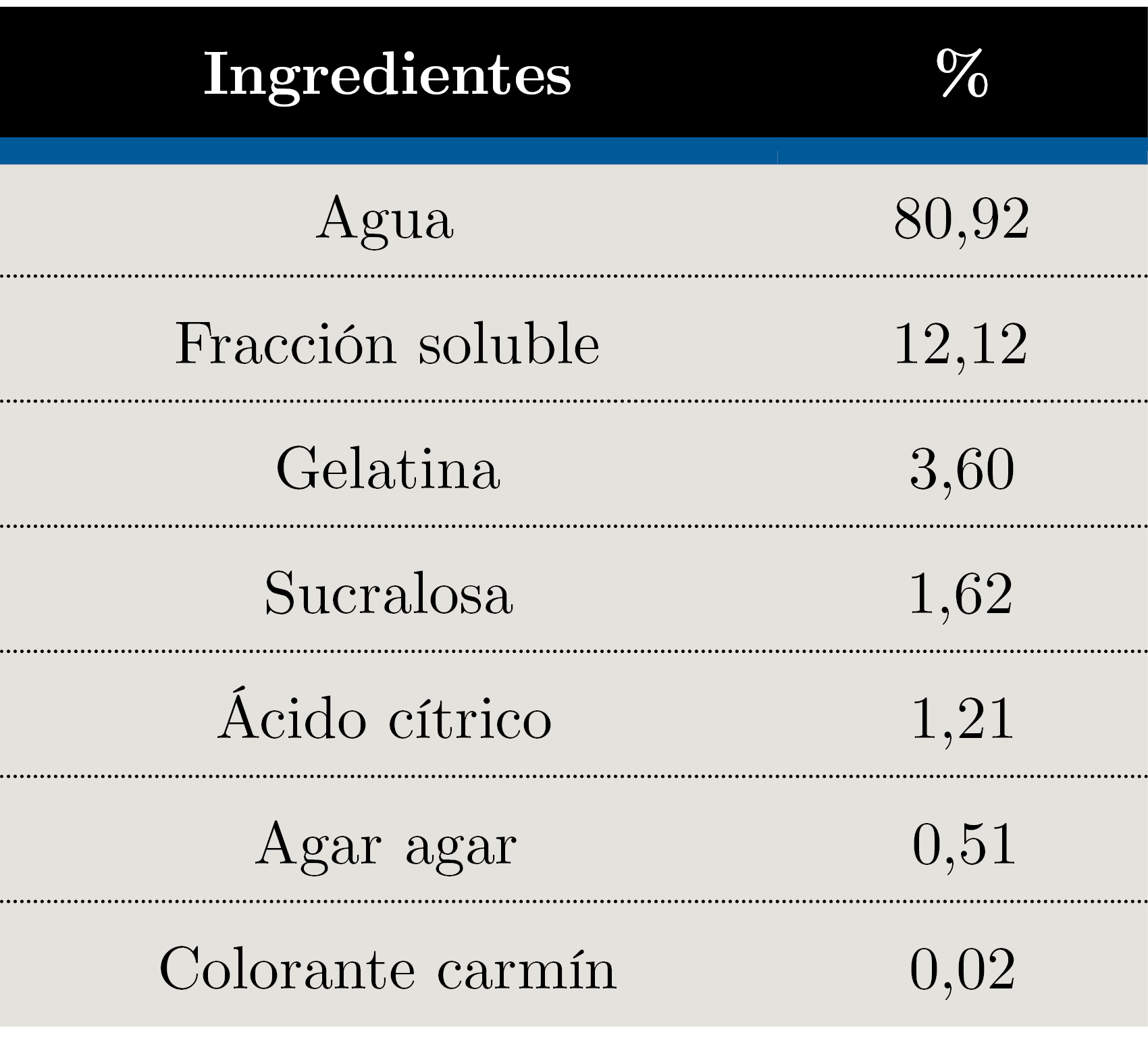
Tabla 4. Formulación de bebida.

Cabe destacar que el orden de incorporación de los ingredientes en el caso de las gelatinas influye en la textura y consistencia, por lo que luego de recurrir a varias formulaciones se obtuvo el siguiente orden óptimo. Se mezcla inicialmente la gelatina (en forma de polvo) con agua a temperatura ambiente, luego se somete la mezcla a temperatura y al observar la primera burbuja de ebullición se agrega el agar-agar. Se continúa revolviendo hasta que hierve totalmente y una vez homogenizada la mezcla se retira del calor. En este momento se agrega la fracción soluble, sucralosa, ácido cítrico y colorante natural carmín (en ese orden) y se mezcla hasta que no queden grumos y quede todo unificado. Por último, se vierte la solución en moldes de silicona. Con respecto a los productos horneados, las galletas fueron horneadas durante 15 min a 180 ℃, mientras que los muffins se hornearon a 180 ℃ por 20 min.
Evaluación sensorial
Los cuatro productos fueron sometidos a análisis sensorial con el fin de determinar su aceptabilidad. Los atributos sensoriales fueron evaluados por consumidores (n = 100 para cada producto), quienes los probaron y posteriormente completaron un cuestionario, teniendo a disposición la etiqueta de cada producto con su respectiva información nutricional. La aceptabilidad se evaluó asignando puntajes de acuerdo con una escala hedónica de 9 puntos (desde 1 = “me disgusta mucho” hasta 9 = “me gusta mucho”).
De acuerdo al tipo de producto, se evaluaron atributos específicos mediante el uso de preguntas check-all-that-apply (CATA). Dentro de una lista presentada, los consumidores identificaron los atributos que consideraron que mejor describen cada producto.
La evaluación sensorial se llevó a cabo con estudiantes y trabajadores de la Universidad Católica del Uruguay, comprendidos en un rango de entre 17 y 63 años, consumidores frecuentes de cada tipo de producto.
Etiquetas
Para cada producto formulado se diseñaron sus correspondientes etiquetas con el fin de comunicar mediante ellas los ingredientes, la información nutricional y las características más relevantes asociadas al producto. Todos los productos se formularon “sin azúcar”, la bebida y gelatinas se definieron como alimentos “con antioxidantes naturales” y los muffins y galletas como “fuente de fibra”. Las etiquetas se muestran en la Figura 1.




Figura 1. Información proporcionada a los consumidores durante la evaluación sensorial:
(a) galletas, (b) muffins, (c) bebida, (d) gelatinas
Análisis estadístico
Los análisis fisicoquímicos de la harina, fracción soluble e insoluble se realizaron por duplicado, mientras que los funcionales se realizaron por triplicado. Todos los datos fueron expresados como la media ± desviación estándar. Se realizaron análisis de varianzas (ANOVA) para evaluar las diferencias entre harina, fracción soluble y fracción insoluble para cada análisis fisicoquímico y funcional. Las diferencias significativas fueron determinadas con el test de Tukey (p ≤ 0,05). Los análisis fueron ejecutados usando InfoStat (Versión 2018).
Resultados y Discusión
Caracterización fisicoquímica
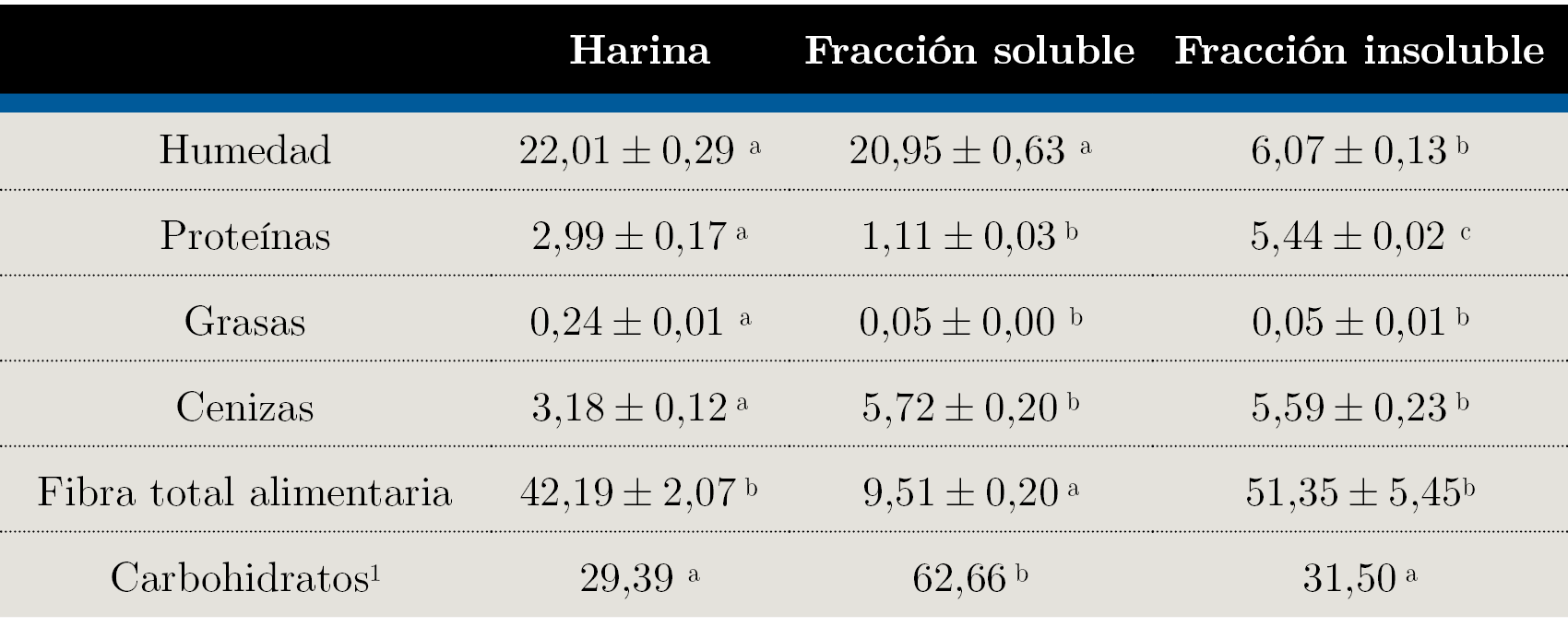
La composición fisicoquímica de las tres matrices analizadas se presenta en la Tabla 5.
Tabla 5. Composición fisicoquímica de la harina, fracción soluble y fracción insoluble. Resultados expresados en base húmeda (bh) como media ± ± desviación estándar, en g/100g.
1Contenido de carbohidratos determinado por diferencia.
Nota. Letras diferentes en una fila implican diferencias significativas entre muestras (p < 0.05).
Los valores de humedad, proteínas, grasas, cenizas y carbohidratos obtenidos son similares a lo reportado por Abid et al. (2016), quienes estudiaron distintas variedades de granada y establecieron rangos de resultados posibles correspondientes a cada característica fisicoquímica. Por un lado, concluyen que la cáscara de granada, independientemente de la variedad, no tiene aporte de grasa, lo cual coincide con los datos obtenidos en esta investigación. Por otro lado, establecen un contenido de cenizas que oscila aproximadamente entre 3,61 y 4,70% bh y uno de proteínas que se ubica entre 3,81 a 6,66% bh, los cuales también se asemejan a los valores obtenidos. Con respecto a los azúcares totales, Abid et al. (2016) afirman que estos se conforman principalmente de sustancias solubles, lo cual tiene coherencia con los valores de carbohidratos observados en la Tabla 5, que fueron determinados por diferencia (62,66 y 31,50 g/100 g bh para fracción soluble e insoluble, respectivamente). El azúcar que posee en mayor cantidad es la glucosa (probablemente de origen celulósico), seguido de manosa y xilosa. En cantidades menores se encuentra la arabinosa, galactosa, ramnosa y fructosa (Abid, et al., 2016).
La Tabla 5 revela un alto contenido de fibra alimentaria total, tanto para la harina como para la fracción insoluble y se aprecia una diferencia significativa entre la fibra presente en estos y en el extracto soluble. El extracto insoluble presenta 51,35 g/100g de fibra y se puede considerar una “fuente” de fibra dado lo reportado por Larrauri (1999), quien observó esta característica para matrices con fibra superior a 50%.
Según Gutiérrez et al. (2019), la cáscara de naranja presenta 43,0 g/100 g en base seca (bs) de fibra dietética total. Asimismo, Pérez et al. (2017) afirman que el subproducto del procesamiento de arándanos tiene 26,15 g/100 g bs. En comparación, tanto la harina de cáscara de granada como la fracción insoluble estudiada ofrecen una fibra alimentaria total superior: en base seca 54,10 g/100 g y 54,67 g/100 g, respectivamente.
Determinación de polifenoles totales y capacidad antioxidante
Los resultados de los análisis de polifenoles totales y capacidad antioxidante se presentan en la Tabla 6.
Tabla 6. Composición funcional de la harina, fracción soluble y fracción insoluble. Resultados expresados en base seca (bs) como media ±± desviación estándar.

Nota. Letras diferentes por fila implican diferencias significativas entre muestras (p < 0,05).
Tanto la fracción soluble como la harina no evidenciaron diferencias significativas en el contenido de polifenoles totales. La cáscara de granada se caracteriza por tener un elevado porcentaje de polifenoles y se destacan como componentes principales punicalina y punicalagina (elagitaninos) y flavonoides (Fischer, et al., 2010). Los flavonoides se encuentran en todas las plantas, pero están localizados principalmente en las vacuolas de las células de la piel de frutas y hortalizas y aportan parte del sabor y del color (Carreño, et al., 2015). Todos estos compuestos son solubles en agua y, consecuentemente, es muy probable que hayan sido extraídos en gran medida por ella y, por ende, pasado a estar en la fracción soluble. Esto explicaría la diferencia observada entre los polifenoles totales en ambas fracciones.
Por otro lado, la fracción insoluble presenta cierta cantidad de polifenoles totales y esto se podría explicar considerando dos aspectos. El primero de ellos es que en la cáscara se presentan compuestos insolubles tales como ácidos hidroxicinámicos e hidroxibenzoicos (derivados fenólicos) que también son detectados en este análisis (Ventura, 2012). El segundo se relaciona con el rendimiento de la extracción acuosa, es decir, con el hecho que el 100% de los polifenoles totales solubles presentes en la harina no pueden ser efectivamente extraídos mediante el método de extracción implementado, ya que durante el proceso de extracción de compuestos fenólicos una de sus partes queda embebida en la fibra. Según Saura-Calixto et al. (2010), los compuestos fenólicos se encuentran unidos a polisacáridos por interacciones hidrofóbicas y enlaces covalentes, haciendo necesaria la hidrólisis para su extracción. Se ha reportado que los compuestos que permanecen unidos a la fibra de cáscara de granada corresponden a taninos hidrolizables, como punicalagina, punicalina, pedunculagina, entre otros compuestos fenólicos, como ácido elágico, ácido gálico, rutina y quercetina (Middha, et al., 2013). Esto permite suponer que determinados polifenoles, a pesar de ser solubles, han podido haber permanecido en la fracción insoluble incluso luego de la extracción.
Al comparar los resultados con los obtenidos para otras cáscaras de frutas, como la naranja y el arándano, se observa que la cáscara de la granada es la que tiene mayor concentración de polifenoles totales. Mientras que la cáscara de naranja presenta 41,7 mg ac. gálico/g bs (Gutiérrez, et al., 2019) y la de arándano 285,14 mg ac. gálico/g bs (Pérez, et al., 2017), la harina constituída por cáscara de granada tiene 1043 mg ac. gálico/g bs, valor que es significativamente superior.
Los valores obtenidos por el ensayo de Folin-Ciocalteu son consistentes con los hallados en la bibliografía. El-Gharably y Ashoush (2011) detectaron 1096 mg ácido gálico/100g en cáscara de granadas de Perú. Devatkal et al. (2010) reportaron 585 mg ácido gálico/100g en extractos acuosos de granadas de la India, valor que ronda un orden similar al de los resultados obtenidos en el análisis de polifenoles totales. En el caso de El-Said et al. (2014), la extracción de la cáscara de granada con diferentes métodos y solventes dio lugar a un rango de polifenoles totales comprendidos entre 1398 hasta 1778 mg ác. gálico/100g.
Cabe destacar que el método de extracción ensayado en este trabajo se realizó en base acuosa, con el fin de usar métodos de bajo impacto ambiental. En la bibliografía se reporta el uso de otros solventes y la obtención de mejores resultados en lo que respecta a la solubilización de antioxidantes solubles. Un número considerable de fuentes sugieren que otros solventes como metanol, etanol y acetona brindan mayor rendimiento que el agua a la hora de extraer polifenoles. Ahmed (2012) reporta resultados obtenidos al investigar sobre extractos solubles metanoicos y etanoicos que parten de cáscara de granada que alcanzan valores de polifenoles totales de 86,7 g ác. gálico/100g y 12,434 g ác. gálico/100g, respectivamente, lo que significa una concentración de 8 a 12 veces mayor que los 1049,98 mg ác. gálico/100 g que ofrece la fracción soluble de este trabajo. Singh et al. (2002) extrajeron antioxidantes de la cáscara de granada con el uso de metanol, acetona y agua y encontraron que el metanol fue el solvente con mayor rendimiento. Li et al. (2005) consideran que la forma más eficiente de extraer antioxidantes es utilizar una combinación de diferentes solventes, ya que la solubilidad de cada antioxidante puede diferir según el solvente. De hecho, en un estudio realizado mostraron que el extracto obtenido mediante el uso de una mezcla de metanol, etanol, acetona y agua tuvo un valor de FRAP significativamente más alto que los extractos obtenidos utilizando los solventes solos. Este resultado indica que la mezcla de distintos solventes tiene un alto poder de recuperación de antioxidantes.
Con respecto a la capacidad antioxidante, es sabido que los polifenoles así como los flavonoides y otros compuestos presentes en la cáscara de granada son altamente efectivos como eliminadores de radicales libres y muy buenos antioxidantes (Ahmed, 2012).
Los resultados de ABTS mostraron que hay diferencias significativas entre la capacidad antioxidante que presenta la fracción soluble con la de la harina y la fracción insoluble.
La cáscara de granada resultó tener una capacidad antioxidante según ABTS de 578,73 μmol trolox/g bs, mayor a la de la cáscara de arándanos reportada por Pérez et al. (2017) y 339,09 μmol trolox/g bs.
Respecto a los valores de capacidad antioxidante obtenidos por el método de FRAP, resultaron con un comportamiento distinto al observado por ABTS. Aunque ambos tienen como objetivo medir la capacidad antioxidante, lo hacen de diferentes maneras, lo que implica mecanismos de reacción distintos. El ensayo de ABTS mide la capacidad para donar hidrógenos o electrones, mientras que el de FRAP mide la capacidad de reducir el Fe3+a Fe2+ (Surco, et al., 2016). A su vez, el primero permite medir antioxidantes hidrofílicos y lipofílicos, mientras que el segundo, según Çelik et al. (2010), no responde tan efectivamente a los lipofílicos, subestimando la capacidad antioxidante real de las matrices. Por ejemplo, Gutiérrez (2015) reportó valores mayores de ABTS en comparación con FRAP en su análisis de cáscara de granada. Un comportamiento similar fue observado por Fischer et al. (2010), quienes reportaron la misma tendencia con 1361,9 y 589,1 μmol trolox/g para ABTS y FRAP, respectivamente.
Los valores de capacidad antioxidante obtenidos por FRAP para la harina, fracción soluble e insoluble resultaron con una tendencia opuesta a la obtenida por ABTS. Este resultado no concuerda con lo observado por Fischer et al. (2010), quienes determinaron capacidad antioxidante por ABTS y FRAP en jugo, cáscara y mesocarpio de granada, mostraron una correlación entre ambos análisis y señalaron que el mesocarpio presentó mayor medición tanto de ABTS como de FRAP.
Para poder explicar el comportamiento observado para FRAP se debe profundizar la investigación e identificar los compuestos presentes en la cáscara, de modo de entender cómo reaccionan y tener así una mejor comprensión de las posibles interacciones que pueden interferir con las reacciones que se dan para FRAP. Se sugiere evaluar tendencia contraria de FRAP y ABTS mediante análisis instrumental con el fin de detectar componentes presentes en ambos extractos e identificar compuestos asociados a la fracción insoluble que son detectados por FRAP y no por ABTS.
En este sentido, Surco et al. (2016) aportan información acerca de la influencia de la estructura química de los ácidos fenólicos sobre la determinación de su capacidad antioxidante y establecen que esta depende y está relacionada con la cantidad y posición de grupos hidroxilos en las moléculas, su posición en la estructura del anillo bencénico con respecto al grupo carboxílico y la longitud de la cadena de este último.
Formulación de productos
La fracción soluble obtenida en este trabajo se destacó por tener un contenido de polifenoles totales y una capacidad antioxidante mayor que la insoluble, mientras que esta última se caracterizó principalmente por ser rica en fibra alimentaria.
La formulación de alimentos fuentes de fibra se puede lograr utilizando esta clase de ingredientes. A modo de ejemplo, Ramírez-Maganda et al. (2015) utilizaron subproductos del procesamiento de mango en la formulación de muffins.
Cabe recalcar que según el reglamento técnico MERCOSUR sobre información nutricional complementaria, declaraciones de propiedades nutricionales, Resolución Nº 01/12 (MERCOSUR, 2012), el claim “fuente de fibra” está autorizado si un alimento posee como mínimo 2,5 g de fibra por porción. En el caso de las galletas, la porción contempla 30 g y para los muffins 60 g, por lo que se decidió formularlos de manera tal de poder rotularlos como “fuente de fibra”. Se calculó la cantidad necesaria de extracto insoluble para que el producto final cuente como mínimo con tal porcentaje de fibra. La razón por la cual se decidió utilizar la mínima cantidad fue el fuerte impacto de los atributos sensoriales que presentan los extractos de la cáscara de granada, tales como el amargor y la astringencia, que pueden afectar fácilmente la sensibilidad de los consumidores a la hora de calificar a los productos.
A pesar de que no existe un claim aprobado en la normativa de Uruguay como “fuente de antioxidantes”, y dada la importancia atribuida a la comunicación de este aspecto a los consumidores en la etiqueta de la bebida y gelatinas, se decidió incorporar la frase “con antioxidantes naturales”. Schubert et al. (1999) realizaron un ensayo in vitro de un extracto de jugo de granada fermentado y encontraron que su capacidad antioxidante es superior a la del vino tinto y similar a la del extracto de té verde.
Evaluación sensorial
La aceptabilidad obtenida para cada producto se observa en la tabla 7.
Tabla 7. Aceptabilidad para los cuatro productos (expresada como la media ±± desviación estándar).

En consumidores informados, la aceptabilidad de las galletas y muffins alcanzó un valor por el cual, según Muñoz et al. (1992), el producto puede considerarse aceptable y su comercialización recomendable. Estos autores proponen una frontera para separar a los productos aceptables de los que no lo son, y establecen que para los primeros los valores de aceptabilidad tienen que ser iguales o superiores a 6. Si bien la bebida y las gelatinas no alcanzaron este valor mínimo, los resultados del estudio de CATA (check all that apply) realizado para estos dos productos revelan que los atributos más destacados pueden considerarse aspectos positivos. El 60% de los consumidores catalogó a la bebida como “saludable” y un 58% la consideró con un “color atractivo”. Por otra parte, las gelatinas obtuvieron altos porcentajes en lo que respecta a los atributos de “color atractivo” (75%), “saludable” (44%), “sabor a fruta” (58%) y “rico” (46%), entre otros. Esto refleja que los consumidores recibieron efectivamente el mensaje que se deseó transmitir mediante la información nutricional y funcional dispuesta en la etiqueta. El uso del atributo “saludable” evidencia una mayor influencia en la aceptabilidad y explica la alta preferencia de los consumidores (Urruzola, et al., 2018). Por este motivo se espera que la consideración de que se trata de alimentos con beneficios para la salud permita que la bebida y las gelatinas alcancen una aceptabilidad adecuada.
Según Carrillo et al. (2012), aunque la aceptabilidad del consumidor se ve afectada principalmente por las características sensoriales del producto, algunos factores extrínsecos (no sensoriales), tales como beneficios para la salud, influyen en la aceptación. Bimbo et al. (2017) explican que ingredientes como la fibra tienen una fuerte aceptación en general, con afirmaciones “naturales” (que en este caso se incluyeron en las etiquetas de las galletas y muffins), y el nivel más alto de aceptación. Además, los autores concluyen que las afirmaciones relacionadas con la salud en los alimentos enriquecidos con fibra dietética y antioxidantes generan un impacto en los consumidores que muestran interés en cuestiones de salud.
Como se puede observar en la Tabla 8, los resultados de la pregunta CATA muestran que, tanto para la bebida, muffins y galletas, los atributos de “saludable” y “rico” se encontraron dentro de los cuatro con mayor porcentaje de respuesta, lo cual es una asociación muy positiva. Las gomitas también comprendieron a estos dos descriptores en posiciones altas de la lista, dentro de los cinco con mayor frecuencia.
Tabla 8. Frecuencia (%) de atributos incluidos en CATA: (a) galletas, (b) muffins, (c) bebida, (d) gelatinas.

El retrogusto estuvo presente en los muffins y se atribuye al uso de sucralosa como endulzante. La cantidad de edulcorante agregada se consideró necesaria para contrarrestar la astringencia propia de la cáscara de granada. Por lo tanto, se recomienda sustituir la sucralosa por una combinación de edulcorantes si se desea mantener el estatus de “sin azúcar”, o realizar una reducción parcial o total de edulcorante, utilizando una mezcla de edulcorante y azúcar o reemplazándolo totalmente.
Otro aspecto a observar es que las galletas y los muffins tuvieron mayor aceptabilidad que las gelatinas y la bebida. Lo que tienen en común ambos productos es que están compuestos por más carbohidratos y estos podrían ayudar a enmascarar la astringencia. Este es un argumento a considerar al evaluar la inclusión de un pequeño porcentaje de azúcar en los muffins para aumentar su aceptabilidad. Asimismo, también se sugiere probar nuevas formulaciones de bebida y gelatinas reemplazando un porcentaje de edulcorante por azúcar, con base en el mismo argumento.
Es importante destacar que la galleta fue el único producto salado elaborado y el que alcanzó mayor aceptabilidad: presentó cuatros atributos positivos con mayor frecuencia de respuesta. Este valor en la aceptabilidad podría deberse al efecto de la sal, debido a que su utilización como ingrediente en productos que contienen fibra podría estar enmascarando la astringencia y el retrogusto generado por la granada.
Según lo reportado por Akhtar et al. (2014), la sensación astringente en los productos se asocia a la formación de complejos de proteínas y taninos. En la cavidad oral, los taninos se precipitan cuando se exponen a histatinas y proteínas ricas en prolina. En una investigación estos autores demostraron que la astringencia de los fenólicos de la cáscara de granada es perceptible en solución acuosa al 0,025% (p/v) para panelistas capacitados. Sin embargo, los mismos panelistas probaron helado enriquecido con fenólicos de cáscara de granada hasta el 1,0% (p/p) y no percibieron astringencia debido a la presencia de carbohidratos en el producto, los cuales enmascaran el sabor astringente de los fenólicos en las muestras analizadas. Soares et al. (2012) también reportaron que la astringencia de los compuestos fenólicos, así como su interacción con las proteínas, se puede reducir con la adición de carbohidratos.
Aproximadamente un 20% de los consumidores destacaron los cuatro productos como “amigables con el medio ambiente”. Sin embargo, un alto porcentaje de los consumidores identificaron los productos como saludables. Por lo tanto, se recomienda buscar otra estrategia de presentación del producto, que destaque la revalorización de la cáscara de granada y apunte a la reducción de residuos y la protección del medio ambiente.
Conclusiones
Mediante un proceso de extracción verde, se obtuvieron dos fracciones a partir de la cáscara de granada, con diferentes funcionalidades y aplicaciones en el ámbito de la industria.
Por una parte, la fracción soluble, rica en antioxidantes y con alta capacidad antioxidante, fue utilizada como materia prima en la formulación de una bebida y gelatinas. Por otra parte, la fracción insoluble, con altos contenidos de fibra, fue incorporada en galletas y muffins.
De esta investigación surge que es posible desarrollar productos que tengan como ingrediente funcional a la cáscara de granada o extractos derivados de ella, y que a la vez logren un buen nivel de aceptación. Los alimentos formulados se pueden catalogar como alimentos funcionales por su contenido de fibra y antioxidantes. Como atributo adicional ninguno contenía azúcar.
De este modo, se logra brindar a los productores la posibilidad de dar más valor a la producción de jugo de granada, mediante la revalorización de los subproductos y el empleo de técnicas simples y efectivas.
Reconocimientos
A la empresa Granadas del Sol por proveer la cáscara de granada utilizada en esta investigación.
