Autores
- Kruk, Carla (1,2); Martínez, Ana (3); Martínez de la Escalera, Gabriela (4); Trinchin, Romina (5); Manta, Gastón (5); Segura, Angel M. (6); Piccini, Claudia (4); Brena, Beatriz (7); Fabiano, Graciela (3,8); Pirez, Macarena (9); Gabito, Lourdes (2); Alcántara, ignacio (2); Yannicelli, Beatriz (2)
- instituto de Ecología y Ciencias Ambientales, Facultad de Ciencias, UDELAR, Montevideo, Uruguay
- Ecología Funcional de Sistemas Acuáticos, Centro Universitario Regional del Este (CURE), UdelaR, Rocha, Uruguay.
- Dirección Nacional de Recursos Acuáticos, La Paloma, MGAP, Rocha, Uruguay.
- Departamento de Microbiología, instituto de investigaciones Biológicas Clemente Estable, MEC, Montevideo, Uruguay,
- Departamento de Ciencias de la Atmósfera, Facultad de Ciencias, UDELAR, Montevideo, Uruguay.
- Modelación y Análisis de Recursos Naturales, CURE, UDELAR, Rocha, Uruguay.
- Bioquímica-DEPBiO, Facultad de Química, UDELAR, Montevideo, Uruguay.
- instituto de investigaciones Pesqueras, Facultad de Veterinaria, UDELAR, Montevideo, Uruguay.
- inmunología-DEPBiO, Facultad de Química, UDELAR, Montevideo, Uruguay.
Las floraciones de cianobacterias tóxicas son un problema mundial. La eutrofización antrópica y la generación de embalses han promovido su desarrollo en la Cuenca del Plata, favoreciendo principalmente al complejo Microcystis aeruginosa (CMA). En este trabajo describimos las floraciones excepcionales de CMA ocurridas en el verano 2019 en la costa del Río de la Plata y Atlántica de Uruguay y discutimos sus mecanismos moduladores con base en datos biológicos, meteorológicos y oceanográficos de muestreos, imágenes satelitales y reanálisis. Las floraciones fueron extensas (Carmelo a Rocha; 500 km) y persistentes (ca.: 4 meses). En todos los casos fueron organismos del CMA con estructura genética similar y su presencia estuvo asociada a niveles cuantificables y elevados de microcistina. En base a las características oceanográficas y la similitud genética entre los organismos, se hipotetiza que las floraciones tienen un origen común, probablemente asociado a tributarios con alta carga de nutrientes y alto tiempo de residencia del agua en la Cuenca baja del Plata. Las precipitaciones extremas generaron caudales récord que transportaron las cianobacterias hasta el Río de la Plata, donde las condiciones de viento y temperatura particulares facilitaron su transporte y arribo a la costa de Rocha, llegando a ambientes de relevancia para la conservación (e.g. Laguna de Rocha).
Palabras clave: complejo Microcystis aeruginosa, verano 2019, microcistinas, mcyJ genes, extremos de lluvias y caudales.
Introducción
Floraciones de cianobacterias
La eutrofización y los cambios globales en el uso de la tierra favorecen y aumentan la intensidad y frecuencia de las floraciones de cianobacterias tóxicas, pudiendo además potenciar la dispersión de algunas especies nocivas (Paerl y Huisman, 2008; Huisman, et al., 2018). Este es el caso de Microcystis aeruginosa y otras especies (M. flos-aquae y M. novacekii, entre otras) y géneros similares (e.g.; Radiocystis, Sphaerocavum), que comparten características fenotípicas y origen filogenético y se agrupan en el complejo Microcystis aeruginosa (CMA) (Komárek y Komárková, 2002; Otsuka, et al., 2000). El CMA es frecuente en cuerpos de agua continentales y costeros del mundo (Harke, et al., 2016), de la región (Andrinolo, et al., 2007; Dörr, et al., 2010; Sathicq, et al., 2015; O’Farrell, et al., 2012; Bordet, et al., 2017; Aguilera, et al., 2018) y de nuestro país (Ferrari y Vidal, 2006; Vidal y Britos, 2012; González-Piana, et al., 2017). Estas floraciones producen en general cianotoxinas, que son denominadas microcistinas y son primariamente hepatotóxicas (De León y Yunes, 2001; Brena, et al., 2006; Andrinolo, et al., 2007; Feola, et al., 2010; Pírez, et al., 2013; Bonilla, et al., 2015; Kruk, et al., 2015). Asimismo, tienen efectos negativos sobre la salud ambiental y humana, principalmente asociados a su exposición (Giannuzzi, et al., 2011; Vidal, et al., 2017). Por estos motivos se torna fundamental evaluar sus mecanismos moduladores como forma de generar acciones para mitigar y prevenir sus efectos adversos (Ibelings, et al., 2016).
Cuenca del Plata: floraciones, usos de suelo, embalses
La Cuenca del Plata, que alimenta al Río de la Plata y descarga en el océano Atlántico, es la segunda en extensión de América del Sur y abarca aproximadamente 3,2 x106 km2 (Guerrero, et al., 1997). En ella habitan cerca de 150 millones de personas distribuidas en cinco países y se ubican cuatro grandes capitales (Achkar, et al., 2015). La cuenca se caracteriza por drenar zonas con intensa producción agroindustrial asociada a un uso elevado de fertilizantes y plaguicidas (García- Alonso, et al., 2017). Durante los últimos 50 años en esta cuenca se ha registrado un incremento en las lluvias, lo que sumado a las modificaciones en los usos del suelo ha determinado un aumento importante en los caudales de sus tributarios (Barros, et al., 2014). En este contexto, las sustancias químicas utilizadas en la producción agropecuaria llegan en forma directa y difusa a los cuerpos de agua por escorrentía, mientras que los desechos de asentamientos humanos llegan en forma puntual y ambos quedan disponibles como nutrientes para las microalgas y cianobacterias (fitoplancton; Nagy, et al., 2002; Goyenola, et al., 2015; Rodríguez-Gallego, et al., 2017; Cardini, et al., 2017). Paralelamente, en los tributarios de la Cuenca del Plata se han construido al menos 70 grandes embalses (Achkar, et al., 2015). En ellos, el agua enriquecida en nutrientes que corre en los ríos es retenida, generando condiciones que favorecen la acumulación de cianobacterias de gran tamaño y la ocurrencia de floraciones (Wang, et al., 2018). En estas condiciones, las cianobacterias del CMA son las más frecuentes (Reynolds, et al., 2002; Debastiani, et al., 2016; Haakonsson, et al., 2017; Adloff, et al., 2018; González-Piana, et al., 2017). Esto transforma a los embalses en fuentes potenciales de cianobacterias, que en condiciones de lluvias muy intensas pueden ser transportadas aguas abajo, distribuyendo las grandes biomasas o inoculando nuevos ecosistemas (Anderson, et al., 2018).
Los organismos del CMA forman colonias mucilaginosas con un amplio rango de tamaños (Harke, et al., 2016; Joung, et al., 2006; Reynolds, et al., 2002; Kruk, et al., 2017). Son típicos de ambientes dulceacuícolas de aguas quietas, como los lagos y embalses, pero pueden crecer en condiciones estuarinas y tolerar salinidades cercanas a las observadas en ambientes marinos (Tonk, et al., 2007; Robson y Hamilton 2003; Lehman, et al., 2005; Lehman, et al., 2017). En el caso de los sistemas que forman parte de la cuenca del Plata, como lo son el río Uruguay y el Río de la Plata, las condiciones de elevada concentración de nutrientes y alto tiempo de residencia, la salinidad y la temperatura son los principales moduladores ambientales de la distribución, diversidad específica, biomasa, actividad celular y producción de toxinas del CMA (Martínez de la Escalera, et al., 2017; Kruk, et al., 2017). Dentro del CMA, la abundancia de poblaciones con genes que codifican para microcistinas es favorecida en ambientes de elevado estado trófico y altas temperaturas (Martínez de la Escalera, et al., 2017). Debido a la presencia de aerotopos en sus células y a la formación de colonias mucilaginosas, los organismos del CMA son capaces de controlar su posición en la columna de agua, formando floraciones superficiales en situaciones de viento moderado a suave y bajo flujo de agua (Harke, et al., 2016; Segura, et al., 2017). Esta capacidad les permite recuperarse rápidamente luego de procesos de mezcla en aguas salobres y que su arrastre sea efectivo por cientos de kilómetros (Kruk, et al., 2017; Martínez de la Escalera, et al., 2017; Forastier, et al., 2016).
Los embalses y los cuerpos de agua que registran más floraciones en la Cuenca del Plata, en particular en el área de influencia de la costa de Uruguay, son aquellos cuyas cuencas de drenaje incluyen una producción agrícola intensiva (Aguilera, et al., 2018; Debastiani et al., 2016). Este es el caso de los embalses en los tributarios del Plata, como por ejemplo el río Uruguay (Salto Grande: Bordet, et al., 2017), Río Negro (González-Piana, et al., 2017) y río Paraná (Adloff et al., 2018). Alternativamente, los remansos de los ríos, con adecuada temperatura, salinidad y luz, también pueden actuar como fuentes de desarrollo de organismos que, en función de variables hidrológicas y climáticas, podrían ser arrastrados hacia zonas con condiciones menos adecuadas para el crecimiento, como los ambientes estuarino-marinos. Describir estos procesos y su efecto en la dinámica espacio-temporal del CMA es necesario para entender su comportamiento y predecir eventos en el futuro.
Objetivos y estrategia
En este trabajo describimos las principales características de las floraciones de cianobacterias registradas en el verano del 2019, una de las floraciones de mayor intensidad registrada en la costa estuarina y Atlántica de Uruguay. Analizamos las condiciones ambientales en las que ocurrieron y evaluamos los principales mecanismos moduladores. Se discuten dos hipótesis de trabajo respecto al origen de estas floraciones: una hipótesis sobre origen autóctono y otra sobre origen alóctono. En la primera, el evento se habría asociado al crecimiento in situ de cianobacterias en diversos puntos costeros del Río de la Plata, en zonas con condiciones ambientales apropiadas (e.g.: salinidad, temperatura y nutrientes). En la segunda hipótesis se propone que el incremento de biomasa local es el resultado del transporte de grandes densidades de cianobacterias desde tributarios de la cuenca. Esto incluye a tributarios pequeños a lo largo de la costa o a los grandes tributarios de la cuenca: los ríos Paraná y Uruguay.
El análisis incluye diferentes niveles espaciales y temporales; una caracterización meteorológica de la Cuenca del Plata (lluvias, vientos y temperatura); el análisis de la dinámica asociada a los caudales y niveles hidrológicos de los ríos Paraná y Uruguay, incluyendo su descarga en el Río de la Plata (RdlP), y el efecto del manejo de los embalses artificiales (i.e. apertura de compuertas). A nivel local, se evalúan variables oceanográficas y la presencia de floraciones, composición específica, concentración de microcistinas y genes que las codifican en muestreos en playas de la costa de Montevideo y de Rocha, en transectas perpendiculares a la costa y en distintos tributarios y ecosistemas costeros.
Materiales y métodos
La estrategia de análisis de este trabajo combinó una revisión de información histórica y actual de variables analizadas durante monitoreos de calidad de agua, así como también variables hidrológicas y climáticas, recabadas por distintas instituciones del país y la región. Esta información fue complementada con observaciones realizadas durante el evento del verano de 2019 en las playas y otros ambientes costeros afectados (e.g. lagunas costeras). Se construyó un modelo conceptual a partir de los diferentes indicadores físicos, químicos y biológicos que permitieron reconstruir el evento del verano 2019 y sus procesos moduladores a distintas escalas espaciales.
Datos de monitoreos de rutina en playas de Montevideo y Rocha
Los monitoreos regulares realizados en playas de Montevideo y Rocha registran temperatura y salinidad en el agua e incluyen la toma de muestras para su posterior procesamiento biológico. En Montevideo, el Departamento de Desarrollo Ambiental de la Intendencia (IM) realiza muestreos cuatro veces por semana en 21 playas, desde Punta Espinillo hasta playa Miramar, desde el año 2000 a la fecha (Risso, et al., 2018). En cada playa se hace una inspección visual de presencia o no de espuma (manchas verdes visibles desde la costa) y presencia o no de colonias cianobacterianas (observación de colonias al acercarse al agua o dentro de ella). Las colonias que son reconocidas visualmente corresponden mayoritariamente a organismos de CMA, ya que estos alcanzan colonias de gran tamaño con decenas de miles de células envueltas por mucílago (Kruk et al., 2018; Segura et al., 2018). Además, se toman muestras de agua superficial que son guardadas en la oscuridad a 4 °C para la estimación de clorofila-a por método espectrofotométrico. Se toman muestras de agua para evaluar la concentración de microcistinas, que son congeladas hasta su procesamiento.
En Rocha, el Departamento de Bromatología de la Intendencia Departamental (IDR) realiza muestreos en siete playas (Balconada, Costa Azul, La Pedrera, Aguas Dulces, Punta del Diablo, La Coronilla, Barra del Chuy), en forma quincenal (MVOTMA-DINAMA, 2017). La Dirección Nacional de Recursos Acuáticos (DINARA) realiza muestreos semanales en seis puntos, cubriendo playas de toda la costa del departamento de Rocha (Los Botes, Arachania, Arroyo Valizas, Aguas Dulces, Punta del Diablo y Barra del Chuy), donde se registra temperatura y salinidad, y se toman muestras de agua superficial para análisis de fitoplancton (fijadas con solución Lugol) desde el año 2011. A su vez, se incluye un punto de monitoreo en la proximidad del puerto de La Paloma donde se realizan mediciones de temperatura y salinidad dos veces por día y un monitoreo mensual de esos mismos parámetros en las lagunas costeras de los departamentos de Rocha y Maldonado. Se consideraron para este trabajo los registros y observaciones obtenidas entre enero y marzo de 2019. Los monitoreos realizados por las tres instituciones fueron diseñados con distintos objetivos, pero en todos los casos son capaces de identificar la presencia visible de cianobacterias.
Muestreo en Montevideo y Rocha
En forma paralela a los muestreos de rutina realizados por IM, DINARA e IDR se realizaron muestreos especiales durante el verano 2019 en la costa de Rocha y Montevideo. El relevamiento en Rocha involucró 24 sitios, que incluyen playas oceánicas y lagunas costeras (Laguna de José Ignacio, Laguna de Rocha, Laguna de Castillos, Laguna Negra y desembocadura del arroyo Valizas). En 11 playas de La Paloma se realizó un seguimiento diario posterior a la aparición de las cianobacterias. En Montevideo se hicieron muestreos adicionales en cinco playas representativas (La Colorada, Cerro, Ramírez, Pocitos y Malvín) donde se tomaron muestras para análisis cualitativos y cuantitativos de fitoplancton que fueron fijadas con lugol y formol, y otras congeladas para la evaluación de microcistinas y presencia de genes mcyJ. Se realizaron además dos transectas, una en Montevideo y otra en La Paloma, donde se tomaron muestras en cinco puntos de cada una. En Montevideo la transecta fue desde el puerto hacia la Isla de Flores, con puntos cada ~7 km, y en La Paloma, desde el Puerto hacia el bajo Falkland, cada ~0,7 km. En ambas se registró la salinidad y la temperatura con un CTD y se tomaron muestras de agua para los análisis biológicos mencionados anteriormente.
Análisis de muestras: conteos, microcistinas y genes
El análisis de las muestras cualitativas de fitoplancton consistió en la identificación de especies y el análisis morfológico bajo microscopio óptico. La determinación de microcistinas totales (soluble e intracelular) se realizó mediante un ensayo de ELISA policlonal en laboratorio (Pírez, et al., 2013). Para la ruptura celular se realizaron tres ciclos de congelado y descongelado. Las muestras se filtraron por filtros de fibra de vidrio de 1 µm de poro y se analizaron por triplicado, en forma directa o mediante diluciones seriadas. Estas muestras también fueron utilizadas para los análisis genéticos.
Extracción de ADN
Se filtraron 150-400 mL de agua a través de filtros de membrana de celulosa de 0,45 μm de tamaño de poro y los filtros se almacenaron en placas de Petri estériles a -20 °C. Para la extracción de ADN se empleó el método descrito en Martínez de la Escalera et al. (2017).
HRM análisis (HRMA)
Para evaluar la presencia de distintos genotipos mcyJ se amplificó este gen por PCR cuantitativo en tiempo real (qPCR), utilizando los primers descritos por Kim et al. (2010) y empleando el kit MeltDoctor (Invitrogen). Posteriormente se realizó un análisis de melting de alta resolución de los amplicones (HRMA) (Lepillanca, et al., 2018; Martínez de la Escalera, et al., 2019).
Reconstrucción temporal y espacial del evento
Se reconstruyó la dinámica espacial y temporal de la ocurrencia de las floraciones. Para ello, se combinaron datos de los monitoreos de playas de DINARA, IDR e IM obtenidos entre enero y marzo. Asimismo, se relevó información disponible en el Observatorio Nacional Ambiental de MVOTMA-DINAMA sobre la ocurrencia de floraciones (MVOTMA-OAN, 2019) y los informes de vigilancia de playas realizados en el Río Uruguay por CARU (CARU, 2019a). En ambos programas de monitoreo se registra la presencia de floraciones. El primero se realiza en la costa estuarina y oceánica de Uruguay a través del sistema de vigilancia visual de floraciones de cianobacterias (MVOTMA-DINAMA, 2017) (Tabla 1), mientras que el segundo corresponde al río Uruguay y utiliza la clasificación de CARU (e.g.: CARU, 2019a) (Tabla 1). También se obtuvo información a partir del monitoreo de calidad de agua de lagunas costeras, realizado por el CURE en convenio con MVOTMA, OSE, Intendencia Departamental de Rocha y DINARA. Se tuvieron en cuenta comunicaciones ocasionales de presencia de organismos del CMA realizadas por guardavidas, guardaparques (Laguna de Rocha, SNAP) y vecinos, que fueron confirmadas mediante la visita al sitio y el análisis de muestras. Se evaluaron también pequeños tributarios en las inmediaciones de las playas afectadas donde se tomaron muestras para evaluación de presencia de CMA.
Tabla 1. Comparación de los diferentes niveles de riesgo y alerta utilizados por la Comisión Administradora del río Uruguay (CARU) en el río Uruguay y los estados posibles de la playa definidos por el Ministerio de Vivienda, Ordenamiento Territorial y Medio Ambiente (MVOTMA) en la costa del RdlP y costa atlántica. El contenido de la tabla fue adaptado de las fuentes consultadas.

Datos climáticos e hidrológicos
Durante el evento las condiciones climáticas se analizaron con productos de diferentes bases de datos de libre acceso. La temperatura superficial del mar se analizó a partir del producto satelital de datos grillados del «Grupo de alta resolución de temperatura superficial del mar» (GHRSST, https://www.ghrsst.org/). Más información y su uso previo en Uruguay se pueden encontrar en Manta y Alcántara (2018). Las imágenes MODIS-AQUA «true color» se obtuvieron para los días despejados y se descargaron del sitio web https://worldview.earthdata.nasa.gov (Savtchenko, et al., 2004). Los datos de precipitación provienen del producto GPM IMERG Late Precipitation L3, de resolución temporal diaria y espacial de 0,1°x0,1° versión 05, (NASA Goddard Earth Sciences, Global Precipitation Measurement Mission: GPM, Integrated Multi-Satellite Retrievals for GPM: IMERG, https://disc.gsfc.nasa.gov/; Huffman, et al., 2015). Los datos de viento y temperatura del aire provienen del reanálisis NCEP/NCAR (National Centers for Environmental Prediction/National Center for Atmospheric Research), con resolución espacial de 2,5°x2,5° y resolución temporal diaria (Kalnay, et al., 1996). Las anomalías fueron calculadas en base a la climatología 1981-2010 (https://www.esrl.noaa.gov).
A partir de Jaime y Menéndez (2002) y de la actualización de Borús (comunicación personal), se obtuvo información de los caudales diarios (Q) del RdlP desde enero a marzo, estimados como la suma de sus principales tributarios (Palmas, Uruguay, Guazú, m³s-1). Se consideraron también los caudales erogados (turbinado más vertido) y las fechas de inicio y finalización de vertido (apertura de compuertas) en los embalses de Salto Grande (río Uruguay) y de Palmar (Constitución, Río Negro). La información de Salto Grande fue aportada por la Comisión Técnica Mixta (CTM) de Salto Grande y la información de balance hidráulico (2014 a 2019) del Río Negro para la Central Constitución fue brindada por la empresa de Usinas y Transmisiones Elécricas (UTE). La información meteorológica de Uruguay fue cedida por el Instituto Uruguayo de Meteorología (INUMET). Para evaluar el estado de descarga de la represas como posibles fuentes de cianobacterias desde los grandes tributarios de la Cuenca del Plata se utilizaron reportes de la Secretaría de Infraestructura y Política Hídrica del Instituto Nacional del Agua, obtenidos a través del Sistema de Información y Alerta Hidrológico de la Cuenca del Plata (INA, 2019). Se consideraron los embalses más cercanos a la desembocadura en el RdlP: Salto Grande (~281 km hasta la desembocadura del río Uruguay en el RdlP), Yacyretá (ca. 1300 km hasta la desembocadura el río Paraná en el RdlP) e Itaipú (ca. 1800 km hasta la desembocadura el río Paraná en el RdlP). Estos reportes también fueron utilizados para recabar información sobre el estado de descarga de distintos tramos de los ríos Paraná y Paraguay en la cuenca media del Plata y los niveles hídricos en distintas estaciones (INA, 2109), así como los informes de crecida del río Uruguay y sus efectos sobre la altura de los puertos (CARU, 2019b).
Análisis de datos
Se compararon los valores de salinidad y temperatura en las playas de Montevideo y Rocha del período enero-febrero-marzo (EFM) 2019, con los valores históricos registrados en los respectivos monitoreos. Las playas de Montevideo fueron clasificadas, según su ubicación en el espacio, en playas al oeste (e.g.: Pajas Blancas), al centro (e.g.: Ramírez) y al este (e.g.: Carrasco, Miramar).
Se evaluaron las similitudes entre los perfiles de melting del HRMA del gen mcyJ, entre las distintas playas de Montevideo y Rocha, con muestras obtenidas previamente en el embalse de Salto Grande (enero y diciembre del verano 2013) y en el embalse de Baygorria, dispuesto sobre el Río Negro (marzo 2013). Para ello se realizaron análisis de clasificación jerárquicos, utilizando la medida de divergencia de Kullback-Leibler (KL), una medida no simétrica de la similitud o diferencia entre dos funciones de distribución de probabilidad. La divergencia de KL sirvió para caracterizar la distancia entre todos los pares de distribuciones de HRMA, utilizando el paquete de R «entropy» (Hausser y Strimmer, 2014). Esta medida de la divergencia ha permitido estimar la discordancia entre funciones en oceanografía (Nerini y Ghattas, 2007). Con la matriz de divergencias de KL se construyó un árbol aplicando el método de Ward con la función «hclust» de R (R Core Team, 2018).
Resultados
Descripción inicial del evento
En el verano 2019, los primeros registros de floraciones cianobacterianas intensas o «espuma» en la costa uruguaya del RdlP fueron en el departamento de Colonia. Estos registros ocurrieron en los balnearios Zagarzazú y El Ensueño, durante los días 15 y 16 de enero, respectivamente (Figura 1). En Colonia, las floraciones se registraron al menos hasta el 11 de marzo. El 9 de enero la CARU registró un nivel de alerta 1 en el río Uruguay a la altura de Nueva Palmira, luego de al menos un mes de estado de vigilancia (Tabla 1). En Montevideo, los primeros registros de floraciones con espuma realizados por la IM correspondieron al 28 de enero y la presencia de colonias visibles y espuma cianobacteriana en remansos o resaca se mantuvo hasta la primera semana de mayo, alcanzando casi cuatro meses de duración. En La Paloma, Rocha, guardavidas de las playas de Balconada, Los Botes y Bahía Grande observaron el 30 de enero la presencia de espuma, mientras que guardaparques y vecinos realizaron similares observaciones el 31 de enero en la Laguna de Rocha. Ese día se inició por primera vez en el departamento de Rocha un Programa de Vigilancia de Floraciones, que incorporó el uso de banderas sanitarias en las playas afectadas. A partir del 31 de enero hubo una rápida disminución de las cianobacterias en las playas de Rocha y el 2 de febrero las playas fueron declaradas como aptas para baños. La extensión total del evento fue de aproximadamente 500 km de la costa comprendida entre Colonia y Rocha.

Figura 1. Representación de la distribución espacio-temporal (día/mes) de las floraciones cianbacterianas en la costa estuarina y oceánica de Uruguay en el verano de 2019. 1) Nueva Palmira: 9/1; 2) Balneario Zagarzazú: 15/1 y Colonia 16/1; 3) Montevideo 28/1; 4) Maldonado 29/1 y 5) Rocha La Paloma 30/1. A) El Ensueño, Colonia (foto Myriam Ducassou); B) vista aérea de la costa de Montevideo 10/2 (foto Andrés Marín); C) Rambla de Montevideo; D) vista aérea playa de Piriápolis (foto Marcelo Umpierez); E) playa La Balconada zona cercana al Faro de La Paloma (30/1), y F) muestra tomada por guardaparques en Laguna de Rocha (31/1).
A nivel de la región: condiciones hidroclimáticas
Los primeros 19 días de enero presentaron un acumulado de lluvias extraordinario, con valores máximos de 550 mm en la cuenca media del río Uruguay, que abarca el Norte de Uruguay y las zonas aledañas de Brasil y Argentina (Figura 2). Esto resultó en mayores precipitaciones al norte y en el litoral de Uruguay, con grandes máximos acumulados, principalmente en Artigas, Salto, Paysandú y Río Negro (Figura 2). En promedio, en enero llovieron a nivel nacional 295 milímetros, con un récord histórico de precipitación acumulada durante enero en Artigas, de 763 mm, y un mínimo de 77 mm en el departamento de Colonia (INUMET, 2019a).
Luego de las precipitaciones, en la región y particularmente sobre Uruguay ocurrieron dos eventos de ola de calor, definidos como tal por el INUMET. En ellos los valores de temperatura máxima y mínima se mantuvieron por encima del percentil 90 durante tres o más días consecutivos (INUMET, 2019b). El primer evento tuvo lugar desde el 27 al 31 de enero, mientras que el segundo ocurrió desde el 19 al 23 de febrero.
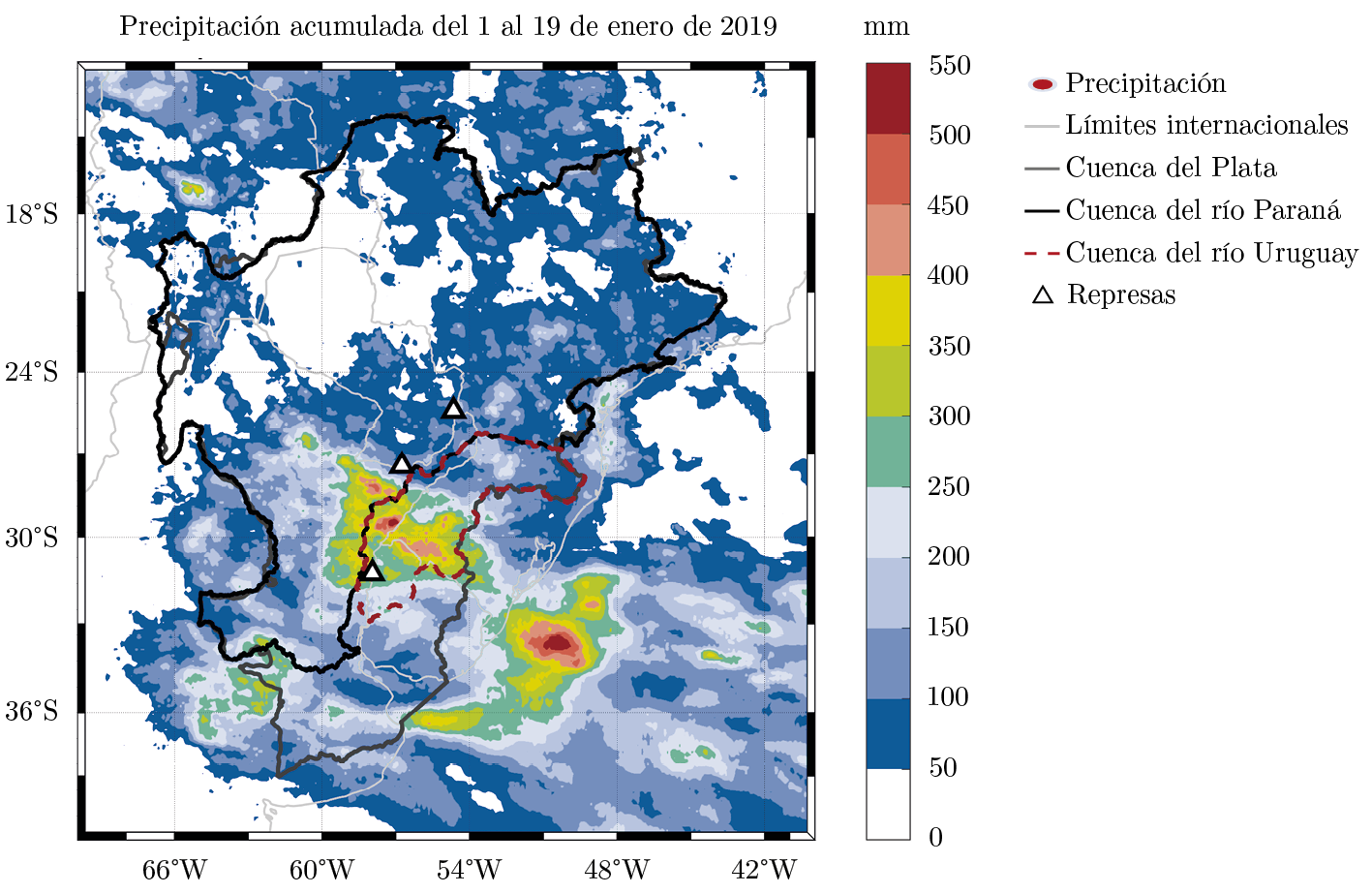
Figura 2. Acumulado de precipitación desde el 1° al 19 de enero de 2019 (hidroestimador satelital GPM IMERG). En la figura se delimitan en gris oscuro la Cuenca del Plata, en negro la Cuenca del río Paraná y en rojo con línea punteada la Cuenca del río Uruguay. Los triángulos indican la ubicación de grandes represas hidroeléctricas; de Norte a Sur estas son: 1) Itaipú, 2) Yacyretá y 3) Salto Grande.
Las precipitaciones registradas durante los primeros días de enero derivaron en un valor de caudal diario del RdlP durante el trimestre enero-febrero-marzo (EFM) que fue récord para los últimos 30 años. La descarga del RdlP fue de 61846 m3s-1, lo que representó una anomalía positiva de 37950 m3s-1 y con máximos entre el 19 y el 31 de enero superiores a los máximos del valor medio climatológico (climatología 1988-2018; Figura 3). El máximo valor de caudal (Q = 61846 m3s-1), registrado el 25 de enero, se situó 2,6 veces por encima de la media climatológica histórica indicada para ese día.
El máximo caudal del RdlP tuvo un aporte importante del río Uruguay (Q = 37143 m3s-1) seguido por aporte del río Paraná Guazú (Q = 17724 m3s-1) y el del Paraná de las Palmas (Q = 6979 m3s-1; Figura 4). En particular, el río Uruguay presentó caudales medios diarios récord para el trimestre EFM y un desfasaje de siete días entre el momento del máximo caudal del río Uruguay en Salto Grande y el máximo caudal del RdlP.
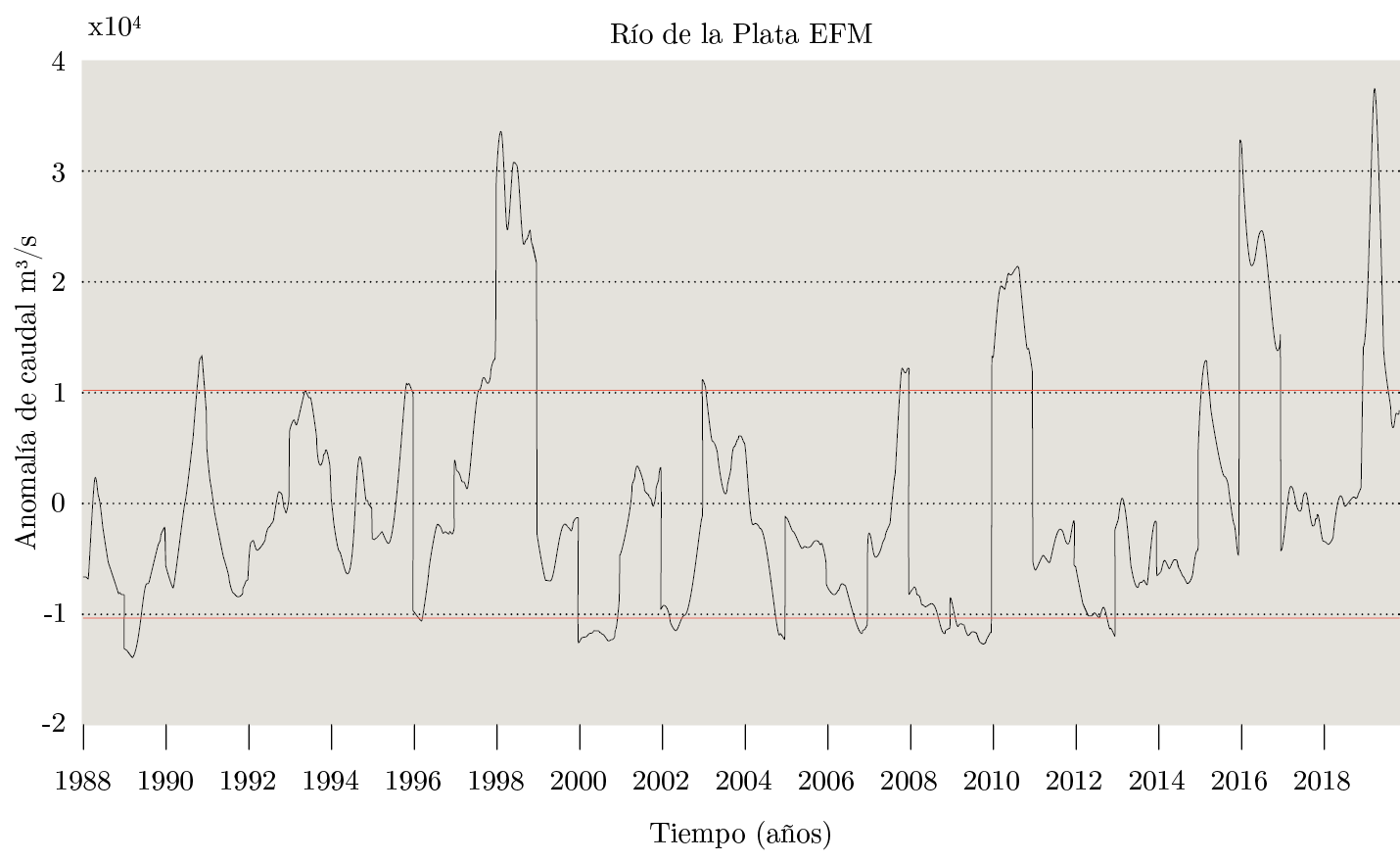
Figura 3. Serie histórica diaria de anomalía de caudal (m3s-1) del Río de la Plata para los trimestres enero-febrero-marzo, del período 1988-2019 (INA, 2019). Las líneas rojas indican + − una desviación estándar.
Las represas cercanas a las zonas de mayor precipitación fueron Salto Grande, Yacyretá e Itaipú, y las represas sobre el Río Negro, aunque las lluvias se concentraron principalmente sobre el área de descarga del embalse de Salto Grande (Figura 2). En las primeras semanas de enero este embalse recibió un aporte promedio desde la cuenca alta del río Uruguay de 2300 m³s-1. En forma paralela, la descarga desde el río Paraguay hacia el río Paraná se encontraba en disminución (4700 m3s-1). Hacia el 14 de enero la descarga en Itaipú, el embalse más alejado, estaba estabilizada (10000 m3s-1), mientras que en Yacyretá (14000 m3s-1) y en Salto Grande (23000 m3s-1) mostraban un aumento en relación a los días previos, especialmente en esta última. El aporte total al embalse de Salto Grande fue máximo el 18 de enero (28200 m3s-1). Para evitar las inundaciones, a partir de valores de caudal de entrada de 10000 m3s-1 se procedió a la apertura de compuertas en el embalse de Salto Grande, lo que ocurrió entre el 8 de enero y el 3 de febrero (Figura 4). El caudal máximo vertido durante el período estudiado fue de 25.177 m³s-1 (Figura 4). Las alertas de floraciones emitidas por la CARU en el río Uruguay muestran una mayor frecuencia de alertas con mayor nivel (rojo) en la zona aguas arriba del embalse antes de la apertura (08/01) de las compuertas y posteriormente aguas abajo, en particular en la zona de Nueva Palmira, al día siguiente de la apertura de compuertas, con un primer registro en esta zona el 9 de enero.
El Río Negro, que aporta sus aguas al río Uruguay, también tuvo un incremento importante de caudal durante el período EFM, llegando a un caudal vertido máximo de 4458 m3s-1 en Constitución (último embalse antes de la desembocadura en río Uruguay). Durante el período de apertura de compuertas alcanzó un caudal promedio de 3100 m3s-1 (Figura 4). Al igual que en el embalse de Salto Grande y para optimizar el control de crecidas entre el 8 de enero y el 8 de febrero se abrieron las compuertas en Constitución, para prevenir cotas de alerta (8 enero) y de evacuación (10 enero) en la ciudad de Mercedes. Los volúmenes vertidos por los embalses de Salto Grande y Constitución estuvieron positivamente relacionados con el caudal de aporte hacia el RdlP. El enorme caudal afectó los puertos de Concordia, Colón, Paysandú, Concepción del Uruguay y Boca del Gualeguaychú, más allá de los niveles de alerta y, en algunos casos, de evacuación.
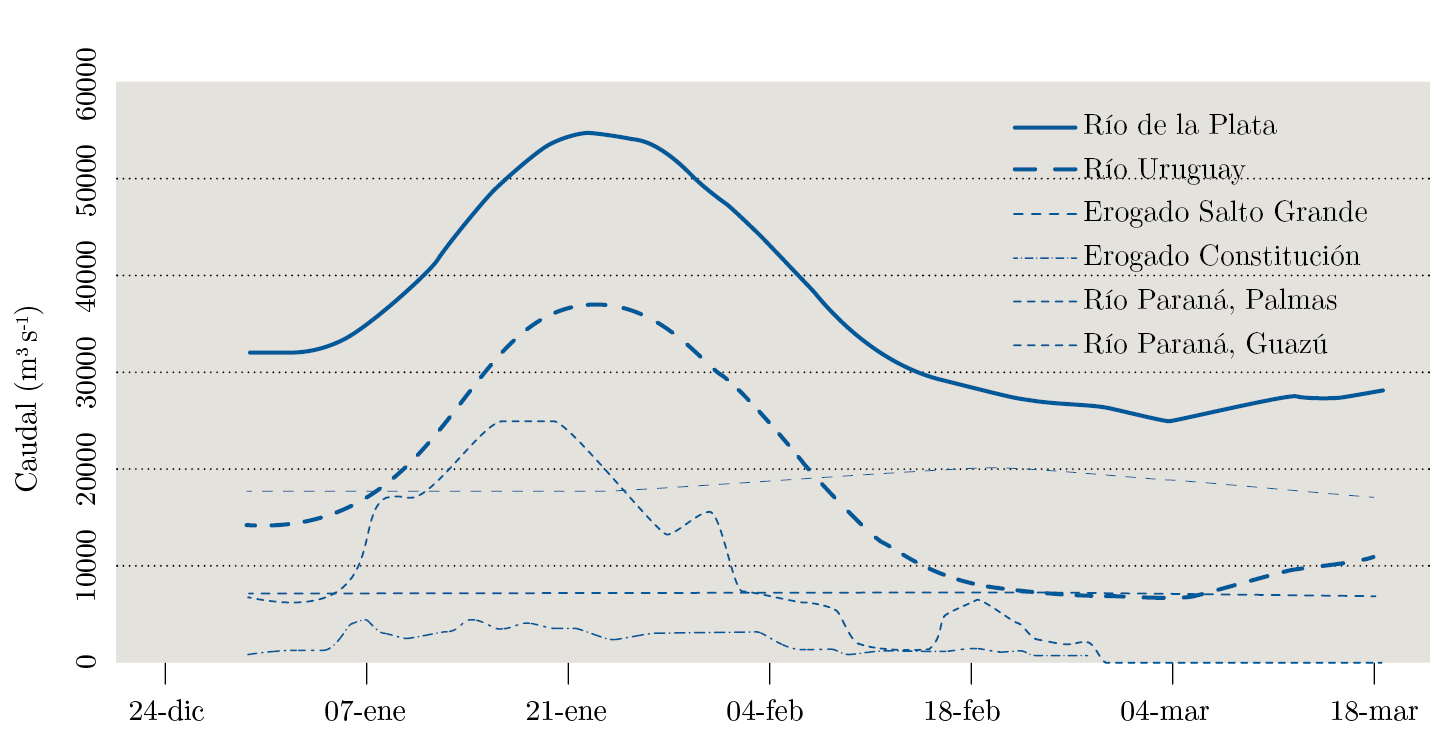
Figura 4. Caudales del Río de la Plata y sus principales tributarios (ríos Uruguay, Paraná de las Palmas y Paraná Guazú), incluyendo además caudal vertido en embalse de Salto Grande en el río Uruguay y en el embalse de Constitución en el Río Negro durante la apertura de compuertas.
Río de la Plata: efectos de los caudales y vientos en la dinámica
Los volúmenes descargados al RdlP afectaron la distribución espacial de las propiedades fisicoquímicas de su agua, con cambios marcados en la temperatura, turbidez y salinidad (Figuras 5 y 6). En la secuencia de imágenes satelitales de temperatura superficial del mar, desde el 22 de enero hasta el 5 de febrero de 2019 se observó el avance de aguas más cálidas desde el interior del estuario hacia la costa atlántica uruguaya (Figura 5). Desde el 22 hasta el 28 de enero, las aguas cálidas avanzaron por el estuario hasta la costa de Canelones mientras que en la región Este se observa una estructura de menor temperatura característica de un evento de surgencia oceánica (Trinchin, 2018). A partir del día 30 de enero se debilita esa estructura de surgencia y las aguas más cálidas se observan en una pluma cercana a la costa que alcanzan La Paloma y zonas más al Este hacia el 5 de febrero. Un patrón similar se observó entre esas fechas para la pluma de turbidez (Figura 6).
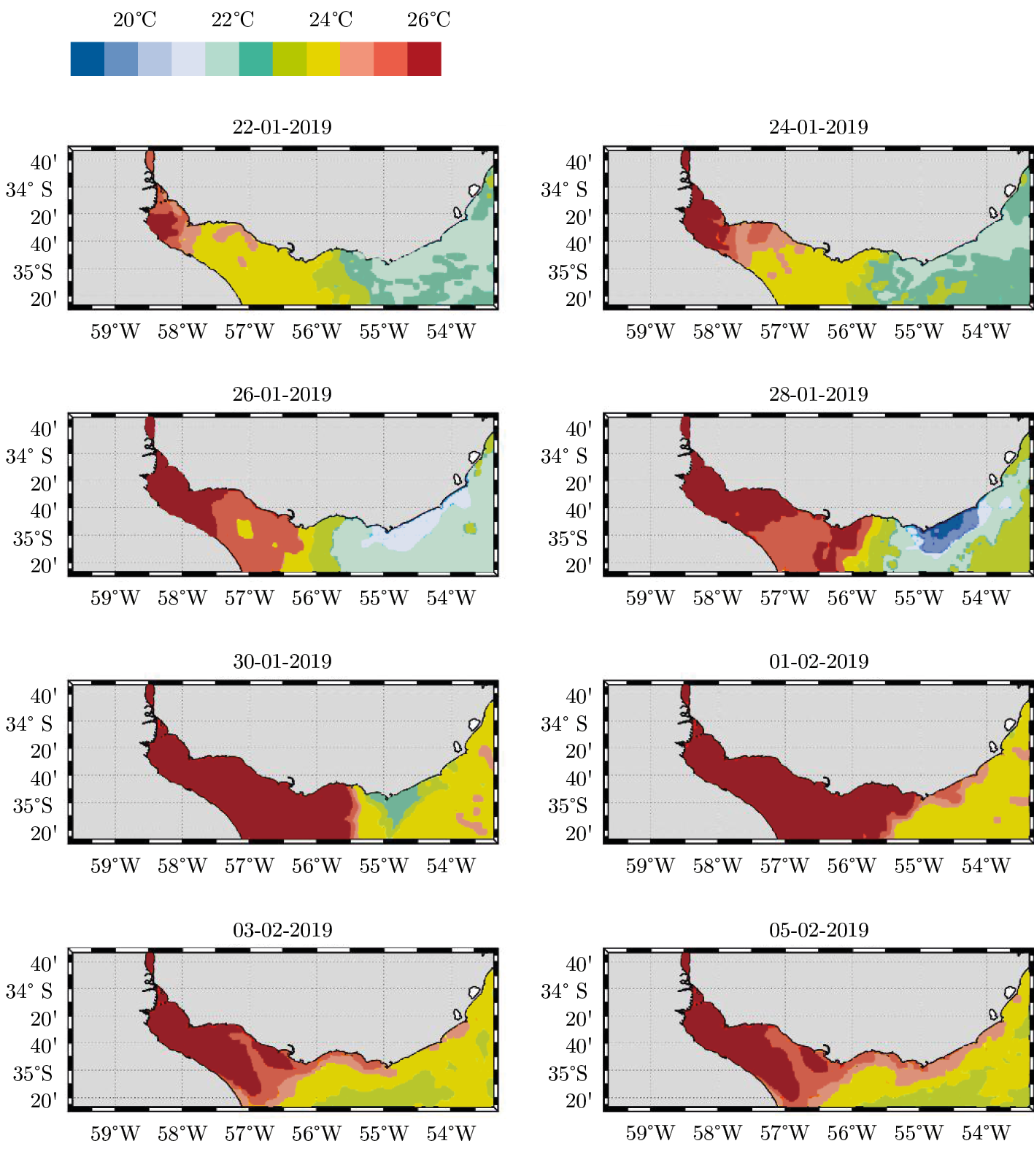
Figura 5. Evolución cada dos días de la temperatura superficial del mar (22 de enero al 5 de febrero de 2019), a partir de datos satelitales MUR-GHRSST.

Figura 6. Pluma de descarga marcada por el frente de turbidez del Río de la Plata (arriba corresponde al día 22 de enero y abajo al día 5 de febrero de 2019). Imagen satelital visible del sensor MODIS-AQUA (AERONET-CEILAP-BA-Subset-Aqua-1 km-True-Color).
Desde el 19 de enero hasta el 5 de febrero predominaron las condiciones de viento NE sobre la costa uruguaya (Figura 7). Estos vientos tuvieron la particularidad de presentar una anomalía negativa de intensidad durante ese período. Su magnitud y dirección indican que eran vientos débiles y cálidos. En cuanto a temperatura del aire también se observaron condiciones de anomalía positiva (Figura 7). El momento en que se registra el caudal máximo del RdlP coincide con la ocurrencia del primer evento de ola de calor y condiciones de viento de baja intensidad. La ocurrencia de vientos provenientes del NE explica la presencia de un evento de surgencia de máxima intensidad desde el 26 y hasta el 28 de enero, que culminó por efecto combinado de la debilitación de los vientos y el avance del agua dulce y cálida sobre la costa uruguaya. Este patrón fue registrado remotamente y confirmado con mediciones in situ en distintos puntos de la costa uruguaya (Figura 8).

Figura 7. Composite de dirección y velocidad del viento (19 enero - 5 febrero de 2019). En azul y rojo se indican la anomalía de velocidad del viento en superficie. Los vectores representan la magnitud y sentido medios de los vientos. En contornos amarillos se indica la anomalía de temperatura del aire a 2 m de altura sobre la superficie del agua.
Efectos de la dinámica de aguas en las playas del estuario
Los cambios en el frente de turbidez asociados a los altos caudales resultaron en cambios en la salinidad y temperatura de las playas de Montevideo y en la ocurrencia de valores extremadamente bajos de salinidad en las playas de Rocha (Figura 8). En Montevideo, la salinidad varió entre 0,1 y 24,1 y la temperatura entre 21,5 y 32,1 ℃, mientras que en Rocha la salinidad estuvo entre 9,8 y 31,9 y la temperatura entre 17,5 y 27 ℃. Tanto en Montevideo como en Rocha el comportamiento de la salinidad estuvo asociado a la distribución espacial de las playas, con menores valores en las playas al oeste, valores intermedios para las playas del centro y los máximos valores para las playas del este (Figura 8).
En Montevideo, entre enero y marzo se registró la presencia de cianobacterias en todos los sitios y playas muestreadas (21 playas) y se observó espuma en 17 de ellas. El día 4 de febrero se registró presencia o espuma en todas las playas, simultáneamente (Figura 8). La playa más afectada por la presencia de espuma fue la Ramírez, en segundo lugar la playa del Cerro y, en menor medida, las playas Honda, Ingleses, Nacional, Pajas Blancas, Puerto del Buceo, Punta Yeguas, Santa Catalina, Verde y Zabala. En todos los casos, las espumas estaban compuestas por organismos del Complejo Microcystis aeruginosa (CMA) y la mayor ocurrencia de espuma estuvo asociada a los menores valores de salinidad (Figura 8). Considerando a las playas en su conjunto, los valores de salinidad y temperatura del verano 2019 en Montevideo no difirieron significativamente de los valores históricos.
La presencia de las cianobacterias del CMA en las playas de Rocha estuvo asociada a una dinámica particular del agua. El primer registro de cianobacterias se presentó con valores de salinidad próximos a 30 (Figura 8). Se observó un patrón espacial, con presencia de cianobacterias y aguas relativamente cálidas (T = 25 ℃) al Oeste del Puerto y hasta la Laguna de Rocha, mientras que en la zona al Este del puerto no se observaron cianobacterias y agua menos cálida (T = 20 ℃) (Tabla 1). A partir del 31 de enero se registró una disminución de la salinidad, con un valor mínimo de 9,8 el día 5 de febrero (Figura 8). Los valores de salinidad fueron significativamente menores a los registrados históricamente, para verano, en las playas de Rocha, donde se ha registrado una salinidad media de 28,8 y un rango de 21,1 a 32,2, para los meses de verano (EFM).
Del total de 24 sitios relevados en Rocha, en 17 se confirmó la presencia de floraciones de cianobacterias. Además de las playas oceánicas, estos incluyeron cuatro lagunas costeras: de José Ignacio, de Rocha, de Castillos y Negra y la desembocadura del arroyo Valizas. La mayor intensidad de las floraciones fue observada en un sector de la playa de la Balconada, con presencia de espuma importante. En las piscinas rocosas del Cabito y en Los Botes se observaron acumulaciones de colonias, y en el resto de las playas, colonias dispersas o yerba, contabilizando en total 10 sitios afectados.
Se confirmó mediante microscopía que la presencia o espuma fue causada por organismos del CMA, en su mayoría identificados como Microcystis aeruginosa. Las colonias en la Laguna de José Ignacio y Laguna de Rocha fueron similares a las observadas en las playas y su ingreso desde el mar fue observado junto con la intrusión de agua de mar durante la noche del 30 de enero (vecinos y guardaparques Laguna de Rocha, comunicación personal). En Laguna de Castillos y Laguna Negra las floraciones fueron observadas días antes del evento en las playas oceánicas y su origen no se adjudica a las floraciones provenientes del mar. El aporte de la Laguna de Castillos al evento marino de MAC no es probable, pues en dicha laguna se registraron predominantemente cianobacterias filamentosas, principalmente del género Dolichospermum. En la Laguna de Garzón no se observaron cianobacterias y durante las floraciones registradas en la costa, la laguna no presentó conexión con el mar. Se registraron un total de 48 casos (sitios y fechas) con presencia de cianobacterias en la zona oceánica de Rocha. No se registraron aportes de organismos del CMA, provenientes de vertientes locales (e.g cañadones). En todos los sitios donde se observó el CMA, a excepción de las lagunas de Castillos y Negra, se trató de organismos de gran tamaño que formaron colonias identificables a simple vista, alta densidad celular, mucílago claro y denso y aspecto rugoso (Figura 1F).
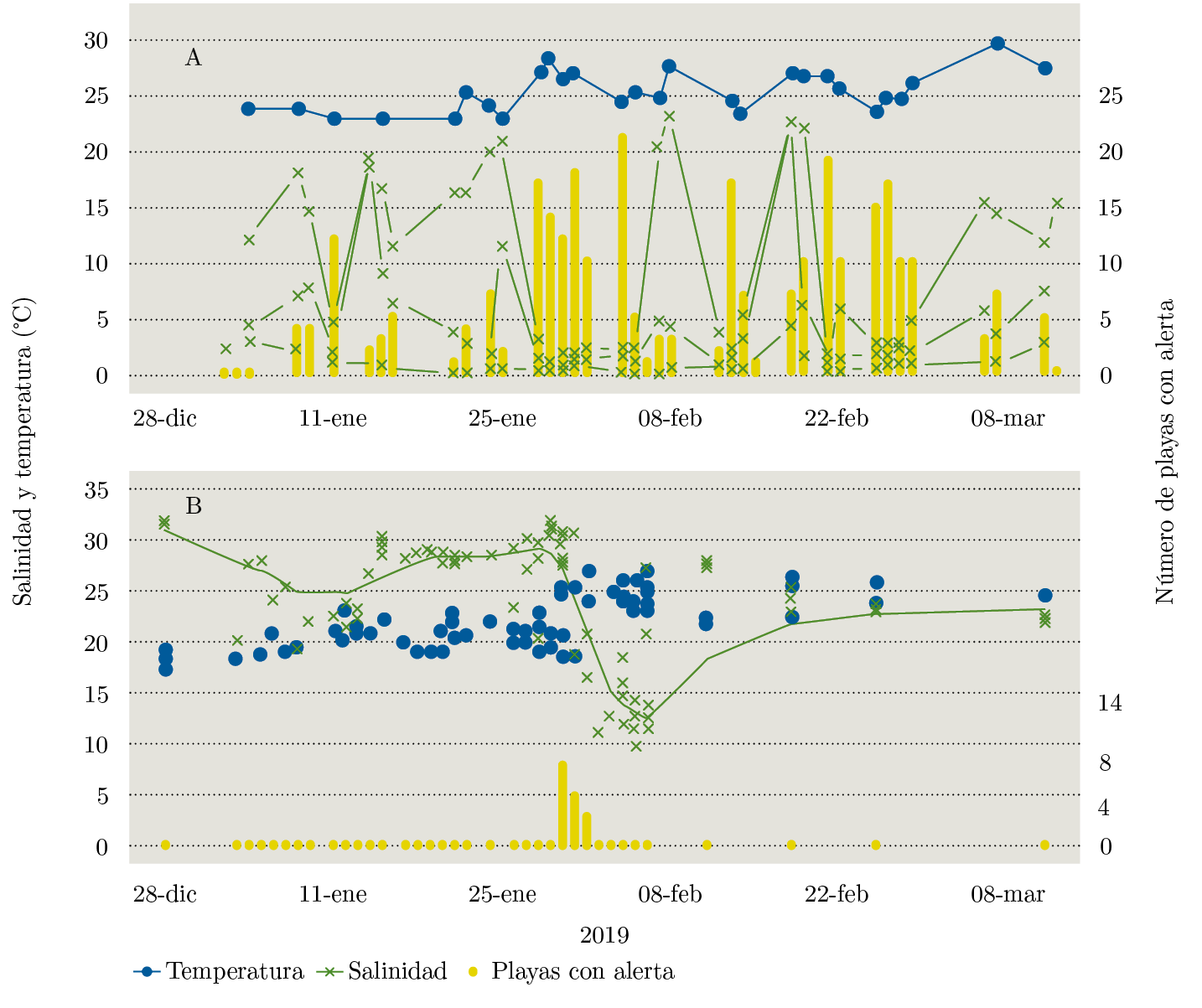
Figura 8. Variación temporal de los valores de salinidad, temperatura y número de floraciones en A) Montevideo y B) Rocha. Se ha representado en barras el número de playas que diariamente presentaban presencia o espuma cianobacteriana en tres playas en Montevideo (Ramírez en el centro de la zona costera, La Colorada al oeste y Miramar al este) (A) y en todas las playas estudiadas de Rocha, en La Paloma (B). Se aplicaron regresiones ponderadas localmente (Lowes) para representar los cambios de salinidad en las playas de La Paloma, Rocha (línea continua verde en B).
Microcistinas en playas
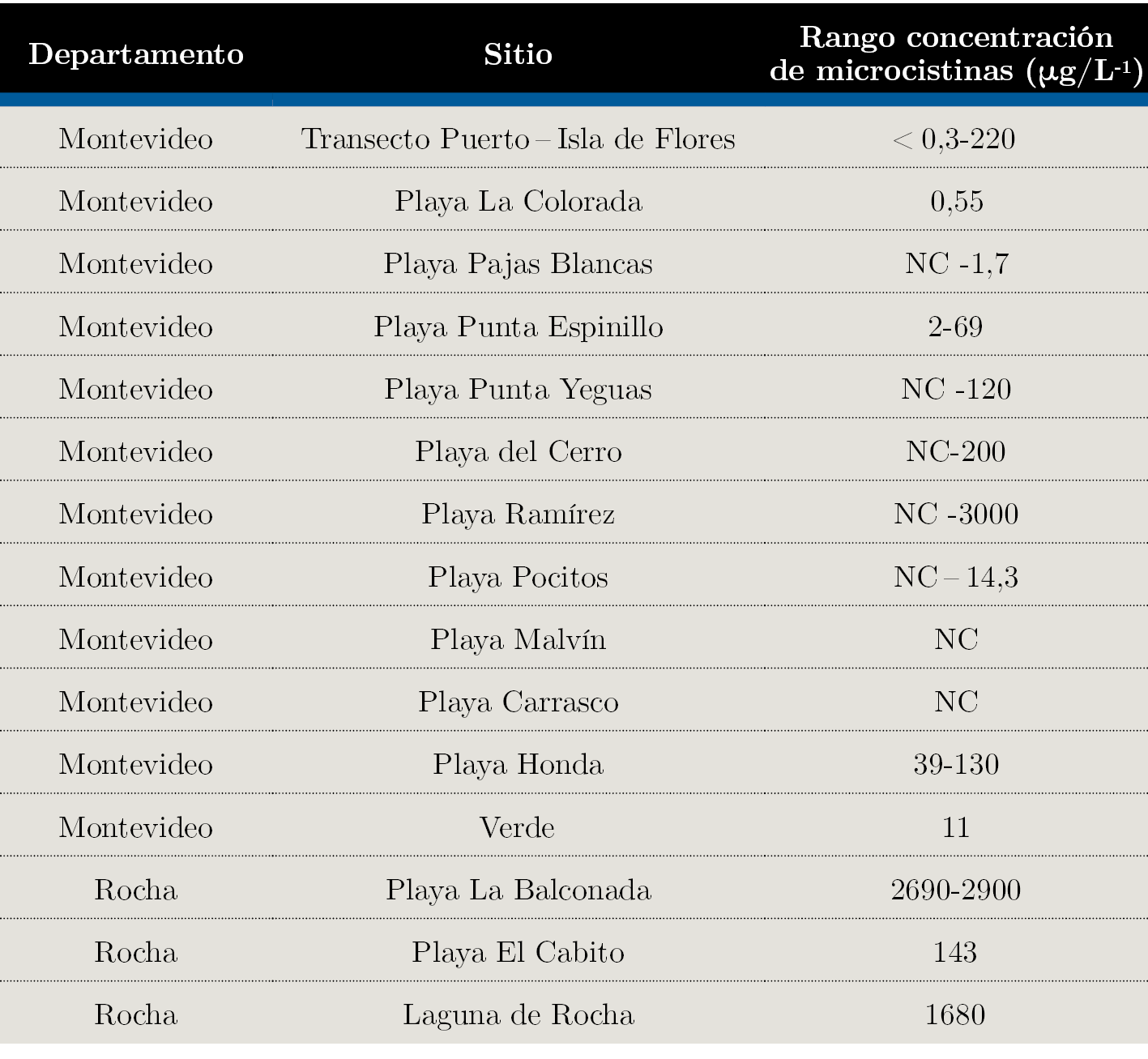
La concentración de microcistinas en el agua en Montevideo entre enero y marzo varió desde indetectable hasta 3000 mg L-1, con un valor medio de 236 mg L-1 (Tabla 2). El valor máximo fue observado en la Playa Ramírez (31 de enero), asociado a la presencia de espuma cianobacteriana y cuantificación del gen mcyJ. Ramírez fue la playa que presentó microcistina detectable en más ocasiones, seguida de Cerro, Punta Espinillo, Pocitos, Honda, Punta Yeguas y Punta Espinillo.
En las muestras de la playa de la Balconada, en la costa de Rocha (30 de enero) se encontraron valores de microcistinas muy similares a los máximos registrados en la playa Ramírez (2700-2900 mgL-1). En esas fechas, las lagunas costeras de Castillos y Negra presentaron valores de microcistinas no cuantificables (< 0,3 mgL-1) o muy bajos (0,5 mgL-1), respectivamente. En la Laguna de Rocha, que se encontraba abierta al mar durante todo el evento, los valores fueron elevados (1680 mgL-1), lo que sugiere el ingreso de la floración desde el mar.
Tabla 2. Rangos de concentración de microcistinas registradas en las costas de Montevideo y Rocha, estimados mediante Elisa (Pírez, et al., 2013). NC = No cuantificable (< 0,3 mgL-1). Los valores de concentración de microcistinas no están corregidos por la densidad celular, representando la concentración de microcistina en la muestra de espuma, en cada sitio.
Variabilidad del gen mcyJ a lo largo de la floración
Los perfiles de melting obtenidos por HRMA fueron utilizados para evaluar si los organismos encontrados en los diferentes sitios a lo largo de la floración pertenecían a la misma población o eran producto de florecimientos locales. Las muestras obtenidas en playas y aguas abiertas de Montevideo y Rocha (30 de enero y el 7 de febrero de 2019) se compararon entre sí y con datos correspondientes a otros períodos (verano 2013) y otras zonas, tales como los embalses de Salto Grande y Baygorria (Río Negro) (Figura 9). No se halló una distinción marcada en cuanto al origen de las muestras. Por ejemplo, las muestras obtenidas en La Paloma para playas de Los Botes y de la Balconada se agruparon con muestras de playas de Montevideo, Ramírez y Pocitos, mientras que muestras de Salto Grande se agruparon con las correspondientes al puerto de Montevideo y de La Paloma (playa de la Balconada junto al Faro) y las de la Laguna de Rocha se asociaron a muestras de Montevideo y de la Playa de La Paloma, el Cabito (Figura 9). Estos resultados evidencian las similitudes entre los genes de mcyJ y entre los organismos de CMA, que conformaron las floraciones, a lo largo de nuestra costa.
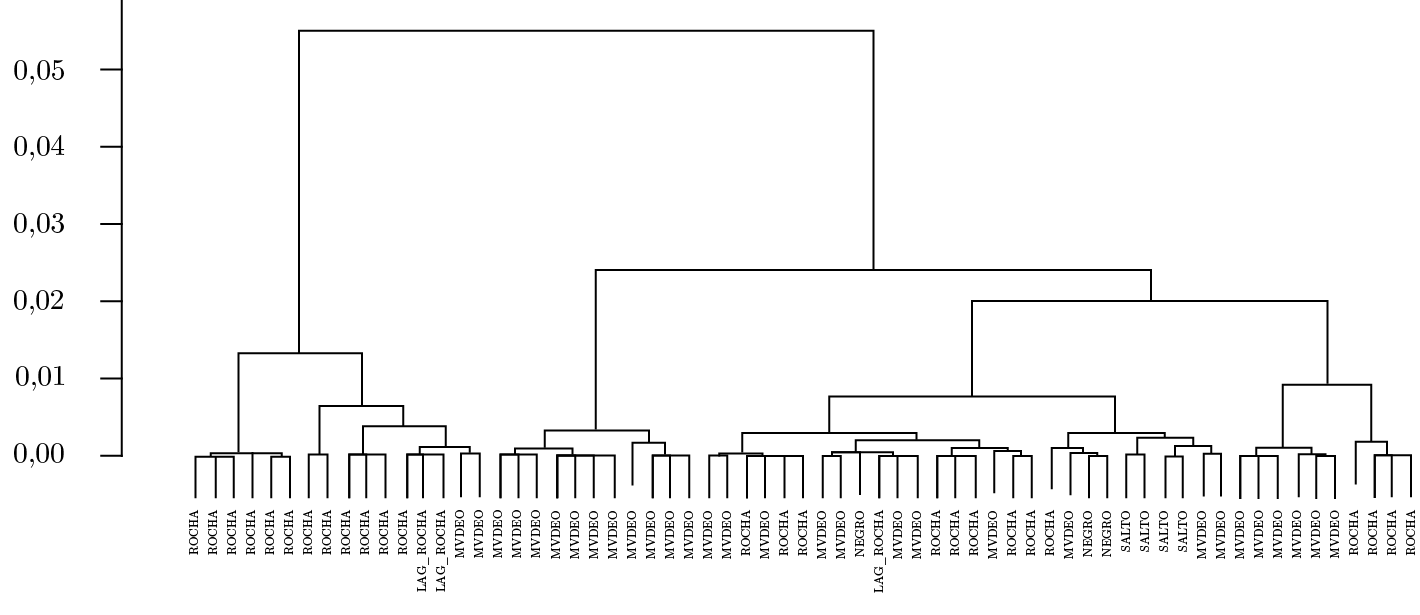
Figura 9. Diagrama que representa el análisis de cluster para las curvas de melting obtenidas por HRMA del gen mcyJ para distintas muestras de Montevideo (MVDEO), Rocha (playas de La Paloma y Laguna de Rocha), tomadas entre el 30 de enero y 7 de febrero del 2019, y para los embalses de Salto Grande (SALTO) (enero y diciembre 2013) y Río Negro (NEGRO) (marzo 2013).
Discusión
Las floraciones de cianobacterias ocurridas en la costa estuarina y atlántica de la República Oriental del Uruguay en el verano de 2019 tuvieron características que nos llevan a calificarlas de extraordinarias. Estas incluyen su amplia extensión espacial (500 km), que afectó gran parte de las playas desde Colonia hasta Rocha e incluyó ambientes de gran valor turístico (Piriápolis, Punta del Este y La Paloma) y para la conservación (lagunas de Rocha y José Ignacio), y su duración (cerca de cuatro meses). Estas floraciones fueron causadas por un restringido grupo de organismos, consignados como complejo Microcystis aeruginosa (CMA), con similares rasgos morfológicos y genéticos y, en muchos casos, asociados a concentraciones de microcistinas detectables en agua. Los organismos del CMA son de origen dulceacuícola, pero en este estudio fueron registradas grandes concentraciones (espuma) en condiciones de salinidad marina (30). Las situaciones extremas de lluvias y de caudal observado en el río Uruguay y en el RdlP sugieren que las floraciones tuvieron un origen común en la cuenca baja del Plata, donde la situación de eutrofización presenta condiciones adecuadas para el desarrollo de organismos del CMA. Esto, junto con un crecimiento positivo del CMA, garantizó su persistencia en las playas con condiciones de agua dulce. Además, las condiciones particulares de caudales y viento facilitaron la llegada de la floración hasta la costa atlántica, en Rocha.
Registros previos de CMA en la costa estuarina y atlántica de Uruguay
En estudios previos se ha observado la presencia de organismos del CMA en los ríos Uruguay y RdlP, desde Salto Grande hasta Punta del Este (Ferrari y Vidal, 2006; Bonilla, et al., 2015; Kruk, et al., 2015). Asimismo, la presencia de microcistinas fue registrada por primera vez en el RdlP en el año 1999 (De León y Yunes, 2001).Desde entonces, la frecuencia de ocurrencia de CMA ha ido aumentando hasta el presente (Sathicq, et al., 2015; Bonilla, et al., 2015). Asimismo, la presencia de genes que codifican para la producción de microcistina ha sido registrada desde el embalse de Salto Grande hasta Punta del Este (Martínez de la Escalera, et al., 2016). En la costa de Rocha (La Paloma), al menos en tres ocasiones han sido registrados organismos del CMA en muy bajas densidades celulares (Fabiano, comunicación personal). Sin embargo, según los monitoreos que realiza DINARA, eventos de floración de la magnitud del presente no han ocurrido en Rocha desde el año 1980. Tampoco se registran eventos de esta magnitud en publicaciones locales o en la memoria de actores locales relacionados al medio acuático (guardavidas, alcalde, técnicos de bromatología, entre otros).
Causas de las floraciones: origen autóctono
La salinidad y temperatura, así como también la estabilidad de la columna de agua, son las principales variables que modulan el crecimiento y formación de floraciones de CMA en los ambientes acuáticos que presentan altas concentraciones de nutrientes, como lo es el RdlP. En este estudio la temperatura del agua presentó en todos los casos valores cercanos al óptimo de crecimiento del CMA (Reynolds, et al., 2002). Por ejemplo, en condiciones de agua dulce y en base a las temperaturas observadas (23 a 30 ℃), el valor esperado para la tasa máxima de crecimiento se encuentra entre 0,5 y 0,7 d-1 (Kruk, et al., 2017). En cuanto a la salinidad, el crecimiento de CMA ocurre a valores menores a 15 (Kruk, et al., 2017), mientras que en condiciones de salinidad entre 10 y 15 la tasa máxima se reduce a 0,4 d-1 (Tonk, et al., 2007). En las playas de Rocha, la presencia de cianobacterias se registró en salinidades cercanas a 30, lo que descarta la posibilidad de crecimiento local. Valores de salinidad menores a 15 fueron observados en Montevideo, en gran parte de las playas (28 de enero y el 25 de febrero), coincidentes con la mayor frecuencia de espumas, por lo que no es posible descartar la hipótesis de crecimiento local solamente por el efecto de la salinidad. Sin embargo, el tiempo en el cual se desarrollaron las floraciones (< 5 días) permite deducir que no es factible el crecimiento local como la principal causa de la floración y su gran magnitud espacial y gran velocidad de dispersión. Por ejemplo, el cambio de densidad celular del CMA, desde un nivel de vigilancia (1000 céls ml-1) a presencia de espumas (alerta roja: 100.000 céls ml-1) a una tasa de 0,4 d-1 requiere de al menos 14 días. Mientras que el pasaje de presencia de colonias (5.000 céls ml-1) a espumas (100.000 céls ml-1) requiere nueve días. Una vez establecidas las floraciones con gran biomasa de cianobacterias, las condiciones de agua dulce en la costa habrían facilitado el mantenimiento temporal de las floraciones y su re-inoculación en diferentes ecosistemas.
Causas de las floraciones: origen alóctono por aportes desde tributarios locales
El origen alóctono podría deberse al transporte de organismos por las descargas de pequeños tributarios en áreas adyacentes a las playas. En los ecosistemas de la Cuenca del Plata en Uruguay, Argentina y Brasil las floraciones de CMA se observan principalmente en grandes embalses, mientras que floraciones de cianobacterias filamentosas (ej.: Dolichospermum) son más frecuentes en cuerpos de agua someros y más pequeños, así como en ambientes lóticos (ej.: Bonilla, et al., 2015; Haakonsson, et al., 2017; Pacheco, et al., 2010; Crisci, et al., 2017). Floraciones de cianobacterias filamentosas también han sido observadas en Salto Grande, pero en mucho menor proporción (Bordet, et al., 2017). En Rocha, especialmente en la Laguna de Castillos, se han registrado floraciones de cianobacterias en varias ocasiones anteriores, principalmente especies filamentosas (Pérez, et al., 1999; Martínez, 2014; Martínez et al., 2016), al igual que en la presente temporada estival (Martínez, observación personal). En las lagunas de José Ignacio y de Rocha se ha registrado presencia de CMA, e incluso floraciones, en ocasiones aisladas (Rodriguez-Gallego, et al., 2017). En esta ocasión, la apertura de la conexión al mar que tenía la Laguna de Rocha durante el evento propició el ingreso de organismos del CMA con similar composición, morfología y estructura genética a los registrados en las playas lejanas. Es interesante destacar que en la Laguna Garzón, que no estuvo conectada con el mar durante ese período, no se observaron estos organismos, mientras que en la Laguna Negra se registraron organismos del CMA con una morfología diferente, lo que nos lleva a descartar que correspondieran al evento costero. Pequeños efluentes pluviales y fluviales cercanos a las playas afectadas por las floraciones fueron también evaluados, pero no presentaron organismos del CMA. Estudios puntuales realizados en distintos períodos entre 2003 y 2012 en Canelones (arroyos Solís Grande, Solís Chico y Pando) no mostraron la presencia de floraciones o de cianobacterias (A. Acuña, comunicación personal; L. Rodríguez-Graña, comunicación personal). Finalmente, el río Santa Lucía (Montevideo), uno de los principales tributarios de la zona costera, presenta una taxocenosis fitoplanctónica caracterizada por una baja proporción de cianobacterias, conformadas principalmente por organismos filamentosos (Bonilla, et al., 2015; Aubriot, et al., 2017; Olano, et al., 2019). Este conjunto de información no respalda la hipótesis sobre los tributarios menores como aportes a las floraciones costeras. Sin embargo, se debería considerar una evaluación sistemática de todos los tributarios a lo largo de la costa estuarina y atlántica de Uruguay para poder refutar esta propuesta. Si bien la contribución de floraciones por parte de los tributarios locales parece ser baja o nula, el aporte puntual de agua dulce con una concentración de nutrientes necesarios para el crecimiento podría ser importante (Rodríguez-Gallego, et al., 2017; Aubriot, et al., 2017; Muniz, et al., 2019).
Los resultados respecto de la composición, morfología, características genéticas y producción de microcistinas indican que todas las floraciones del CMA a lo largo de la costa estuvieron compuestas por un grupo homogéneo de organismos. En todos los casos se trató de organismos coloniales CMA de gran tamaño, lo que se ha asociado con mayor toxicidad (Wang, et al., 2013). El análisis de HRMA del gen mcyJ, que codifica para microcistinas, agrupó conjuntamente muestras de este verano, de distintos ambientes de Montevideo y Rocha, así como también con organismos analizados otros veranos pertenecientes a Salto Grande y al Río Negro, lo que indica gran similitud entre los organismos formadores de esas floraciones (Martínez de la Escalera, et al., en revisión). Esto apoya la idea de un origen común y no la de diversos orígenes en tributarios alejados entre sí. La baja diversidad genética y morfológica de los organismos observados, sumada a la rapidez del inicio y extensa distribución de las floraciones, sustenta la hipótesis de que el evento tuvo un origen común, alóctono y no asociado a los pequeños tributarios a lo largo de la costa uruguaya.
Causas de las floraciones: origen alóctono desde ríos Uruguay, Paraná y Río Negro
Las grandes lluvias, en la zona baja de la Cuenca del Plata, afectaron particularmente al río Uruguay, en la zona de influencia del embalse de Salto Grande. Las precipitaciones acumuladas en enero de 2019 representaron un récord para los últimos 30 años (Artigas 670 mm), superando los acumulados para el mismo mes durante 1998 bajo condiciones del fenómeno El Niño (Artigas 449 mm). La cuenca del Río Negro también se vio afectada por las precipitaciones y su caudal aumentó durante el período de estudio. El río Paraná, si bien generalmente aporta grandes volúmenes de agua al RdlP, en esta ocasión no resultó ser el más afectado por estas lluvias y sus aportes fueron relativos.
La costa uruguaya del RdlP se caracteriza durante el periodo estival por una baja descarga de agua dulce, temperatura media de 24 ℃ y vientos predominantes del sector NE, la pluma de descarga es volcada hacia la costa argentina y una mayor influencia de las ramas costeras de corrientes subtropicales en Uruguay (cálidas y salinas; Ortega y Martínez, 2007). Durante el verano de 2019, la combinación de condiciones extremas de lluvias que incrementaron el caudal de los ríos Uruguay y Río Negro, moduladas por la intensidad y dirección del viento, resultaron en un corrimiento de la pluma de descarga, acompañada de mayor turbidez, menor salinidad y mayor temperatura sobre la costa uruguaya. Este fenómeno arrastró aguas abajo las elevadas concentraciones del CMA y propiciaron su traslado a lo largo de toda la costa uruguaya.
En un estudio de revisión de fitoplancton del río Paraná se indica que las cianobacterias son abundantes en las represas al inicio del río y en sus zonas medias, pero poco frecuentes en los tramos finales (Delta del Paraná, Reserva de Biósfera) (Devercelli, et al., 2014). En la represa de Yacyretá son frecuentes las floraciones del CMA y el registro de las toxinas asociadas (Forastier, et al., 2016). Estos estudios indican que las floraciones serían transportadas aproximadamente 300 km aguas abajo de Yacyretá y no son registradas 50 km aguas abajo de la confluencia con el río Paraguay. En el tramo final del Paraná existen algunos registros del CMA que ocurrieron asociados a pulsos del fenómeno La Niña (finales de 2008), sin alcanzar grandes densidades celulares (Dogliotti, et al., 2018). En este sentido, la evidencia sugiere que el aporte de floraciones del CMA al RdlP no estuvo primordialmente relacionado a poblaciones provenientes desde el río Paraná. Sin embargo, es necesario evaluar información específica del presente periodo.
Se ha registrado frecuentemente la ocurrencia de floraciones del CMA en los embalses de Salto Grande y del Río Negro (e.g.: González-Piana, et al., 2017; Bordet, et al., 2017). Estas floraciones podrían ser transportadas desde los embalses hacia el tramo final del río Uruguay y luego al RdlP. De acuerdo al programa de vigilancia de playas del río Uruguay, durante el periodo de estudio se observó una mayor frecuencia de alertas en el embalse, previo a la apertura de las compuertas, una disminución durante la apertura y un incremento al cerrarlas nuevamente, así como un incremento de alertas aguas abajo del embalse durante su apertura (Nueva Palmira). Estos resultados apoyan la hipótesis que sugiere que las floraciones se generan de forma alóctona en áreas de aguas quietas (embalses, remansos) de la zona baja de la cuenca del Plata, donde están presentes durante gran parte del año. La similitud genética entre las muestras del embalse de Salto Grande, del Río Negro y las muestras tomadas a lo largo de toda la costa sugieren un pool similar de especies asociadas al tramo inferior del Río Uruguay. Para confirmar estos resultados es fundamental complementar esta información con el análisis de muestras tomadas en estos embalses durante el período de estudio. Las floraciones del CMA ocurren en temporada estival, frecuentemente sobre la costa de Argentina del RdlP (Andrinolo, et al., 2007; Sathicq, et al., 2015). Sin embargo, durante el período en estudio, en la desembocadura de los tributarios del Paraná y en la costa argentina del RdlP, se informó la ausencia de floraciones (M.C. González, comunicación personal), apoyando la hipótesis del origen alóctono de las floraciones, específicamente en el río Uruguay.
Dinámica de las floraciones en el Río de la Plata y costa oceánica
Durante el evento de arribo de cianobacterias a la costa rochense predominaron vientos débiles del E-NE sobre el Río de la Plata que favorecieron la descarga de la pluma de agua dulce hacia la costa uruguaya, lo que sumado al gran caudal descargado propició la llegada a esta región de aguas con características atípicas para la fecha. Por otra parte, los registros satelitales y de medidas in situ permiten inferir una advección de aguas cálidas, desde el interior del RdlP hacia la costa atlántica. Este transporte habría desplazado masivamente a las floraciones de cianobacterias hacia la costa uruguaya, a diferencia de lo sucedido en la costa argentina, donde no se percibió la presencia importante de cianobacterias. Esto habría sido facilitado por la gran capacidad de flotación de los organismos del CMA, que se vuelve aún mayor con altas salinidades características de ecosistemas marinos (Kruk, et al., 2018)
Conclusiones
Teniendo en cuenta las similitudes morfológicas y genéticas de los organismos que formaron las floraciones observadas, la relación temporal de los eventos, las condiciones ambientales a lo largo de la costa, así como una relación notoria entre el caudal del RdlP y sus grandes tributarios, la evidencia indica que las floraciones ocurridas en la costa de Uruguay tendrían un origen alóctono común, principalmente en embalses de la cuenca baja del Plata. Su mantenimiento en el tiempo podría haber sido favorecido por el crecimiento local en las zonas de baja salinidad, influido por los aportes de agua dulce rica en nutrientes proveniente de los ríos Uruguay, Paraná y de otros tributarios a lo largo de la costa uruguaya. En el caso de las floraciones registradas en la región correspondiente al departamento de Rocha, si bien se trató de un fenómeno transitorio, fue notoria su intensidad y toxicidad, posiblemente asociadas al gran tamaño de los organismos (Wang, et al., 2013).
El incremento de las floraciones como resultado de la eutrofización asociada a las actividades antrópicas en las cuencas de drenaje ha sido ampliamente demostrado, tanto internacionalmente como en la región. Sería relevante analizar el efecto de las distintas actividades y su aporte porcentual al incremento de las floraciones en la cuenca del río Uruguay, tal como fuera realizado en el Río Negro (Arocena, et al., 2018) y en otros ambientes de Uruguay (e.g. Aubriot, et al., 2017; Chalar, et al., 2017; Rodríguez-Gallego, et al., 2017).
Los mecanismos que generaron condiciones climáticas extremas en la región durante el verano 2019 aún no han sido caracterizados y son un tema de investigación actual. Por otro lado, a mayores escalas de tiempo se prevé un aumento de los máximos anuales de precipitaciones y un aumento de la frecuencia de precipitaciones, más intensas para el Sudeste de América del Sur, incluyendo la cuenca baja del Plata (Re y Barros, 2009; Barros, et al., 2000). La cuenca del Plata es una de las más afectadas a nivel mundial en términos de cambios en la descarga de sus tributarios, lo que se incrementará notoriamente en comparación con el resto del mundo (Wang-Erlandsson, et al., 2017) especialmente en la cuenca del Río Uruguay (Barros, et al., 2000; Tucci y Clarke, 1998). La cuenca del Plata es además una de las cuencas con mayor producción agropecuaria y de interés para la construcción de nuevos embalses. Es por ello fundamental considerar los cambios de precipitaciones y otros moduladores de la descarga de los ríos, así como las proyecciones de distintos usos de los suelos en la región, utilizando arreglos espaciotemporales adecuados para contribuir a futuros modelos, a fin de predecir el desarrollo de floraciones en la costa de Uruguay.
Reconocimientos
Los autores agradecen a las intendencias de Montevideo y de Rocha, a la Alcaldía de La Paloma y a la Dirección Nacional de Recursos Acuáticos por ceder la información de sus respectivos monitoreos en las playas de Montevideo y Rocha, así como por la disponibilidad para realizar reuniones y discutir, en conjunto, la problemática. Agradecemos también a los guardavidas de la Paloma, los guardaparques de Laguna de Rocha y vecinos de La Paloma, por el aporte de muestras e información, así como también a los investigadores del Proyecto DINAMA, Monitoreo de Lagunas Costeras y al SNAP, por la coordinación de los embarques. También agradecemos a D. Calliari y G. Martínez por la provisión de muestras durante el evento. Este trabajo forma parte del proyecto «Análisis estadístico de variables atmosféricas e hidrográficas para la predicción de floraciones de cianobacterias en el Río Uruguay y costa de Montevideo», financiado por el Fondo sectorial de investigación a partir de datos (2017) – Agencia Nacional de Innovación e Investigación de Uruguay (FSDA1/20171144351). AMS agradece al proyecto Fondo Vaz Ferreira.
Referencias
