Autores
- Proverbio, Carlos (1); Carnevia, Daniel (2); jorge-Romero, Gabriela (1); Lercari, Diego (1)
- UNDECiMAR, Facultad de Ciencias, Universidad de la República, Montevideo, Uruguay.
- Facultad de Veterinaria, Universidad de la República, Montevideo, Uruguay.
Tradicionalmente en Uruguay, la almeja amarilla Mesodesma mactroides ha sido explotada artesanalmente en la costa oceánica. Su consumo se ha valorado notoriamente y se ha convertido en un producto gastronómico codiciado. Para obtener un producto seguro y de calidad se realiza un proceso de depuración (de arena), manteniendo las almejas en tanques de agua marina por un corto período. Sin embargo, no existen estudios acerca de los efectos de este proceso ni un análisis de las condiciones óptimas de depuración. El objetivo de este trabajo fue evaluar experimentalmente técnicas que permitan mantener en buen estado a ejemplares de M. mactroides en condiciones de cautiverio. Se realizaron ensayos en los que se evaluó marcaje por etiquetado, dietas, tipos de agua marina artificial, posición anatómica de los organismos y sustrato utilizado en cautiverio. Los resultados mostraron que el método de marcaje no afectó la sobrevivencia y no se alteró la legibilidad de las marcas. La Spirulina seca resultó adecuada como dieta alternativa. El agua artificial aumentó significativamente la sobrevivencia luego de la primera semana de experimentación. Mantener a los individuos en posición vertical aumentó significativamente la sobrevivencia respecto a la posición horizontal. Estos resultados tienen aplicabilidad experimental inmediata y contribuyen a mediano plazo al desarrollo de la especie en cautiverio.
Palabras clave: Mesodesma mactroides, cautiverio, largo-plazo.
Introducción
Los bivalvos filtradores (entre ellos las almejas) cumplen un importante rol en el flujo de materia y energía, impactando de manera significativa en los procesos fisicoquímicos de los ecosistemas en que habitan. Son entonces componentes fundamentales de la salud de estos sistemas y brindan importantes servicios ecosistémicos (Coen, 2007; Dame, 2012).
La explotación de los bivalvos por el hombre como fuente de alimento de calidad se remonta a los orígenes de la humanidad. En la actualidad las poblaciones sujetas a explotación sufren los mismos problemas que otros recursos pesqueros: sobreexplotación y deterioro de las condiciones ambientales debido a la contaminación, eutrofización y cambio climático (Defeo y de Alava, 1995; Lercari, et al., 2002; Ortega, et al., 2012).
El proceso de comercialización de bivalvos para consumo humano en general implica un procesamiento previo de eliminación de arena y posibles contaminantes, exigido por la legislación internacional o nacional como medio para proteger a los consumidores garantizando un producto seguro (National Shellfish Sanitation Program - NSSP, 2009; FAO, 2010; Richards, 2010). La depuración es el proceso realizado en condiciones de cautiverio por el cual se eliminan contaminantes microbianos y químicos de los moluscos bivalvos, asegurando el suministro de agua limpia para que lleven a cabo su actividad normal de filtración y bombeo durante períodos variables de tiempo. El éxito de este procedimiento implica la reanudación de la actividad filtradora por parte de los individuos de la especie objetivo. Para ello se debe asegurar la provisión constante de agua marina natural o artificial con los adecuados parámetros fisicoquímicos y microbiológicos para el correcto desarrollo del proceso de depuración. El tiempo necesario para lograr la eliminación efectiva total o parcial del contaminante depende de su naturaleza, de la especie en cuestión y de las condiciones del proceso de depuración (FAO, 2010).
La almeja amarilla Mesodesma mactroides es un molusco bivalvo infaunal habitante de la zona intermareal en playas de la costa Atlántica de América del Sur, desde Santos (Brasil, 24º S) hasta Río Negro (Argentina, 41º S) (Fiori y Morsán, 2004). M. mactroides vive enterrada en la arena en posición vertical a profundidades mayores a los 10,0 cm (Celentano, et al., 2019), preferentemente en la zona intermareal de playas disipativas, un ambiente rico en nutrientes y oxígeno, pero a la vez dinámico. En Uruguay, la pesca artesanal de M. mactroides se desarrolla en una franja de costa de 22 km de extensión entre la Coronilla y Barra de Chuy (Gianelli, et al., 2015). En una primera etapa (1960-1987), la extracción se realizó bajo régimen de acceso abierto al recurso, lo que llevó a su sobreexplotación, colapso y cierre de la pesquería por 32 meses (de abril de 1987 a noviembre de 1989) (Defeo, et al., 1992). Desde el año 2009 la explotación se realiza bajo régimen de co-manejo (Gianelli, et al., 2015), se otorgan cuotas de pesca y se busca la comercialización viva del recurso para consumo humano (Defeo, 2015) y su posicionamiento como producto gourmet.
Pese a la importancia de M. mactroides en la región y su potencial interés acuícola (Carnevia, 2007), no existen estudios para maximizar el tiempo de sobrevida de la especie fuera de su medio natural, ya sea con fines experimentales o comerciales. En Uruguay, el tratamiento previo a la comercialización de M. mactroides implica la depuración de arena en recipientes de 700 L con agua marina tomada de la costa y durante un período de 48 horas. Los actuales usuarios de este recurso se enfrentan a una serie de problemas entre los cuales se destacan el suministro de agua de depuración, las constantes vedas por marea roja y la imposibilidad de mantener con vida y en buenas condiciones a las almejas capturadas por relativamente largos períodos de tiempo, con el fin de disponer de un stock de comercialización. Actualmente la investigación más básica acerca de las condiciones de cría de este recurso resulta insuficiente. Al respecto, son desconocidas las condiciones óptimas en cuanto a la calidad y tipo de agua, opciones básicas de alimentación natural o artificial, y métodos de marcaje e identificación individual de los organismos vivos, entre otros aspectos. Este estudio incorpora herramientas y métodos experimentales sencillos ampliamente utilizados en acuicultura, de bajo costo y tecnología básica, para evaluar su aplicación en M. mactroides.
Dado el incipiente conocimiento acerca del mantenimiento de M. mactroides fuera de su medio natural, este trabajo evalúa técnicas básicas que permitan la sobrevivencia a largo plazo de los organismos en condiciones controladas de laboratorio, minimizando los cambios en la condición fisiológica. La estrategia del estudio consistió en la implementación de experimentos factoriales donde se evaluaron los efectos en la sobrevivencia y condición corporal de diferentes tipos de agua marina artificial (AMA), dietas, posición anatómica de los organismos y el sustrato, e identificación individual de los organismos.
Materiales y métodos
Muestreo
La extracción de las almejas se realizó en la franja costera arenosa comprendida entre La Coronilla y Barra del Chuy (LCBC), en la costa oceánica del departamento de Rocha, Uruguay (Figura 1). Los organismos fueron extraídos manualmente. Se registró la salinidad y temperatura in situ con termosalinómetro YSI EC300. Las almejas extraídas se acondicionaron para su transporte, enterradas en recipientes con arena seca. En el laboratorio las almejas fueron enjuagadas en agua marina artificial (AMA) (salinidad = 21,9 ± 0,1) y colocadas 5´ sobre papel secante. Se midió la longitud máxima del eje antero posterior con vernier Stronger y su masa (MHTi) en balanza digital de precisión OHAUS Adventurer. El acondicionamiento previo a las experiencias se realizó en un tanque de 100 L con AMA Sera marine basic salt y se mantuvieron las características ambientales: salinidad 21,9 ± 0,1 (Carvalho, et al., 2015), pH = 8,00 ± 0,15 temperatura 12,0 ± 1,0 C. El período de acondicionamiento fue de seis días, y las almejas se colocaron horizontales sin suficiente sustrato para enterrarse y sin alimento (Sauco, et al., 2013). Se contó con un sistema de recirculación a través de filtro físico y biológico y luz UV. Se suministró aireación constante a niveles de saturación de oxígeno. En todas las experiencias se utilizaron almejas sin roturas y talla comercial (≥ 50 mm; Gianelli, et al., 2015), con excepción de los experimentos de marcaje en los cuales los individuos fueron clasificados en dos tallas: < 50 mm (juveniles y no comerciales) y ≥ 50 mm (adultos comerciales).
Figura 1. Ubicación de la playa La Coronilla - Barra del Chuy (LCBC) en la costa atlántica uruguaya, lugar de la extracción de los ejemplares de M. mactroides utilizados en los experimentos.
Método de marcaje
Se marcaron 20 almejas, 10 de tamaño < 50 mm y 10 mayores a 50 mm. Se comparó su sobrevivencia respecto a almejas de los mismos rangos de tamaño no marcadas. Las marcas consistieron en etiquetas de nylon transparentes numeradas con marcador indeleble y adheridas a las valvas con pegamento de cianoacrilato. El tiempo de manipulación para el marcaje con etiquetas fue de aproximadamente 1 minuto por individuo. Los organismos se colocaron en el tanque experimental común de 100 L con recirculación de agua y se registró la mortalidad durante seis días. Se analizaron las curvas de sobrevivencia (método Kaplan-Meier, método Log-rank) para todos los tratamientos experimentales.
Dietas
El diseño experimental consistió en seis tratamientos con 10 unidades experimentales (UE) individuales cada uno. Estas consisten en contenedores plásticos de 0,5 L con AMA comercial (salinidad 21,0 ± 0,5) y aeración a saturación donde se colocó una sola almeja; en total se colocaron 60 almejas ≥ 50 mm. Los tratamientos evaluados fueron: C: control sin alimentación; S: alimentación con Spirulina deshidratada (0,021 g/día); K: alimentación con harina de krill (0,021 g/día); SS: alimentación con Spirulina deshidratada (0,021 g/día) + sacarosa (0,071 g/día); KS alimentación con harina de krill (0,021 g/día) + sacarosa (0,071 g/día).
Se registró la mortalidad diariamente y se evaluaron las curvas de sobrevivencia y el tiempo medio de sobrevivencia. Los cambios en la condición corporal se evaluaron mediante el índice IC = Masa Seca de Pulpa (MSP, g)/Masa Seca Total (MST, g), que puede ser estimado utilizando instrumentos y cálculos simples (Galvao, et al., 2015). La obtención de la MST se realizó secando las muestras en estufa a 45 ± 5 ℃ hasta obtener una masa constante. La MSP se obtuvo separando la pulpa de las valvas. Antes del inicio del experimento se determinó el IC a una muestra de 17 almejas a los efectos de comparar el estado inicial y final.
Para evaluar cambios en variables de calidad del agua durante el desarrollo de los experimentos se realizaron medidas semanales al azar en tres UE de cada tratamiento; se determinaron los sólidos sedimentables (SS) (Avnimelech, 2009) y el pH mediante un medidor portátil de pH. El amoníaco NH3 se midió mediante un test kit colorimétrico semicuantitativo para acuarios marinos Sera ®, pero no fue posible la realización de medidas repetidas en cada instancia.
Las funciones de sobrevivencia se compararon globalmente y de a pares (método Kaplan-Meier, método Log-rank, Kaplan y Meier, 1958). Se ajustó el modelo de regresión de Cox por el método Efron a los efectos de determinar si existieron efectos significativos de los tratamientos sobre el tiempo de sobrevivencia y los riesgos relativos en comparación con el control. Se realizó un ANOVA de una vía para evaluar las diferencias entre la media del tiempo de sobrevivencia y el IC entre cada tratamiento del factor dieta.
Agua marina artificial
Se compararon los costos y la sobrevivencia de la especie en dos aguas marinas artificiales, un agua marina comercial (Sera Marine Basic Salt ®) y un AMA preparada según una fórmula provista por FAO (2010). El costo en plaza por litro de las aguas artificiales es similar: AMA comercial 0,19 US$/L; AMA fórmula FAO (FAO, 2010) 0,17 US$/L.
El diseño experimental consistió en dos tratamientos con 10 UE individuales cada uno, en contenedores de plástico de 0,5 L: 10 con AMA comercial y 10 AMA FAO (salinidad 21,0 ± 0,5) y aeración a saturación, donde se colocó una sola almeja. En total se colocaron 20 almejas de talla comercial (≥ 50 mm). Se registró la mortalidad durante 30 días y se obtuvieron y compararon las curvas de sobrevivencia según la regresión de Cox por el método Efron. Se registró la media de los tiempos de sobrevivencia para ambas aguas artificiales y se compararon utilizando un ANOVA de una vía para el factor tipo de agua marina artificial.
Posición de vida y sustrato
El diseño experimental consistió en tres tratamientos con 10 UE individuales cada uno, que difirieron en la posición de los organismos. Las UE consistieron en un contenedor plástico de 0,5 L con AMA comercial y aeración a saturación donde se colocó una sola almeja. Los tratamientos fueron: almejas en posición horizontal en el fondo, almejas en posición vertical con los sifones hacia arriba soportadas por un tubo de PVC y almejas enterradas en arena como sustrato. Se registró la mortalidad durante 30 días; se construyeron y compararon curvas de sobrevivencia globales y de a pares (método Kaplan-Meier, método Log-rank, Kaplan y Meier, 1958).
Los análisis de sobrevivencia se realizaron en el programa estadístico R (R Development Core Team, 2008), utilizando el paquete R commander (Fox, 2005) y el plugin RcmdrPlugin.survival (Fox y Carvalho, 2012). Las curvas de sobrevivencia se compararon por el método Log-rank (Molinero, 2001).
Resultados
Método de marcaje
Durante los seis días del experimento de marcaje no se perdieron marcas y todas fueron legibles. Tanto para juveniles como para adultos no existieron diferencias significativas en las funciones de sobrevivencia de almejas marcadas y sin marcar (Figura 2). Se observaron diferencias significativas entre tallas, independientemente de las marcas: para la talla ≥ 50 mm fue mayor la probabilidad de sobrevivencia luego del segundo día de experimentación (Tabla 2).
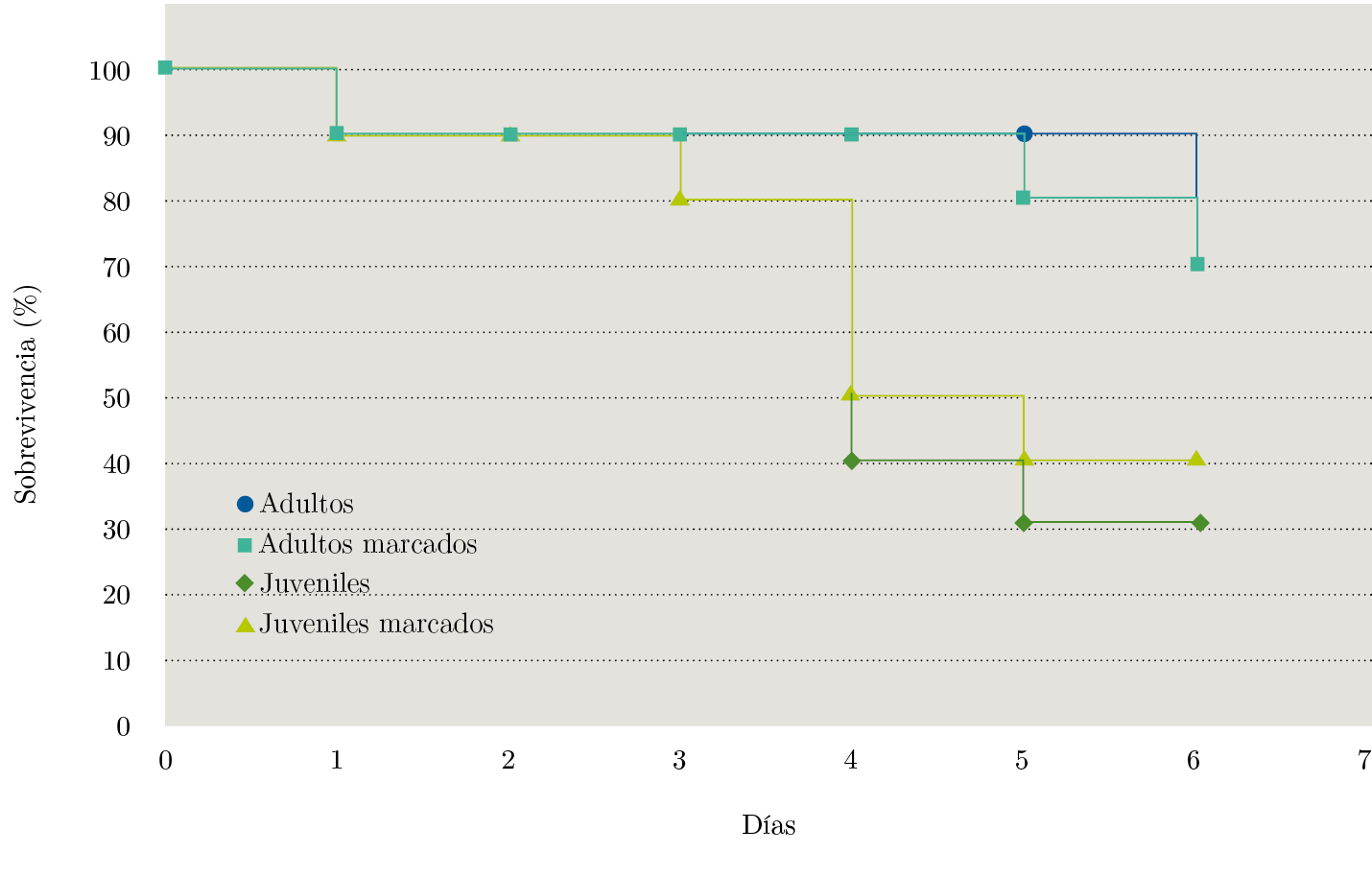
Figura 2. Funciones de sobrevivencia de la almeja amarilla para los experimentos de evaluación de marcas.
Tabla 1. Comparación de las funciones de sobrevivencia de la almeja amarilla durante seis días. N: tamaño de la muestra. Los p-valores significativos se detallan en negrita.

Dietas
La comparación de las funciones de sobrevivencia mostró diferencias significativas entre dietas (Figura 3 y Tabla 3). El ajuste de los datos al modelo de regresión de Cox por el método Efron se muestra ordenado desde un riesgo relativo de muerte menor a mayor, en comparación con el tratamiento control (Tabla 2).
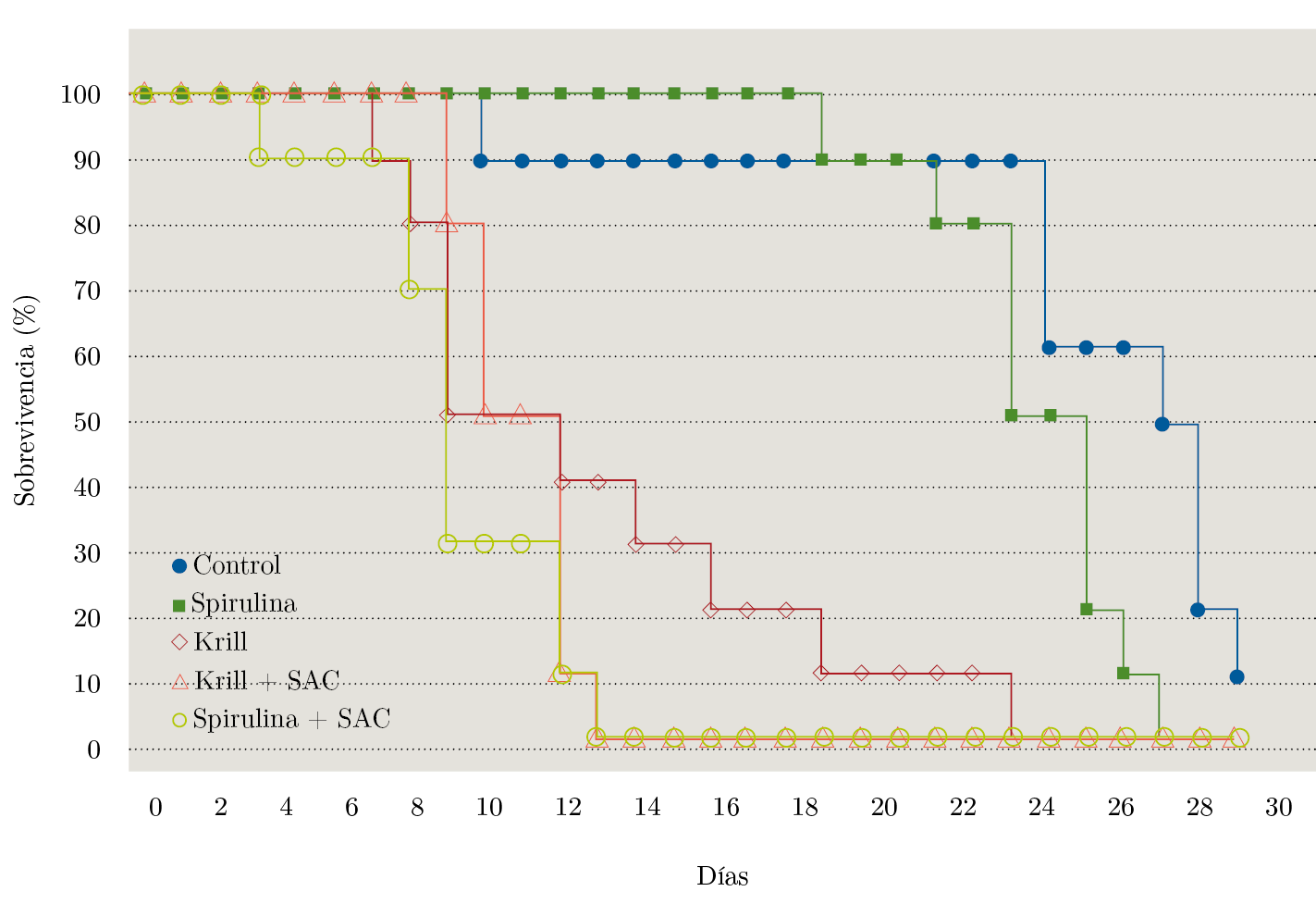
Figura 3. Curvas de sobrevivencia de la almeja amarilla para los diferentes tratamientos de alimentación.
Tabla 2. Resultados de la comparación pareada de las funciones de sobrevivencia de la almeja amarilla. Los p-valores significativos se detallan en negrita.

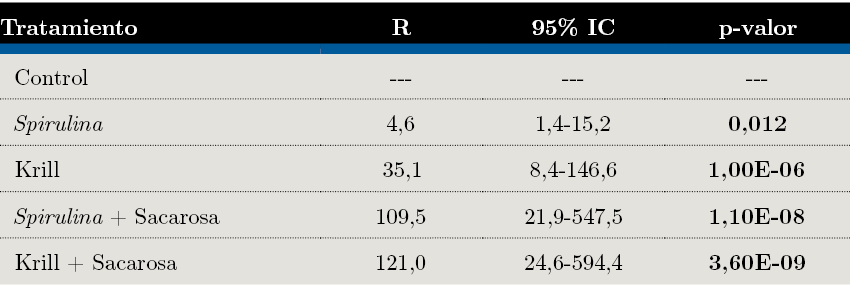
Todos los tratamientos influyeron significativamente sobre la probabilidad de sobrevivencia dentro de sus respectivos intervalos de confianza (Tabla 4). El modelo ajustó para cualquiera de los criterios de bondad: test de razón de verosimilitud (p=3,79e-12), test de Wald (p=7,47e-08) y test Score (p=4,59e-11), con una concordancia= 0,81 ± 0,05 (R²=0,65). No hubo evidencia significativa de que se viole la hipótesis de riesgos proporcionales.
Tabla 3. Resultados de modelo de Cox para los tratamientos de alimentación de la almeja amarilla. R: riesgo relativo de cada tratamiento, tomando el tamaño de la muestra como referencia. Los p-valores significativos se detallan en negrita.
La comparación del tiempo medio de sobrevivencia para los tratamientos de alimentación y el IC (Figura 4) mostró que no hubo diferencias significativas entre los tratamientos Control y Spirulina, pero sí entre estos y el resto. A su vez, todos los tratamientos resultaron en un menor IC en relación al estado inicial. El ANOVA mostró un efecto significativo de los tratamientos sobre el IC F(6,66)=8,44, p=8,39E-07. El tratamiento S fue el que produjo una menor disminución del IC.
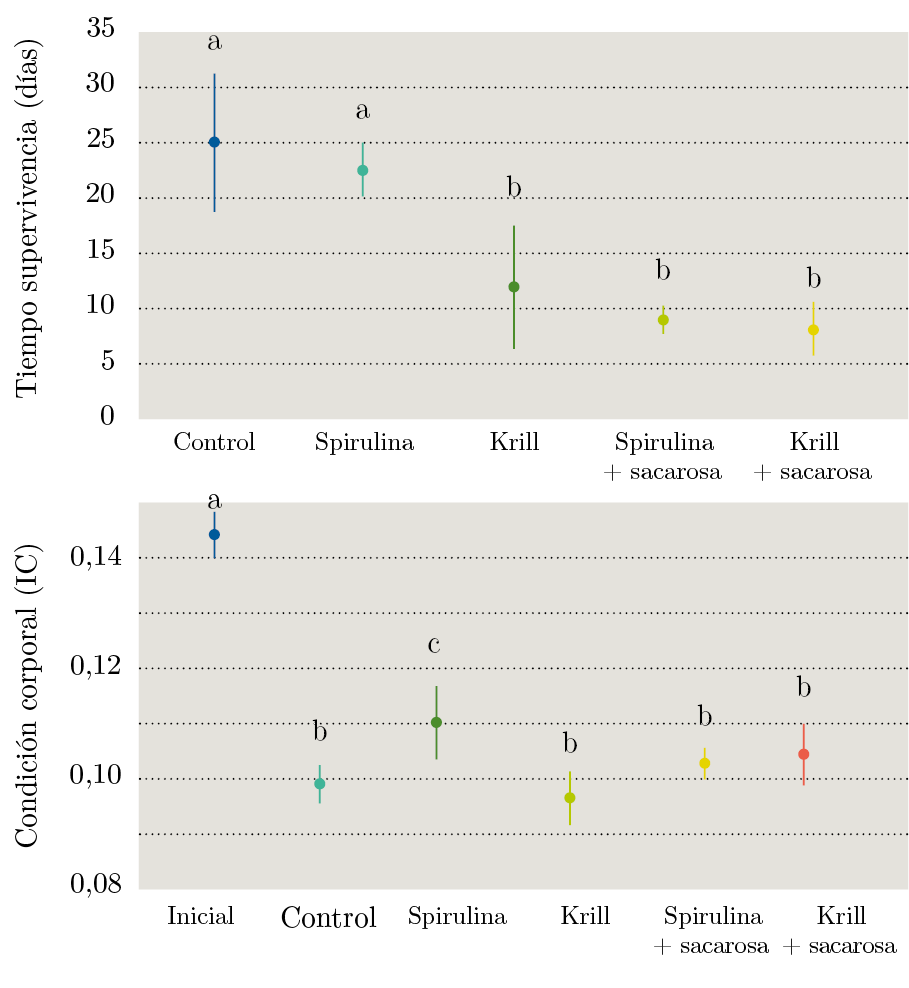
Figura 4. Tiempo de sobrevivencia (Media ± DE, arriba) e Índice de Condición Corporal (Media ± DE, abajo) de la almeja amarilla para los tratamientos de dieta.
Los cambios en variables de calidad del agua durante el transcurso del experimento se muestran en la Figura 5.
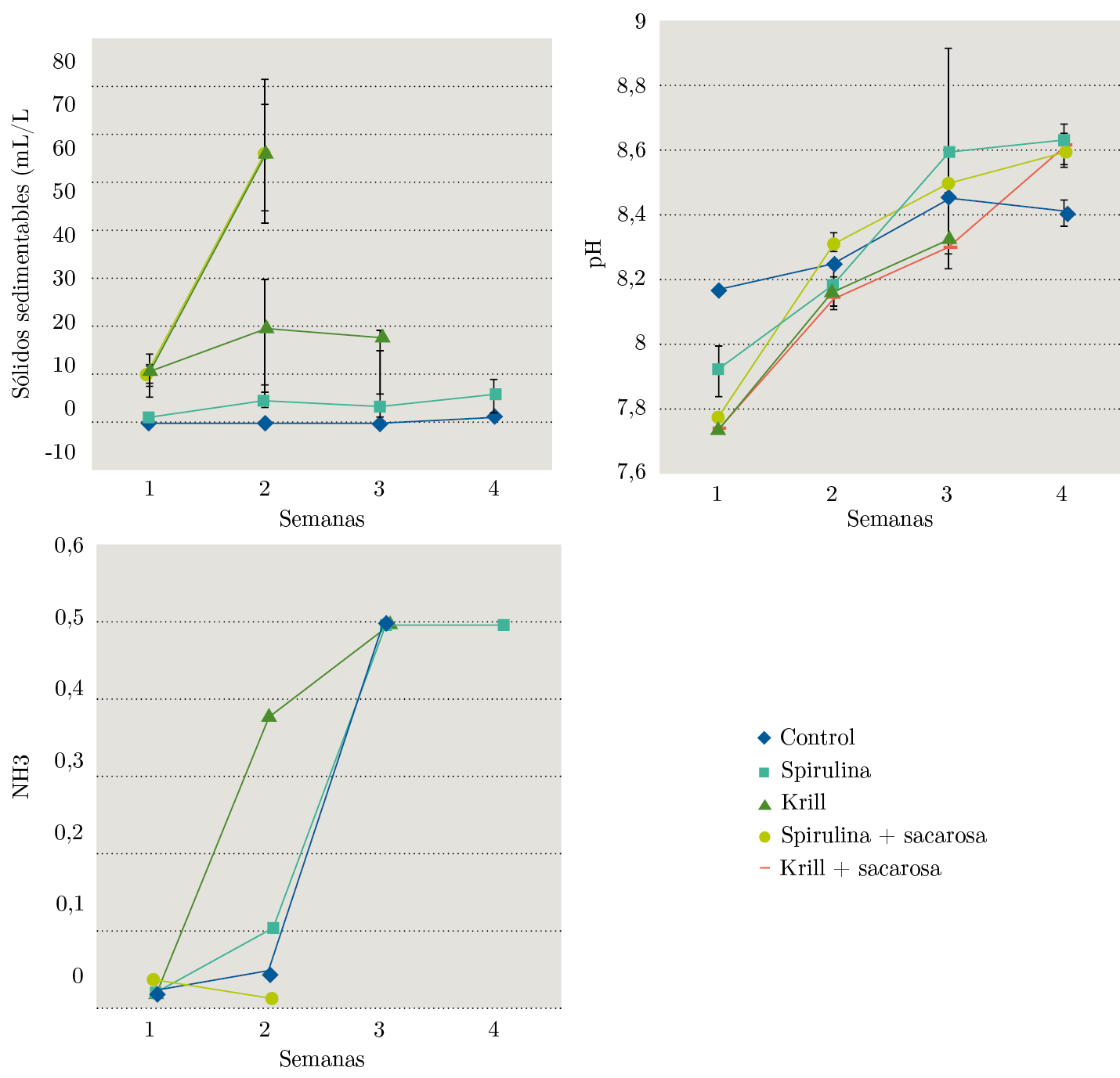
Figura 5. Sólidos sedimentables (Media ± DE), pH (Media ± DE) y NH3 (Media) para los tratamientos de dieta de la almeja amarilla. Nótese que debido al método de medición de NH3 no se contó con una estimación de variabilidad dentro de las semanas.
Agua marina artificial
La comparación de las curvas de sobrevivencia (Figura 6) para las AMAs no mostró diferencias significativas entre ellas (chi²=1,9 en 1 grado de libertad, p-valor=0,168). El ANOVA mostró un efecto significativo del tipo de agua sobre el tiempo promedio de sobrevivencia (F(1,18)=5,737, p-valor=0,028); la media del tiempo de sobrevivencia en el tratamiento con AMA comercial fue mayor que en AMA FAO (2010).
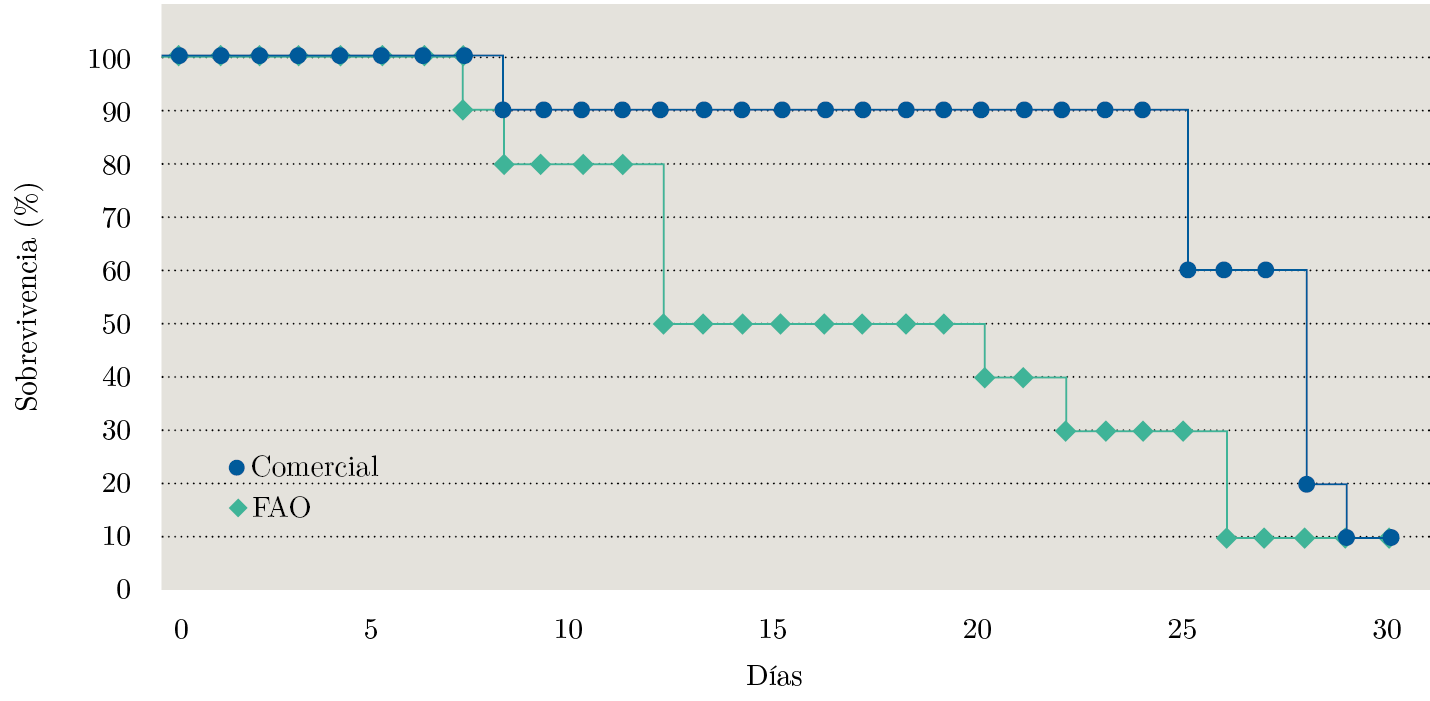
Figura 6. Curvas de sobrevivencia de la almeja amarilla para los tratamientos AMA comercial y AMA FAO (2010).
Posición de vida y sustrato
El análisis pareado de las curvas de sobrevivencia (Figura 7) mostró diferencias significativas entre los tratamientos vertical y horizontal (chi²=13,5 en 2 grados de libertad, p-valor=0,001), pero no entre los verticales con y sin sedimento (chi²=1 en un grado de libertad, p-valor=0,317).
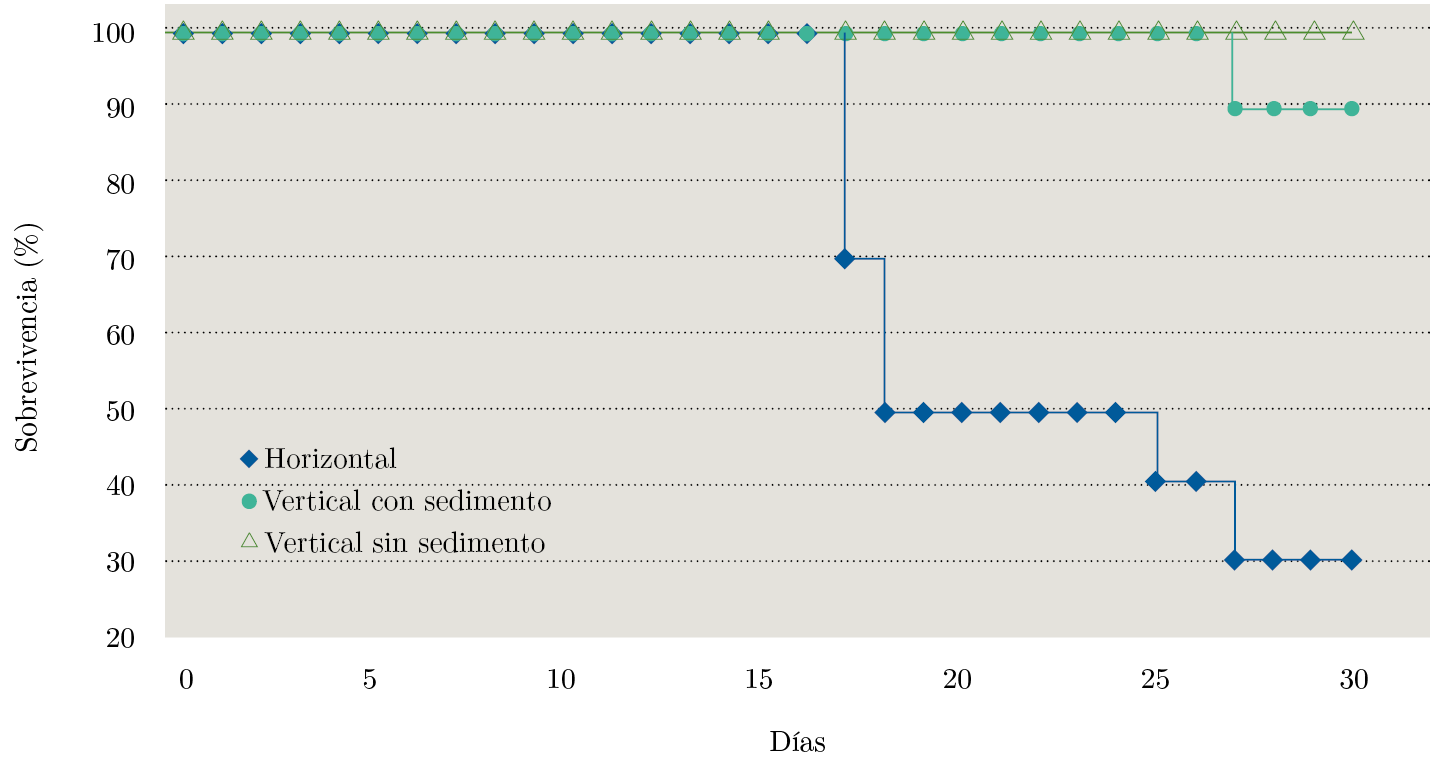
Figura 7. Curvas de sobrevivencia para los experimentos de posición anatómica: almejas en posición horizontal en el fondo, almejas en posición vertical con los sifones hacia arriba soportadas por un tubo de PVC y almejas enterradas en arena como sustrato.
Discusión
En este trabajo se exploraron de manera satisfactoria algunas condiciones de sustento artificial para la almeja amarilla M. mactroides mediante la evaluación de diferentes técnicas aplicadas al mantenimiento a largo plazo de la especie en laboratorio.
Método de marcaje
La evaluación de métodos de marcaje en M. mactroides demostró que la técnica elegida no produce un efecto negativo sobre la sobrevivencia para ninguna de las tallas probadas y que permite el seguimiento individual durante toda la experiencia. El método seleccionado es inocuo y efectivo, además es económico y ha sido probado en varias especies de moluscos bivalvos (Todolí, 2014; Riley, et al., 2010). Sin embargo, es necesario remarcar que el procedimiento es demandante en cuanto al tiempo de manipulación y adicionalmente es incierta la permanencia de las marcas en un medio natural altamente abrasivo como las playas arenosas. Por consiguiente, si se requiere marcar una muestra relativamente grande y/o el tamaño de los individuos es pequeño, existen otros métodos de marcaje cuya implementación podría ser más adecuada, como los descriptos por Lepore et al. (2009).
Independientemente de las marcas, se observó un efecto significativo de la talla sobre la probabilidad de sobrevivencia, que fue mayor en los organismos adultos de talla comercial. La menor sobrevivencia de las tallas juveniles podría deberse a distintos factores, como los estados fisiológicos y la sensibilidad a condiciones ambientales diferenciales entre tallas. La mayor susceptibilidad de estados tempranos de desarrollo en bivalvos ha sido observada anteriormente (Griffith, et al., 2019).
Dietas
Los tiempos de sobrevivencia más prolongados se logran con el tratamiento control, donde no se le suministró alimento a los animales y en el que la concentración de NH₃ aumenta hacia el final de la experiencia. En experiencias anteriores se observó una gran tolerancia a largos períodos de inanición en moluscos bivalvos (84 días), al mantener una buena calidad de agua (Albentosa, et al., 2006). Sin embargo, el tratamiento con Spirulina no mostró diferencias significativas con el control en cuanto al tiempo de sobrevivencia, en tanto que produjo menores pérdidas en el IC.
La mayor probabilidad de sobrevivencia del tratamiento con Spirulina probablemente esté relacionada a la calidad y tamaño de partícula del alimento. Mientras la Spirulina parece ser consumida por M. mactroides, la harina de krill no, ya que no se observaron diferencias en el volumen de sólidos sedimentables en los tratamientos de harina de krill con y sin almeja. El tamaño de partícula podría ser la causa de esta diferencia en el consumo entre ambas raciones. El rango de tamaño de partícula consumido por los bivalvos varía entre 1 a 100 μm (Mamat, 2010), mientras que la harina de krill utilizada tiene un tamaño de 100 a 150 μm. Por su parte, la Spirulina tiene un tamaño de célula de entre 6 y 16 μm (Ali, 2012). No se han encontrado referencias anteriores sobre el rango de tamaño de partícula consumido por M. mactroides. Existen experiencias previas de utilización de Spirulina en la alimentación de moluscos bivalvos en etapas de hatchery o con fines experimentales (Benemann, 1992; Berthet, et al., 1992; Coutteau y Sorgeloos 1992, Coutteau, et al., 1993; Bonner y Rockhill, 1994; Arney, et al., 2015), con resultados variables según la especie objetivo y la etapa de desarrollo. No se ha encontrado bibliografía previa sobre la utilización de Spirulina, otras dietas alternativas o algas vivas en la alimentación de M. mactroides, con fines experimentales o de cultivo.
No se obtuvieron buenos resultados respecto a la sobrevivencia en los tratamientos con sacarosa. La probabilidad de sobrevivencia fue más baja y el riesgo relativo superior al resto de los tratamientos. Aunque se logró mantener baja la concentración de NH₃, el rápido aumento de los sólidos sedimentables podría explicar la baja probabilidad de sobrevivencia en los tratamientos con sacarosa. En los moluscos bivalvos es conocido el efecto negativo de la turbidez sobre el fitness, la respiración, la abundancia y la sobrevivencia (Steele-Petrovic, 1975; Murphy, 1985; Ellis, et al., 2001; Newell, 2004). La producción de biofloc implica la resuspensión continua de las partículas en la columna de agua, por lo cual es un punto clave el control de los sólidos en suspensión para el éxito del cultivo de algunas de las especies objetivo (Ray, et al., 2010; Schveitzer, et al., 2013). El suministro de sacarosa no aportó a la producción de biofloc, como ha sido observado en otros estudios (Huang, et al., 2017).
Debido al suministro diario de alimento y a la ausencia de recambio de agua durante los experimentos, se evidenció un aumento de la concentración de amoníaco, indicador del deterioro progresivo de la calidad del agua y al mismo tiempo una disminución de la probabilidad de sobrevivencia de los individuos. Varias especies de moluscos bivalvos muestran una gran tolerancia a la exposición a altas concentraciones de amoníaco, durante tiempos relativamente cortos (Epifanio y Srna, 1975; Reddy y Menon, 1979), pero los efectos sobre la sobrevivencia aumentan con la exposición prolongada a concentraciones no tan altas como las registradas durante los experimentos (Zischke y Arthur, 1987; Hickey y Martin, 1999).
Agua marina artificial
La utilización de agua artificial elaborada a partir de la fórmula proporcionada por la FAO (2010), de menor costo que las sales a disposición en el mercado, no es recomendable en manejos que requieran tiempos mayores a siete días, debido a la disminución de la probabilidad de sobrevivencia. Sin embargo, podría ser una alternativa para el manejo a corto plazo, como un proceso de depuración de 48 horas. El agua artificial FAO (2010) es ampliamente utilizada para el almacenamiento de langostas y en la depuración de la ostra japonesa (Crassostrea gigas) y la almeja Mercenaria mercenaria, pero su uso parecería no ser fácilmente generalizable, por lo cual debe probarse específicamente. Los resultados sugieren que la composición del agua comercial elaborada a partir de una mayor mezcla de sales se adecúa mejor a los requerimientos fisiológicos de M. mactroides. Sin embargo, existe poca información sobre los requerimientos específicos de la especie, por lo que sería recomendable realizar estudios fisiológicos y testear AMAs con otras formulaciones disponibles.
Posición de vida y sustrato
El acondicionamiento de reproductores en algunas especies de moluscos bivalvos infaunales se realiza en bandejas que contienen un sustrato para permitir que se entierren adoptando su posición de vida. Esto facilita la filtración, alimentación y respiración, y tiene importantes consecuencias fisiológicas (FAO, 2006). Por ejemplo, Panopea generosa es acondicionada para su transporte viva sujetando las valvas con una banda elástica. La presión ejercida reduce el esfuerzo realizado por los músculos aductores para mantener las valvas cerradas, permitiendo conservar las almejas en mejores condiciones por mayor tiempo. Los efectos fisiológicos de permitir a los animales adoptar la posición de vida parecen ser más determinantes para la sobrevivencia en M. mactroides que la presencia de un sustrato que ejerza presión sobre las valvas. En futuros manejos experimentales será fundamental permitir o colocar a los animales en la posición de vida, y una solución para ello será suministrar un sustrato. Sin embargo, el uso de arena u otro sustrato particulado acarrearía dificultades a tener en cuenta en los sistemas de recirculación de agua para la depuración de estos animales (e.g. anoxia). La utilización de sustratos artificiales (e.g. espuma sintética inerte e inocua) podría ofrecer una solución a estos problemas.
Conclusiones
El uso de etiquetas plásticas numeradas pegadas con cianoacrilato mostró ser un método de marcaje inocuo, efectivo y económico, y su utilización es viable como herramienta experimental en esta especie.
La Spirulina ofrece buenas perspectivas como alimento o como parte de una dieta alternativa, si bien aún faltan estudios fisiológicos que brinden información sobre aspectos nutricionales de M. mactroides.
La calidad del agua es fundamental para la sobrevivencia en esta especie como lo es en otras de moluscos bivalvos. La gestión de los residuos nitrogenados y los sólidos en suspensión es por lo tanto un requisito indispensable para su mantenimiento en buenas condiciones.
La utilización de un AMA de menor costo podría ser una alternativa en un proceso de depuración corto como el que se realiza en la actualidad, aunque no sería recomendable su utilización en procesos o manejos que requieran tiempos más prolongados debido a la disminución de la sobrevivencia.
Otra consecuencia de aplicación inmediata para el manejo de esta especie in vitro es el efecto de la posición sobre la sobrevivencia. Cualquier manejo a mediano y largo plazo deberá permitir a los animales adoptar la posición de vida.
Reconocimientos
Se agradece a los pescadores de almeja amarilla de La Coronilla y Barra del Chuy, en especial a Nancy Schuch y Gabriel Rocha, de la empresa Almejas Palmares. Al Servicio ECCA de la Intendencia Municipal de Montevideo, en especial al Dr. Gustavo Saona. Se agradece el apoyo económico del «Programa de Vinculación Universidad - Sociedad y Producción»y del «Programa de Grupos de Investigación (Grupo 32)»de la Comisión Sectorial de Investigación Científica de la Universidad de la República.
