Autores
- Assis, João Matheus Cassiano (1); Pastre, Ieda Aparecida (1); Silva, Matheus Antônio (1)
- INSTITUTO DE BIOCIÊNCIAS, LETRAS E CIÊNCIAS EXATAS (IBILCE), UNIVERSIDADE ESTADUAL PAULISTA (UNESP), SÃO JOSÉ DO RIO PRETO, SÃO PAULO, BRASIL
Las resinas de intercambio iónico son constituidas, en su gran mayoría, por polímeros orgánicos sintéticos con estructura reticulada que forman gránulos porosos y son portadores de carga eléctrica. Estas cargas son neutralizadas por sus contraiones presentes en soluciones, los cuales son intercambiables y dan origen al proceso del cambio iónico. Las resinas, muy utilizadas en deionizadores del agua, tienen en su estructura grupos ácidos y básicos cambiables por los cationes y aniones contaminantes. Estos últimos son eliminados en una dinámica de iones con la resina en un proceso denominado desmineralización. Las pruebas comparativas propuestas para evaluar la eficacia de la recuperación de las resinas polifuncionales fueron la conductividad y la capacidad adsortiva frente a los colorantes azul de metileno (AM) y naranja de metilo (AL). La conductividad obtenida en el agua aplicada a las resinas recuperadas fue de 0,880 μS cm-1, valor contenido en el rango ideal para agua deionizada (0,5-3,0 μS cm-1). Frente a la resina comercial, la recuperada presentó una capacidad adsortiva superior; la resina recuperada aniónica (R-) adsorbió 22% más que la comercial anionica (C-), mientras que la capacidad adsortiva de la resina cationica (R+) y de la comercial catiónica (C+) fueron prácticamente semejantes. Aplicando los modelos matemáticos de adsorción, se halló que la recuperación no sufrió modificación en el perfil adsortivo, que permaneció homogéneo (Langmuir), mientras que en las resinas C+ y R+ ocurrió la modificación del perfil de adsorción, que varió de homogéneo a heterogéneo (Freundlich), respectivamente. En pruebas de espectro en la luz infrarroja fue posible constatar que la recuperación modifica la morfología de la resina pero no su estructura química.
Palabras clave: purificación de agua; adsorción en resinas polifuncionales, isotermas de adsorción, modelos de Langmuir y Freundlich.
Introducción
Las resinas de intercambio iónico están constituidas, en su gran mayoría, por polímeros orgánicos sintéticos con estructura reticulada, que forman gránulos porosos y son portadores de carga. Las cargas son oriundas de grupos ácidos y básicos, como grupos sulfonatos y aminas cuaternarias, y son neutralizadas por sus contraiones, especies intercambiables en el proceso de intercambio iónico. En este proceso, cationes y aniones de naturaleza orgánica o inorgánica son removidos de la fase acuosa por medio de una dinámica simple de adsorción física. Estas resinas se utilizan extensamente en los sistemas de purificación de agua, donde se utiliza aproximadamente 1 kg de resina dentro de los deionizadores.
En general, las resinas polifuncionales poseen viabilidad de 24 meses y poseen capacidad de deionizar aproximadamente 500 L de agua hasta llegar al estado de saturación. Después de la saturación de la resina, es enviada al entreposto de residuos para el descarte final en el vertedero. Al ser un polímero sintético y de difícil degradación en el medio ambiente, la recomendación del fabricante es la incineración (Baird, 2002). En el caso de que sea descartada directamente, la resina contribuye a la polución por microplásticos en varios ecosistemas, principalmente en el acuático (Gregory, 2009).
La propuesta de recuperación de la resina resulta viable, pues se utilizan menos recursos financieros y materiales que los derivados de la producción y la compra (o sustitución) de estas y, en consecuencia, una menor cantidad de resinas saturadas en el medio ambiente causan menos impacto ambiental.
Una de las formas de evaluar la eficacia de la recuperación de las resinas es realizando estudios adsortivos. Uno de los principales modos de estudio es la adecuación en modelos de adsorción ya establecidos, como los de Langmuir y Freundlich. Para el estudio de la adecuación de los modelos de Langmuir y de Freundlich a los datos experimentales se emplearon las ecuaciones linealizadas.
El modelo de Langmuir (Ecuación 1) describe cuantitativamente la formación de monocapa del adsorbato en la superficie del adsorbente y no considera la transmigración del adsorbato en el plano de la superficie. Es válida para la adsorción en monocapa en superficies que contienen un número finito de lugares idénticos y una energía uniforme.
$$\frac {Ce}{qe} = {\frac {1}{QmKL}+\frac{1}{KL}Ce}$$ (1)
Donde:
qe representa la cantidad adsorbida por gramo de adsorbente en el equilibrio (mg g-1); Ce es la concentración del adsorbato en el equilibrio (mg L-1); Qm representa la cobertura máxima de la monocapa (mg g-1), y KL es la constante de Langmuir (L mg-1), que está relacionada con la energía de adsorción que refleja la afinidad entre adsorbente y adsorbato (Marco-Brown, et al., 2014).
El modelo de Freundlich describe mejor la adsorción en superficies heterogéneas donde ocurre adsorción en multicamadas con interacción entre las moléculas de adsorbato. Es representado matemáticamente por la Ecuación 2.
$$lnQe = {lnK_F+\frac{1}{n}lnCe}$$ (2)
Donde:
KF es la constante de Freundlich (mg g-1) que indica la capacidad de adsorción; Ce es la concentración del adsorbato en el equilibrio (mg L-1); Qe es la cantidad adsorbida por gramo de adsorbente en el equilibrio (mg g-1), y n indica cualitativamente la reactividad de los sitios de conexión (Sodré, 2001).
Objetivos
Separar y recuperar resinas apunta a reducir los costos de su sustitución en el sistema de purificación del agua implantado en los laboratorios didácticos y de investigación de los campus de la UNESP. Además, proporciona un fin alternativo para un residuo sin un plan de descarte que sea ecológicamente correcto. En este contexto, el objetivo de este trabajo es estudiar y evaluar la recuperación y capacidad adsortiva de la resina empleada en los purificadores del agua.
Materiales y Métodos
El proceso de recuperación de la resina se realizó en tres etapas.
La primera etapa incluyó la separación de las resinas catiónicas y aniónicas. Para esto, fue preparada una solución acuosa de una sal inorgánica, que posee una densidad intermedia entre las dos resinas. De esta manera, las resinas son separadas por densidad intermedia entre las dos resinas. Luego, la fracción de la resina aniónica y catiónica se diferenció por medio de la adsorción del colorante AM. En la camada superior se identificó la presencia de la resina catiónica, en la camada inferior, de la camada aniónica.
La segunda etapa involucró tratamiento específico de cada resina con solución ácida y básica, ambas con una concentración de 1 mol L-1, bajo agitación de 30 minutos. A continuación, las resinas fueron lavadas con agua desmineralizada, agitándose por 30 minutos. Las resinas fueron puestas en una columna y lavadas con agua desmineralizada hasta verificar que el pH del agua de salida fuera igual al pH del agua de entrada en la columna.
La tercera etapa implicó la elaboración de un sistema de filtración a pequeña escala, utilizando la resina post-uso y recuperada. Para verificar la eficiencia del proceso se comparó la conductividad del agua con aquella proveniente de la resina comercial. Después de recuperada, se realizaron estudios de la capacidad de intercambio iónico de la resina mixta y de la aniónica, comercial y recuperada, frente a colorantes AM y AL en medio acuoso y a 25 °C de temperatura.
Los estudios de intercambio iónico se realizaron añadiendo en medio acuoso concentraciones fijas de resina en concentraciones variadas de colorante, con el sistema bajo agitación constante por 24 horas. Luego el sistema fue centrifugado por 20 minutos a 3000 rpm. Las cuantificaciones del colorante presentes en la fase acuosa fueron determinadas por espectrofotometría en la región del visible. La lectura para los ensayos de adsorción para AM se realizó en la longitud de onda de 670 nm, que corresponde a la longitud de máxima absorción de la especie monomérica de azul de metileno, y para los ensayos con AL 463 nm, que corresponden a naranja de metilo.
En el análisis de evaluación de la recuperación se realizaron las pruebas de espectro en la luz infrarroja con el objetivo de comparar las estructuras de las resinas estudiadas. Para esto se pulverizó las resinas con un mortero y luego se analizó en el espectrofotómetro FT-IR Spectrometer: Spectrum Two, PerkinElmer®.
Resultados
Uno de los parámetros para la evaluación de la viabilidad del proceso de recuperación fue la conductividad, que permite determinar cuantitativamente la presencia de iones en solución. El agua del grifo, que tiene iones disueltos, presentaba una conductividad de 207,4 μS cm-1. Después que el agua pasó por las columnas, conteniendo la resina comercial y la recuperada, la conductividad se redujo a 0,66 y 0,88 μS cm-1, respectivamente.
Los datos presentados son la media de 10 mediciones y el valor para el agua tratada con la resina recuperada está cerca del rango ideal para el agua desionizada (0,5 a 3,0 μS cm-1; Gehaka, 2013), como se puede ver en la Tabla 1.
Tabla 1. Conductividad del agua del grifo sin tratamiento y después del tratamiento con la resina comercial y recuperada.

La eficiencia del proceso se demuestra porque las resinas recuperadas, al ser aplicadas en los sistemas de deionización, reducen significativamente (99,6%) la conductividad del agua que entra al comienzo del proceso (207,4 μS cm-1).
Las isotermas de adsorción del azul de metileno con la resina mixta y la aniónica, comercial y recuperada, se presentan en las Figuras 1 y 2. Las isotermas presentan perfil de alta afinidad; la resina aniónica recuperada presentó un aumento del 22% de la capacidad máxima de adsorción del azul de metileno en relación a la resina comercial aniónica, como se observa en la Figura 1.
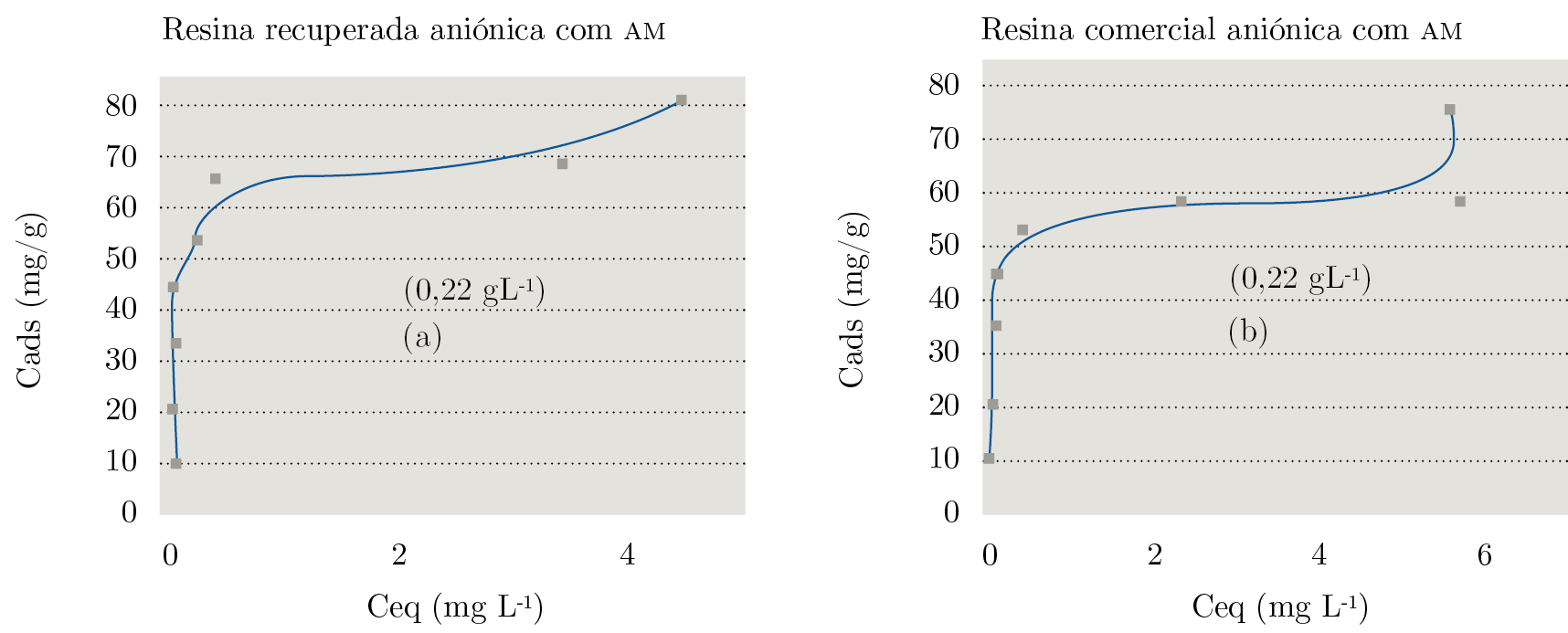
Figura 1. Adsorción del azul de metileno en las resinas aniónicas: (a) recuperadas, (b) comerciales. T = 27 °C; medio acuoso.
En la Figura 2 se presentan las isotermas de adsorción del colorante en la resina mixta recuperada y comercial. Se observa que la resina catiónica, cuando se ubica junto con la aniónica, presenta un perfil de alta afinidad para las bajas concentraciones del colorante, con una adsorción lenta en concentraciones del colorante mayores que 2,1 x 10-5 mol L-1 sin “plató” definido (Myers, 2003).
Contemplando que en 0,22 g de la mistura de la resina mixta (aniónica y catiónica) el 60% corresponde a la aniónica, la concentración máxima adsorbida es equivalente a la observada para la resina aniónica separada (Figura 1). Al contrario de la isoterma, que presenta un plato horizontal según el modelo de Giles, presentó un plato ascendente, que expresa que una segunda camada se forma antes del término de la primera monocamada. Ese efecto puede ser atribuido a la agregación del colorante en la superficie de la resina, lo cual se induce por la concentración de las moléculas de AM en solución.
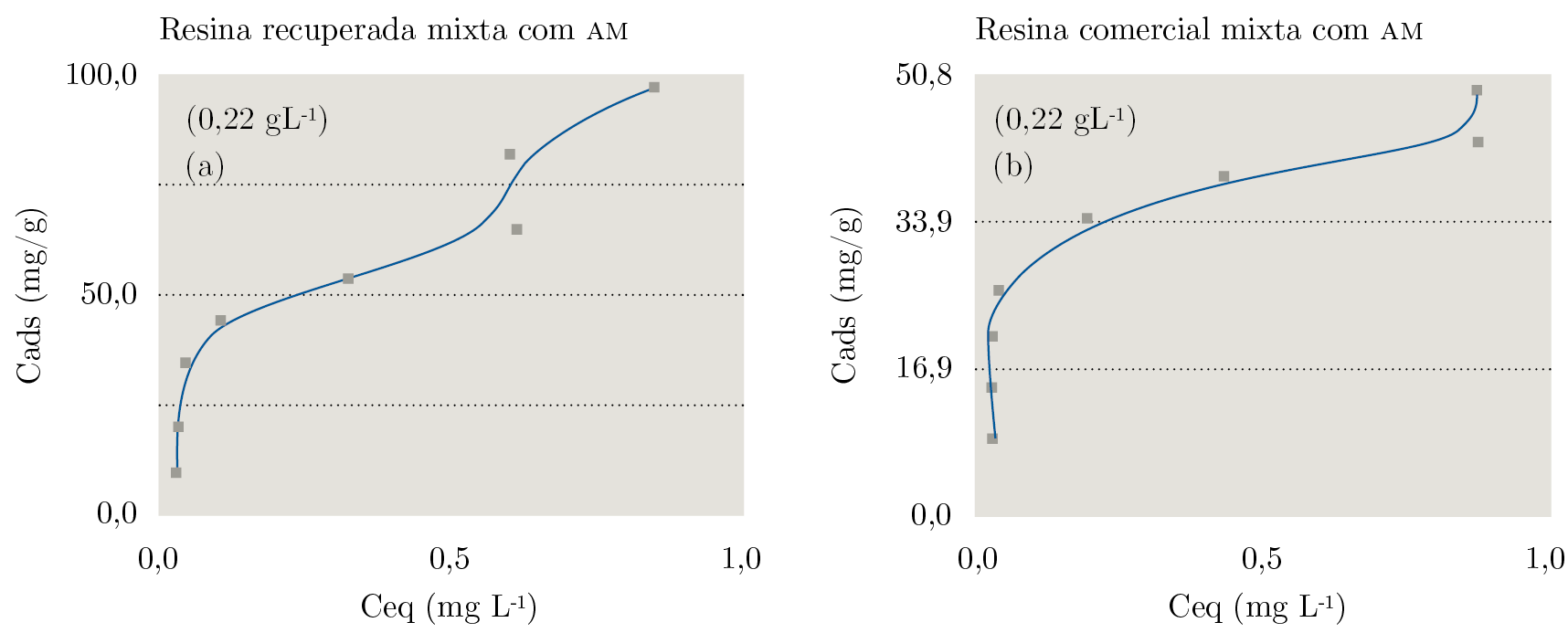
Figura 2. Adsorción del azul de metileno en las resinas mixtas (polifuncionales): a) recuperadas, b) comerciales. T = 27°C; medio acuoso.
Para las resinas catiónicas que en su matriz polimérica contienen cargas positivas se empleó el colorante aniónico naranja de metilo (AL). Las curvas que representan la relación de la composición del colorante agregado con la absorbancia del colorante que permanece en el sobrenadante se expresan en la Figura 3. Se observa que la resina recuperada presenta menor capacidad de adsorción en las concentraciones del colorante menores que 1,5 x 10-5 mol L-1 en relación con el comercial.
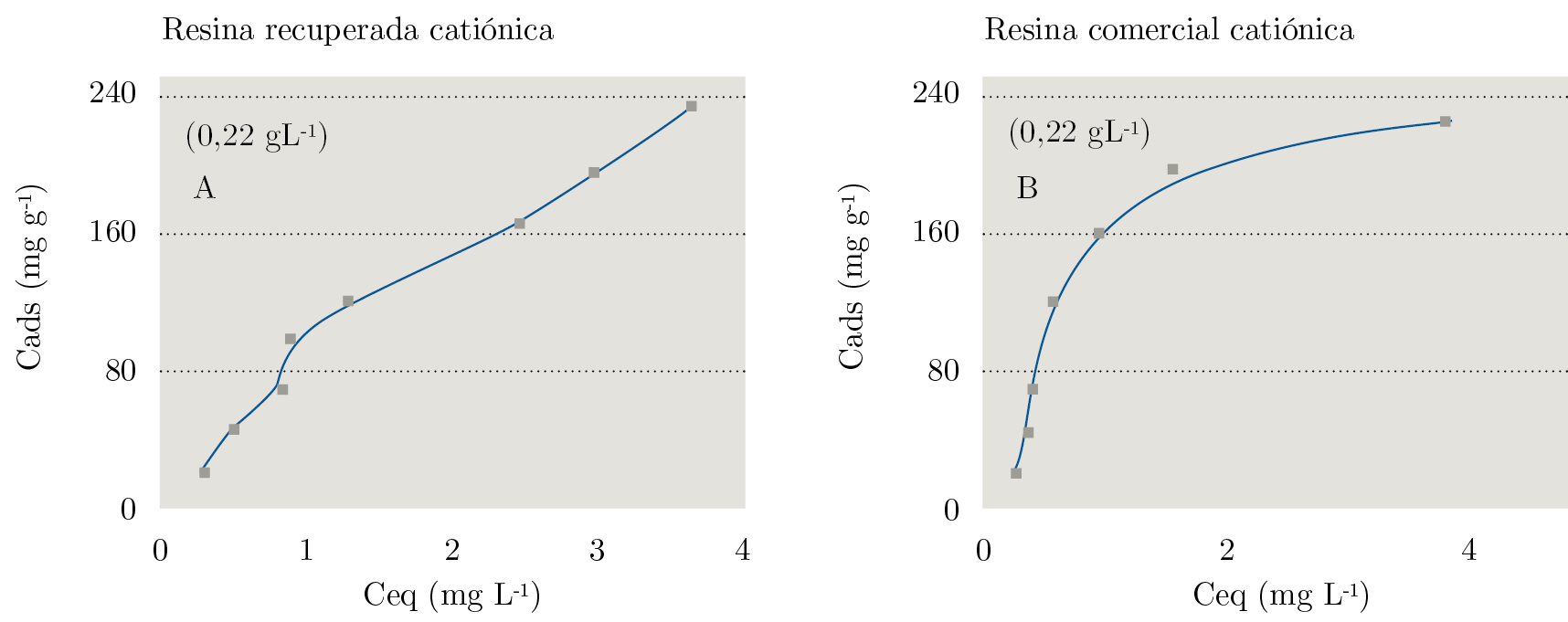
Figura 3. Adsorción del naranja de metilo en las resinas: A) catiónicas recuperadas, B) comerciales. T = 27 °C; medio acuoso.
Con el fin de obtener más datos y caracterizar el proceso adsortivo de las resinas comerciales y recuperadas, se aplicó a los datos obtenidos los modelos matemáticos de Langmuir y Freundlich. Además, se realizó una estimación de la capacidad máxima de retención de especies por las resinas (Sposito, 1989).
Cuando los modelos matemáticos linealizados de isotermas de adsorción se aplican a los datos experimentales obtenidos para la adsorción del azul de metileno en las resinas, solo el de Langmuir alcanza valores de coeficiente de correlación satisfactorios (R2 > 0,90, Tabla 2). Este modelo de isoterma considera la adsorción que ocurre en monocapa, donde la energía de los sitios de adsorción es homogénea durante el proceso adsortivo.
Tabla 2. Parámetros de Langmuir y Freundlich obtenidos por medio de las isotermas de adsorción de las resinas: catiónica comercial (C+) y recuperada (R+), aniónica comercial (C-) y aniónica recuperada (R-), T = 25 °C. Donde, R2: coeficiente de correlación; Qm: cobertura máxima de la monocapa; KL: cte. de Langmuir; n: reactividad de los lugares; Kf: capacidad de adsorción (cte. de Freundlich).
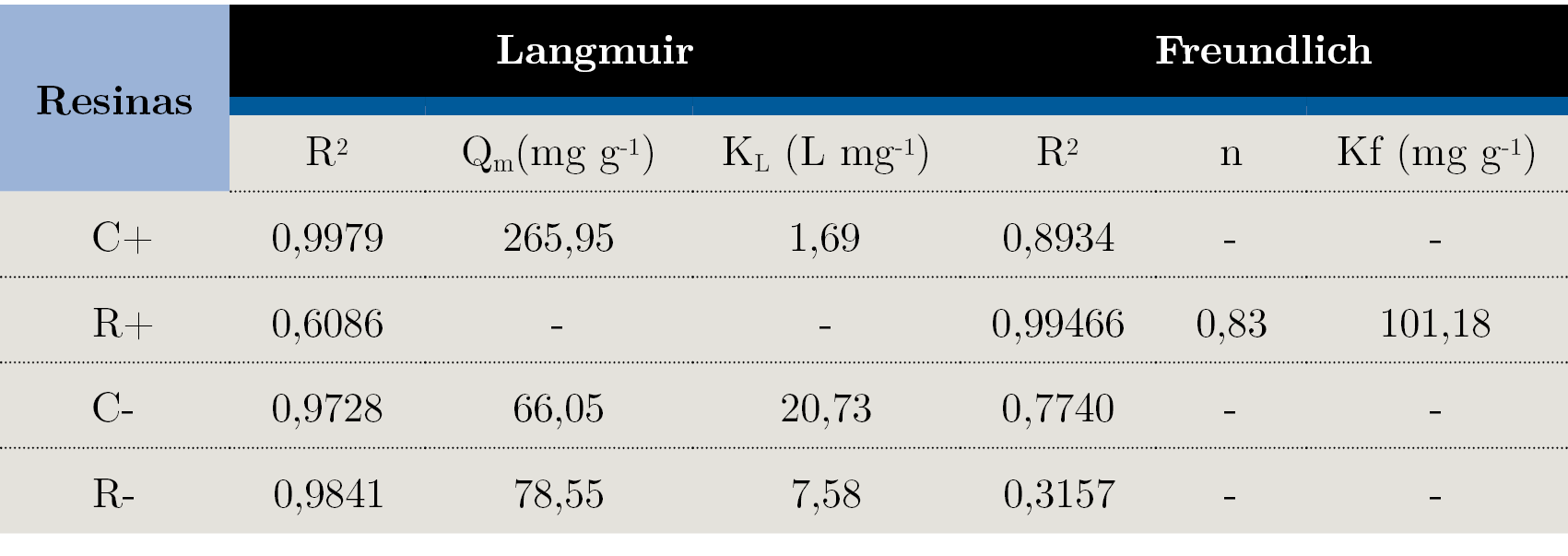
Se aplicaron los modelos matemáticos de Langmuir y Freundlich en las adsorciones realizadas con las resinas aniónicas y el naranja de metilo. Se observó que mientras la adsorción del azul de metileno en la resina aniónica, recuperada y comercial, presentó siempre correlación con la isoterma de Langmuir, las adsorciones realizadas con el naranja de metilo en las resinas catiónicas presentaron un perfil mixto. Mientras la comercial catiônica presentó perfil de la isoterma de Langmuir, la recuperada catiónica presentó perfil de la isoterma de Freundlich y menor eficiencia adsortiva.
La R+ posee una mayor correlación con el perfil de adsorción heterogéneo, a diferencia de las otras tres resinas estudiadas (C+, C-, R-, Langmuir). Para realizar una comparación global, se utilizan como dato común los factores encontrados en las ecuaciones 1 y 2, Qm y Kf, respectivamente. Ambos expresan un mismo sentido físico, la cantidad máxima adsorbida.
La constante de Langmuir, KL, que presentó la resina comercial catiónica, tuvo valores de cinco a veinte veces menores que los obtenidos con la resina comercial aniónica con azul de metileno. Esto demuestra que la interacción entre la resina comercial catiónica y el colorante naranja de metilo tiene menor afinidad que la resultante de la resina comercial mixta y aniónica con azul de metileno.
El parámetro n de la isoterma de Freundlich indica cualitativamente la reactividad de los sitios de conexión, así como la heterogeneidad del adsorbente. En el caso de la resina recuperada con naranja de metilo, el parámetro n menor que 1 indica que el proceso de adsorción ocurrió de forma física, sin reacciones químicas entre adsorbente y adsorbato y sin la formación de nuevas conexiones químicas. Además, la heterogeneidad del adsorbente es baja, pues cuanto más lejos de 1 está el parámetro n, más heterogénea se muestra la superficie del adsorbente.
Por último, en relación a las pruebas de infrarrojos, se presentan en la Figura 4 las curvas referentes a las resinas comerciales y recuperadas, aniónicas y catiónicas.

Figura 4. Resultados de infrarrojos para las resinas comerciales / recuperadas aniónica / catiónica.
En la Figura 4 se presentan los espectros en la región del infrarrojo de la resina comercial mixta separada y de las resinas que sufrieron el proceso de recuperación. En las resinas aniónicas se evidencian las bandas alrededor de 3420 cm-1, referentes a los grupos sulfonatos presentes en el poliestireno sulfonato de sodio (PSSNa) (Souza, 2014). En contraste, en las resinas catiónicas la banda ancha en torno a 3365 cm-1 y la banda de menor intensidad en 3024 cm-1 son características de las aminas cuartenarias presentes en el hidróxido de trimetilamina quartenizado (HTQ), que se halla en las resinas de carga positiva (Dow, 2018).
La resina comercial mixta presenta una banda ancha en 3360 cm-1, resultado de la suma de las intensidades de las bandas evidenciadas en las resinas aniónicas y catiónicas.
La Figura 5 compara las resinas recuperadas y comerciales. Se observa que no existen diferencias significativas en el número de onda de las bandas, lo que indica que no ocurrió modificación química a partir de la aplicación del proceso de recuperación:
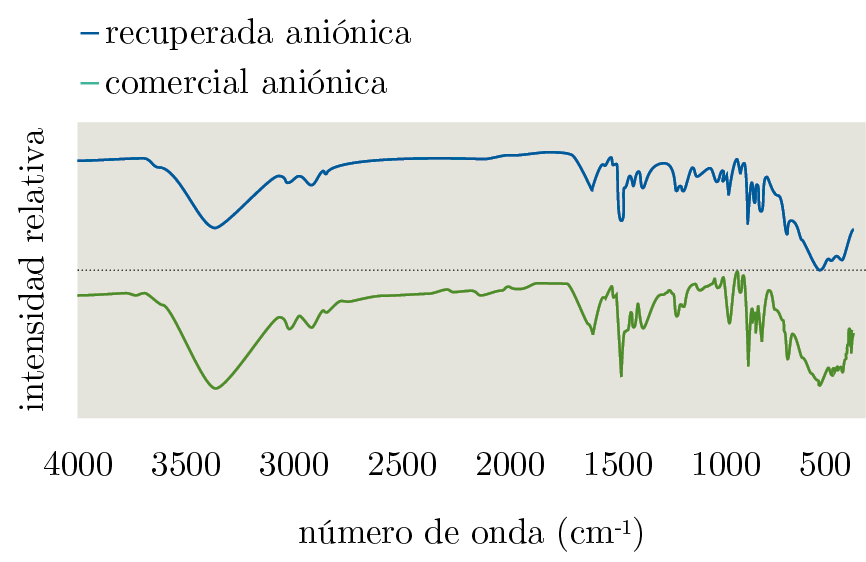
Figura 5. Comparación entre la resina comercial y recuperada aniónica.
Conclusiones
Este trabajo que comenzó en 2015 ha mostrado datos satisfactorios desde su comienzo, pues el proceso empleado para la recuperación es viable.
La recuperación propuesta proporcionó un aumento en la capacidad adsortiva en relación a la resina comercial, dado que una de las resinas recuperadas, la aniónica, presenta capacidad adsortiva un 22% mayor. La recuperación no causó modificación en la estructura química, lo que indica solo una modificación física en la superficie de la resina y ocasiona el aumento de la capacidad adsortiva observada.
Además, cumple con el compromiso económico y ambiental propuesto por el proyecto, dado que utiliza una cantidad mínima de agua desmineralizada para el tratamiento, además de permitir que lo que se obtenga hasta aquí sea expandido a trabajos futuros que utilicen las resinas recuperadas para descontaminación de contaminantes emergentes en aguas, como el herbicida paraquat y el fármaco diclofenaco.
Reconocimientos
Laboratório de Fotoquímica (LFQ), PET - Programa de Ensino Tutorial/MEC (Ministério de Educação e Cultura), Capes - Coordenação de Aperfeiçoamento de Pessoal de Nível Superior, Universidade Estadual Paulista “Júlio de Mesquita Filho” – Instituto de Biociências, Letras e Ciencias Exatas (UNESP/Ibilce).
