Autores
- Machado, Ignacio (1); Tissot, Florencia (1); Bühl, Valery (1); Santander, Jessica (1); Falchi, Lucía (1); Chambón, Jessica (1)
- Grupo de Análisis de Elementos Traza y Desarrollo de Estrategias Simples para Preparación de Muestras (GATPREM), Área de Química Analítica, Departamento Estrella Campos, Facultad de Química, Universidad de la República, Montevideo, Uruguay.
Moringa stenopetala es una gran fuente de nutrientes utilizada para alimentación humana y animal. Este hecho inspiró el estudio de su composición química en lo que respecta al contenido de minerales y vitamina C. Las determinaciones analíticas de metales se realizaron mediante espectrometría de absorción atómica de llama. Para las determinaciones de vitamina C se utilizó cromatografía líquida con detector de arreglo de diodos. Se evaluó la disponibilidad de nutrientes en infusiones mediante el cálculo de factores de transferencia desde las matrices sólidas. Luego de analizar varias marcas comerciales, se pudo observar una mayor variabilidad en el contenido de elementos como hierro, magnesio y sodio. Se destacó un alto contenido de calcio en las muestras, pero con bajo factor de transferencia a las infusiones. En el caso de la vitamina C, se evidenció una gran pérdida durante la preparación de las infusiones debido a la descomposición térmica. Moringa stenopetala sería un interesante suplemento natural beneficioso para la salud, sobre todo consumido en base fresca, rico en calcio, potasio, magnesio y vitamina C, en cantidades similares a las presentes en alimentos recomendados como fuente de estos nutrientes por excelencia.
Palabras clave: Moringa stenopetala, nutrientes, análisis elemental.
Introducción
Moringa stenopetala es un árbol tropical perteneciente a la familia Moringaceae, nativa de Etiopía, Kenia y Somalia. Estos cultivos fueron introducidos en América Central (Nicaragua, Honduras) en 1920, principalmente como plantas ornamentales y cercos vivos. También se han extendido a Colombia, Venezuela y Paraguay, donde las condiciones son propicias para su desarrollo. En Uruguay existen pequeños emprendimientos particulares que se dedican al cultivo de Moringa stenopetala a partir de semillas importadas (FAO, 2018; Olson, 2017; Alegbeleye, 2017).
Se trata de una especie multipropósito utilizada para alimentación humana y animal, que posee diversos usos a nivel agrícola, industrial y medicinal. Es muy apreciada como alimento por ser fuente de minerales, carbohidratos, aminoácidos esenciales y vitaminas. Se consumen tanto las hojas frescas como sus respectivas infusiones (Fekadu, et al., 2017; Melesse, et al., 2012; Gebregiorgis, et al., 2012).
Además de su rápido crecimiento, resistencia a la sequía y a diferentes plagas, ofrece muchas ventajas de subsistencia a los agricultores. Una planta de Moringa stenopetala puede mantener a una gran familia durante varios años. Las hojas verdes están disponibles durante la mayor parte del año, incluso durante la estación seca. Se pueden consumir en ensaladas, lo cual es importante en regiones donde las verduras escasean. Asimismo, la corteza es utilizada como condimento en las comidas (Gebregiorgis, et al., 2012).
Las semillas también son utilizadas como alimento y condimento en muchos países asiáticos y africanos, así como en bebidas preparadas en medicina popular. Estas contienen 40% en peso de aceite de alta calidad y con valor culinario, y también es utilizado como ingrediente principal para la fabricación de jabones (Abuye, et al., 2003).
Las raíces de la planta se usan a menudo para tratar la malaria y otros problemas de salud. Diversos informes también han demostrado actividades medicinales de las hojas, por ejemplo: anti-Leishmaniasis, anti-Tripanosomiasis y anti-diabetes (Fekadu, et al., 2017; Toma, et al., 2014; Toma, et al., 2015). En particular, las personas con hipertensión arterial suelen beber infusiones acuosas de las hojas para obtener alivio de los síntomas. Otros estudios han reportado la potencial actividad diurética de las infusiones de las hojas, así como el alivio de ciertos trastornos estomacales y de los síntomas del asma (Seifu, 2014; Gebregiorgis, et al., 2012; Saucedo-Pompa, et al., 2018).
En algunos países africanos suelen utilizarse las hojas como forraje para mejorar la productividad de pequeños rumiantes, sobre todo cuando la calidad y la cantidad de forraje son limitadas. Sin embargo, esto no es muy bien visto por la población, ya que las hojas son muy apreciadas como alimento y suplemento dietético. Por este motivo se prefiere destinar las vainas y no las hojas para la alimentación animal (Debela, et al., 2013). Los beneficios nutricionales de Moringa stenopetala están poco difundidos al momento en Uruguay. Este hecho inspiró el estudio de esta matriz de forma de proporcionar información sobre la composición química de este alimento de origen vegetal no convencional. En este sentido, el objetivo principal del trabajo fue la determinación del valor nutricional de Moringa stenopetala en lo que respecta al contenido de micro y macronutrientes esenciales como calcio (Ca), magnesio (Mg), cobre (Cu), hierro (Fe), potasio (K), zinc (Zn) y vitamina C. A su vez, se realizó una comparación contra los respectivos valores encontrados en la literatura en los alimentos usualmente recomendados como fuente de estos nutrientes (USDA, s.d.).
Materiales y Métodos
Reactivos
Para las determinaciones de metales se utilizaron soluciones estándar para absorción atómica de 1000 mg L-1 de Ca, Cu, Fe, K, Mg, Na y Zn (Merck, Alemania). Las curvas de calibración fueron preparadas mediante dilución apropiada de la correspondiente solución stock, utilizando agua ultrapura de resistividad 18,2 MΩcm (ASTM Tipo I), obtenida mediante un purificador Millipore Simplicity 185 (São Paulo, Brazil). Todo el material de vidrio se descontaminó con ácido nítrico 10% v/v, preparado a partir de HNO3 concentrado (67% v/v, Merck, Alemania) y luego se enjuagó exhaustivamente con agua ultrapura previo a su uso.
Las determinaciones de vitamina C se realizaron bajo la forma de ácido ascórbico. Para ello se utilizó una solución estándar de 1000 mg L-1 preparada a partir de ácido L-ascórbico (99%, Sigma-Aldrich, EUA) en agua ultrapura. Para las extracciones se utilizó ácido fosfórico 0,5 %v/v preparado a partir de H3PO4 concentrado (85% v/v, Merck, Alemania).
Muestras
Un total de 15 muestras de Moringa stenopetala fueron adquiridas en mercados locales de Montevideo, Uruguay. A los efectos de su acondicionamiento, todas las muestras tomadas en su estado original fueron secadas en estufa (Daihan Scientific ON-50, EUA) a 105 °C, trituradas y guardadas a 20 °C en ausencia de luz.
Para la optimización y la evaluación de la veracidad y precisión de las metodologías analíticas se utilizaron dos materiales de referencia certificados: hojas de manzana (SRM NIST 1515) y coles de Bruselas (CRM BCR 431).
Preparación de las muestras para la determinación de metales y vitaminas
Para las determinaciones de metales se llevaron a cabo digestiones ácidas asistidas por microondas (CEM Mars 6, EUA). Para ello se pesaron 0,5 g de muestra en vasos de reacción EasyPrep Plus® y se agregaron 10,00 mL de HNO3 50% v/v. La programación de temperatura fue la siguiente: potencia 400-1800 W, rampa de temperatura: 15 min hasta alcanzar 200 °C, 10 min a 200 °C, presión 500 psi. Se realizaron blancos de reactivos junto con las muestras. El método consistió en una digestión total, que a su vez es considerada como método de referencia.
Para las determinaciones de vitamina C (expresada como ácido ascórbico) se realizaron extracciones sólido-líquido utilizando como solvente extractante H3PO4. Para ello se pesaron 0,2 g de muestra y se agregaron 2,0 mL de H3PO4 0,5% v/v a pH=2,81. Las suspensiones obtenidas fueron agitadas en vórtex (Qilinbeier 5, China) durante 1 minuto y luego centrifugadas (Luguimac LC-15, Argentina) a 3700 rpm durante 15 minutos.
Preparación de las infusiones para la determinación de metales y vitaminas
A los efectos de evaluar la disponibilidad de nutrientes y teniendo en cuenta las formas de consumo, se prepararon las infusiones correspondientes colocando 2,0 g de muestra en un recipiente tipo Pyrex® junto con 250,0 mL de agua ultrapura a 100 °C y dejando reposar durante 5 minutos. Inmediatamente se filtraron utilizando papel de filtro tipo Whatman No. 541. Luego se realizaron las determinaciones analíticas mediante absorción atómica y cromatografía líquida, y se calculó el factor de transferencia de los diferentes nutrientes desde la matriz sólida como: Factor de transferencia (%) = (concentración en infusión por unidad de masa/concentración en base seca) x 100.
Determinaciones analíticas
Para las determinaciones analíticas de Ca, Cu, Fe, K, Mg, Na y Zn se utilizó un espectrómetro de absorción atómica de llama Perkin Elmer AAnalyst 200 (Norwalk, CT, EUA) equipado con un quemador de 10 cm y operado a las líneas analíticas de 422,67 nm (Ca), 324,75 nm (Cu), 248,33 nm (Fe), 766,49 nm (K), 285,21 nm (Mg), 589,00 nm (Na) y 213,86 nm (Zn), respectivamente. Las lámparas de cátodo hueco utilizadas (Photron, Australia) fueron operadas según las recomendaciones del fabricante. Se utilizó gas acetileno (Linde, Montevideo, Uruguay) como combustible. La composición de la llama fue acetileno (2,5 L min-1) - aire (10,0 L min-1).
Para la determinación de vitamina C (expresada como ácido ascórbico) se empleó cromatografía líquida con detector de arreglo de diodos (Agilent 1260 Infinity), utilizando como fase móvil una mezcla de ácido fosfórico 0,5% v/v: acetonitrilo (95:5) a un flujo de 0,7 mL min-1 en modo isocrático. Como fase estacionaria se utilizó una columna Zorbax Eclipse Plus C18 (4,6 x 250 mm, 5 µm) (Agilent, EUA). La longitud de onda de trabajo fue 254 nm.
Discusión
Los experimentos de optimización para la determinación de metales fueron realizados utilizando el SRM de hojas de manzana. La cantidad de muestra a pesar y el volumen de ácido a agregar para la extracción fueron determinados considerando los rangos de concentración de los diferentes elementos informados en el certificado del SRM. Con este criterio, todos los analitos se encontraron en un nivel adecuado para realizar tratamientos de muestra simultáneos. Una masa de 0,5 g y un volumen de ácido de 10,0 mL resultaron el mejor compromiso obtenido para llevar a cabo el método propuesto para la determinación de todos los elementos en estudio, en las muestras analizadas y en una única extracción. Los elementos Ca, K, Mg, Na y Zn requirieron una dilución posterior con agua ultrapura. Los experimentos de optimización para la determinación de vitamina C (expresada como ácido ascórbico) fueron realizados utilizando el CRM de coles de Bruselas, que declaraba los valores certificados para este analito.
La validación fue llevada a cabo en las condiciones experimentales descriptas para cada tratamiento en la sección Materiales y Métodos. La veracidad y la precisión fueron evaluadas mediante la aplicación de los métodos seleccionados utilizando el material de referencia correspondiente (n = 6). Los métodos optimizados y validados fueron luego aplicados al análisis de muestras comerciales de Moringa stenopetala.
Después de realizar una prueba t de Student, todos los valores experimentales de t se encontraron por debajo del valor teórico de t (0,05, 5) = 2,57. Por lo tanto, pudo concluirse que a un nivel de significancia del 95% las concentraciones obtenidas utilizando los métodos desarrollados no diferían significativamente de los respectivos valores certificados, con lo cual la veracidad de ambos métodos fue asegurada.
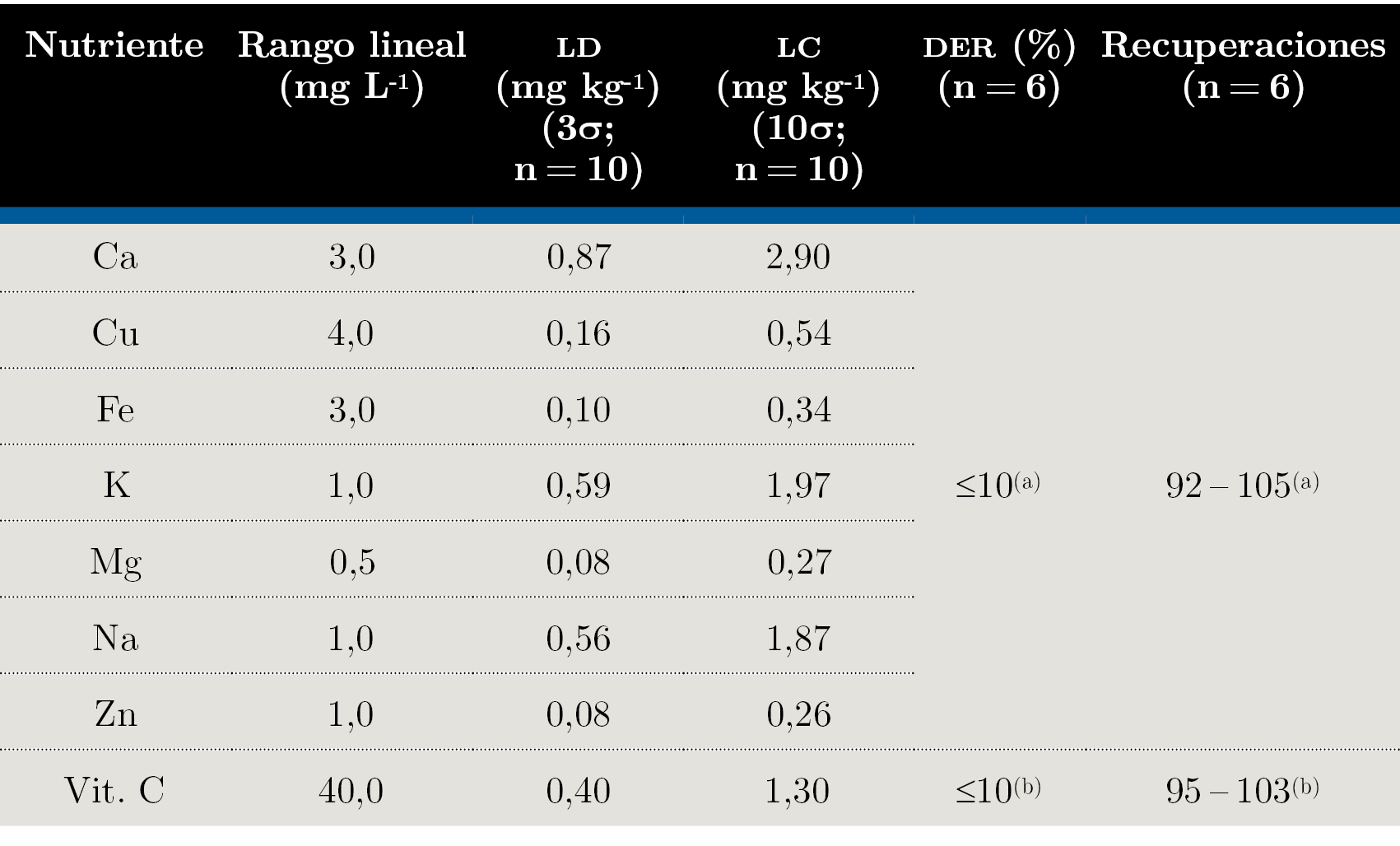
La linealidad fue determinada mediante inspección visual de las curvas de calibración, valor del coeficiente de correlación (r2) y el estudio de aleatoriedad de los residuales. Los coeficientes de correlación de las regresiones lineales obtenidos luego de realizar las curvas de calibración fueron mayores a 0,99 para todos los analitos en estudio. Los rangos lineales se pueden apreciar en la Tabla 1. Los límites de detección (LD) y cuantificación (LC) fueron expresados como el contenido del analito correspondiente a tres y diez veces la desviación estándar del blanco, respectivamente (Tabla 1). La precisión expresada como DER (%) (desviación estándar relativa porcentual) fue estudiada utilizando los materiales de referencia certificados y las muestras de Moringa stenopetala. Se obtuvieron valores menores al 10% para todos los analitos en estudio.
Tabla 1. Principales parámetros de desempeño estudiados. (a) SRM NIST 1515, (b) CRM BCR 431.
En la Tabla 2 se aprecian los rangos de concentración obtenidos para Ca, Cu, Fe, K, Mg, Na, Zn y Vit. C en las muestras comerciales de hojas de Moringa stenopetala analizadas utilizando las metodologías validadas.
Tabla 2. Rangos de concentración obtenidos para cada analito en las muestras analizadas (expresados en base seca).
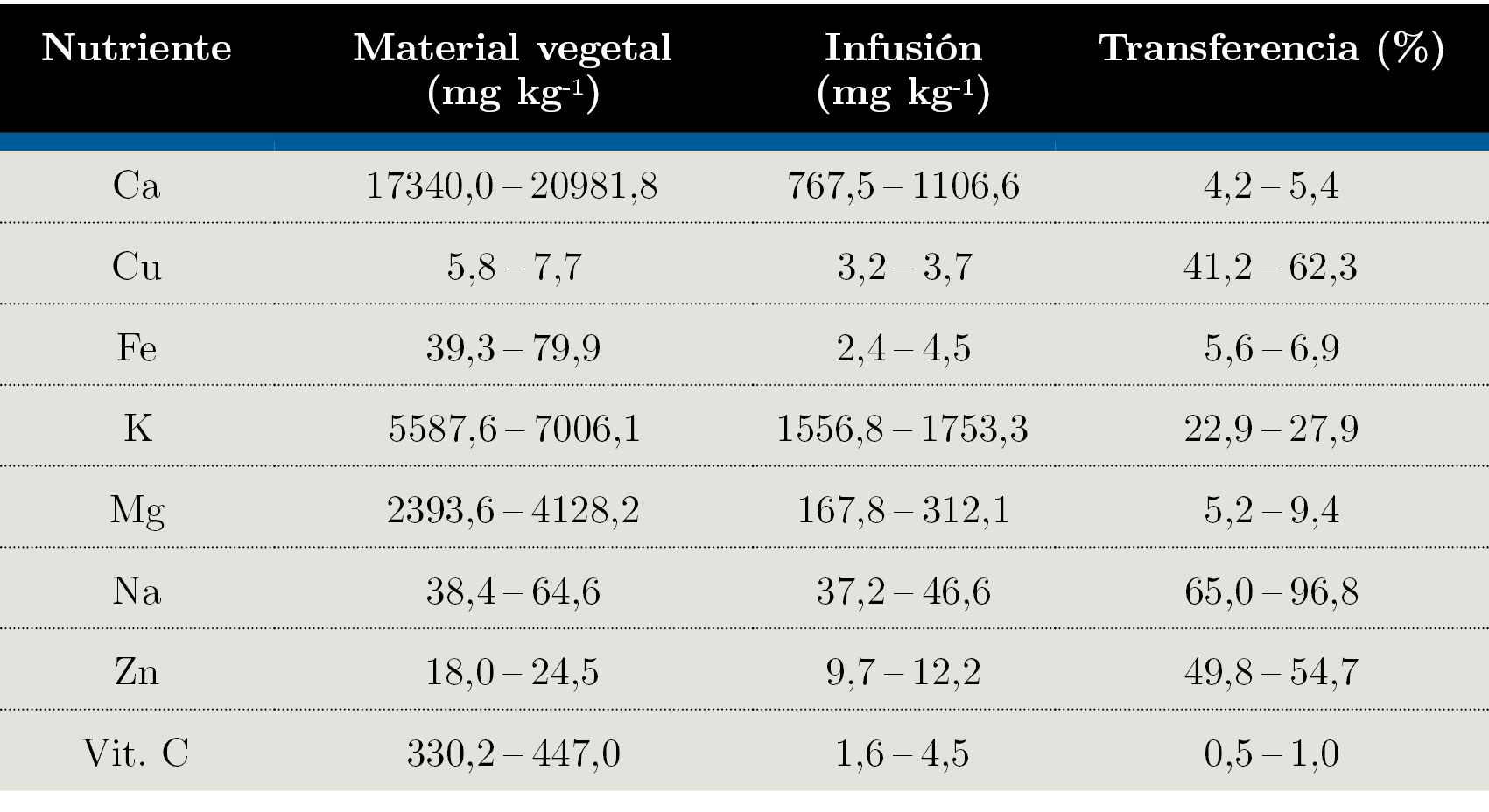
Las diferencias encontradas en la literatura respecto al contenido de elementos metálicos en este tipo de cultivos puede deberse a varios factores: el origen geográfico, el medio de cultivo, los nutrientes, el uso de fertilizantes, el tiempo de siembra, el tipo de suelo y el momento de colecta. Las tasas de absorción, translocación y retención de metales varían fuertemente entre las distintas poblaciones, dependiendo de la tolerancia y la fisiología. La mayoría de las plantas restringen el movimiento de los iones metálicos en los tejidos fotosintéticos, regulando el transporte a través de la endodermis y removiendo cualquier ion móvil por medio del almacenamiento en las paredes celulares y en las vacuolas o mediante la unión a metalotioneínas o fitoquelatinas (Colangelo, et al., 2006).
De acuerdo con el contenido de metales hallado, los valores de concentración obtenidos para todos los analitos están en muy buen acuerdo con los reportados en la literatura (Hamza, et al., 2017; Kumssa, et al., 2017).
Luego de analizar varias marcas comerciales se pudo observar una mayor variabilidad en el contenido elemental de Fe, Mg y Na entre las diferentes muestras. Los valores de concentración más altos encontrados fueron para Ca, un orden mayor respecto a K y Mg, tres órdenes respecto a Fe, Na y Zn, y cuatro órdenes respecto a Cu. Moringa stenopetala podría considerarse como una fuente promisoria para cubrir los niveles de elementos esenciales de la ingesta diaria recomendada, y en particular sería una buena fuente de elementos como Ca y Mg. A modo de ejemplo, los requerimientos diarios de Ca de un niño de entre 1 y 3 años estarían cubiertos con 100 g de hojas frescas. En este sentido, las hojas de Moringa stenopetala podrían destacarse como suplemento alimenticio para mitigar las deficiencias de nutrientes esenciales.
Sin embargo, a pesar del alto contenido de Ca se observó un bajo factor de transferencia a las infusiones, y algo similar ocurrió con el Mg, posiblemente por la forma en que estos elementos se unen a la matriz. Esto pone de manifiesto el consumo de la hoja fresca en lugar de las infusiones para obtener mayores beneficios. De forma similar, en el caso de la vitamina C se evidenció una gran pérdida durante la preparación de las infusiones debido a que ésta se descompone a altas temperaturas.
Las hojas de Moringa stenopetala serían un interesante suplemento natural para la salud, sobre todo consumidas en base fresca, por ser ricas en Ca, K, Mg y Vit. C, en cantidades similares a las encontradas en los alimentos usualmente recomendados como fuente de estos nutrientes. Contienen niveles de Ca similares a los encontrados en leche de vaca, niveles de Vit. C similares a los reportados en naranjas y niveles de K similares a los hallados en bananas (Hamza, et al., 2017).
Conclusiones
En este trabajo fueron optimizados y validados dos métodos simples de preparación de muestras para la extracción y subsecuente determinación de Ca, Cu, Fe, K, Mg, Na, Zn y Vit. C en hojas de Moringa stenopetala.
Los niveles encontrados en las muestras analizadas ponen de manifiesto la importancia desde el punto de vista nutricional de esta especie vegetal como fuente de aporte de Ca, K, Mg y Vit. C a la dieta, en cantidades similares a las encontradas en alimentos ricos en estos nutrientes, principalmente cuando es consumida en base fresca.
Reconocimientos
Los autores agradecen a la Agencia Nacional de Investigación e Innovación (ANII) y al Programa de Desarrollo de las Ciencias Básicas (PEDECIBA-Química).
Referencias
